不同茶叶中游离氨基酸的对映异构体
2021-03-08朱荫张悦严寒吕海鹏林智
朱荫,张悦,严寒,吕海鹏,林智
不同茶叶中游离氨基酸的对映异构体
朱荫,张悦,严寒,吕海鹏,林智
中国农业科学院茶叶研究所/农业部茶树生物学与资源利用重点实验室,杭州 310008
【】游离氨基酸是茶叶的主要化学成分之一,与茶叶的滋味品质密切相关。大多数氨基酸具有手性中心,因此存在滋味特性及生理活性均可能截然不同的L型和D型两种对映异构体。由于检测技术的限制,过去的研究多集中在L型氨基酸上,而茶叶中D型氨基酸罕有系统的研究报道。因此,研究茶叶中游离氨基酸对映异构体,对茶叶化学理论体系的深化及滋味品质的提升与调控具有重要的推进作用。采用手性HPLC法、MTBSTFA硅烷衍生化法和酯化-PFP酰化法3种不同的分析方法对比茶叶中游离氨基酸对映异构体的分离性能,结果表明采用酯化-PFP酰化法结合手性气相色谱-质谱联用技术(gas chromatography-mass spectrometry,GC-MS),可实现茶叶中丙氨酸、缬氨酸、苏氨酸、脯氨酸、亮氨酸、异亮氨酸、丝氨酸、半胱氨酸、天冬氨酸、蛋氨酸、苯丙氨酸、谷氨酸、酪氨酸、赖氨酸及色氨酸等15种重要游离氨基酸对映异构体的有效分离。继而建立茶叶中游离氨基酸对映异构体的高效衍生化及定性定量分析方法,并查明市售11种代表性白茶、乌龙茶及普洱茶中游离氨基酸对映异构体的分布规律。衍生化条件为:将氨基酸反应液在100℃下酯化105 min,继而以四氢呋喃为反应溶剂,在100℃下五氟丙酰化10 min。游离氨基酸对映异构体的回收率介于75.26%—123.6%(低浓度)、81.23%—121.8%(高浓度),RSD值介于2.09%—13.12%(低浓度)、1.48%—10.59%(高浓度)。茶样分析结果表明,大部分氨基酸的1—2个对映异构体可以在茶样中检测出,且D-氨基酸普遍存在于茶样中,尤其是D-苏氨酸、D-天冬氨酸、D-半胱氨酸、D-苯丙氨酸、D-茶氨酸、D-谷氨酰胺及D-谷氨酸混合物在大部分茶样中均有分布,而D-蛋氨酸、D-赖氨酸及D-色氨酸在所有茶样中均未被检测出。在具体含量分布上,除了L-茶氨酸、L-谷氨酸及L-谷氨酰胺混合物之外,L-半胱氨酸(1.48—2.08 mg∙g-1)、D-半胱氨酸(1.46—1.49 mg∙g-1)、L-丝氨酸(0.15—1.80 mg∙g-1)及D-天冬氨酸(1.02—1.14 mg∙g-1)在白茶中的含量普遍较高;L-半胱氨酸(1.52—1.70 mg∙g-1)、D-半胱氨酸(1.45—1.49 mg∙g-1)、L-丝氨酸(1.03—1.50 mg∙g-1)、L-蛋氨酸(1.03—1.52 mg∙g-1)、L-酪氨酸(1.32—1.35 mg∙g-1)及D-天冬氨酸(1.01—1.15 mg∙g-1)在乌龙茶中具有较高含量。在普洱茶中,L-茶氨酸、L-谷氨酸及L-谷氨酰胺混合物的含量(1.04 mg∙g-1)与其他氨基酸相比并无显著性差异,而L-苏氨酸、L-色氨酸及L-丝氨酸含量较高,介于0.61—0.84 mg∙g-1。在氨基酸总量上,各茶类呈现出白茶(最高为40.61 mg∙g-1)>乌龙茶(最高为25.43 mg∙g-1)>普洱茶(8.01 mg∙g-1)的分布规律。多元统计分析结果表明,L-茶氨酸、L-谷氨酸及L-谷氨酰胺混合物、L-色氨酸及L-天冬氨酸在部分白茶中的含量显著高于乌龙茶,而L-酪氨酸与L-蛋氨酸则在乌龙茶中含量较高。D-氨基酸存在于大部分茶叶中,对茶汤滋味品质存在潜在影响,但在本研究样例中,D-氨基酸的含量分布在不同茶类间未表现出显著性差异。
茶叶;游离氨基酸;对映异构体;气相色谱-质谱联用技术;五氟丙酸酐
0 引言
【研究意义】氨基酸是茶叶中的主要化学成分之一,与茶叶的滋味及香气形成均有密切的关系[1]。目前在茶叶中发现并鉴定的氨基酸约有26种,其中茶氨酸约占游离氨基酸总量的50%—60%,是茶汤鲜味的主要呈味因子;谷氨酸和天冬氨酸是茶叶中重要且含量高的一类氨基酸,是构成茶叶鲜爽滋味的重要成分;苯丙氨酸、色氨酸、精氨酸等则呈现甜味口感,对茶汤滋味有益[2]。大部分天然氨基酸具有手性中心,存在D和L两种构型,它们的生理活性截然不同。研究发现,部分D构型氨基酸有十分理想而特别的滋味,而其相应的L构型氨基酸却有着令人不悦的滋味[3-5]。尤其是D-色氨酸、D-苯丙氨酸、D-组氨酸、D-酪氨酸及D-亮氨酸分别呈现出高于蔗糖35、7、7、6及4倍的甜味[3]。由此可知,如果茶叶中存在D构型氨基酸,那它们对茶汤滋味的影响应该与相应的L构型有较大差异,因此,茶叶中游离氨基酸对映异构体研究具有重要的研究价值。【前人研究进展】近几年来,随着分析技术的飞速发展,茶叶中的D-氨基酸也引起了研究者的一定关注。研究发现在白茶[6]、绿茶[7]、乌龙茶及部分红茶中[8]均存在较高含量的D-茶氨酸,茶叶萎凋、储藏过程以及碱化处理可促进D-茶氨酸的生成,且D-茶氨酸的比例与茶叶的等级存在一定的相关性[8-9]。另一方面,在检测方法上,国内外均已采用不同的分析手段对茶叶中茶氨酸对映异构体进行了研究,如高效液相色谱(High Performance Liquid Chromatography,HPLC)/大气压电离质谱法[10]、配体交换色谱手性固定相法拆分法[11]、配体交换色谱手性流动相法[12]及手性衍生-高效液相色谱法拆分法[13]等,均在不同程度上检测出D-茶氨酸的存在。然而,相比D-茶氨酸,茶叶中其他重要D-氨基酸的研究进展缓慢。近期,研究者采用离线二维液相色谱[14]及手性液相色谱-飞行时间质谱技术[15]查明了茶叶中多种D-氨基酸的含量分布情况。除此之外,茶叶领域少有相关研究报道。手性固定相拆分法是手性色谱发展的前沿领域,也是手性色谱发展的关键和核心,其特点是使用方便,一般不需要高光学纯的手性衍生试剂,制备分离便利。手性固定相拆分法在HPLC及气相色谱法中均有所应用,在液相色谱法中,最常使用的是手性配体交换型和环糊精型固定相,前者往往需要引入二价铜离子,分离效果受流动相pH、金属离子浓度等的影响大[16];后者虽然有多种环糊精结构可供选择,但每种结构分离效果单一,拆分适用范围窄,需多种结构的环糊精联用才能达到较好分离效果,操作繁琐复杂[17]。而近年来新发展的手性冠醚固定相适用范围广,操作方便快捷,无需引入额外的衍生剂或金属离子,具有很强的实用性和可操作性[18]。除了最广泛使用的HPLC外,气相色谱-质谱联用技术(gas chromatography- mass spectrometry,GC-MS)也是常用的氨基酸分析方法,该方法具有柱效高、分析速度快、易于定量且具有可供参考的标准谱图库等优点[19]。由于氨基酸含有氨基、羧基和羟基等极性基团,因此首先需要将氨基酸衍生为易于汽化的衍生物,然后再进行分离检测。目前氨基酸柱前衍生主要有硅烷化[20]、酯化-酰化两步法[21]等方法。氨基酸的酯化和酰化又合称为两步法,先将羧基用短碳链脂肪醇酯化,然后再用各种酸酐将N-(O,S)基团乙酰化[22],常用的衍生试剂有三氟乙酰、五氟丙酸酐(pentafluoropropionic anhydride,PFPA)、正丙醇、七氟丁酰和异丙醇等。【本研究切入点】由于各氨基酸对映异构体与手性固定相的作用力差别迥异,且茶汤属于复杂化学体系,很难在一个手性色谱体系中将众多氨基酸对映异构体完全分析,因此游离氨基酸的对映异构体研究具有较大的挑战性。拟采用3种不同的手性分析方法对茶叶中常见游离氨基酸进行对映异构体分离,对可分离的对映异构体数量、分离度、分析时间以及操作可行性等进行综合比较,继而优化茶叶中游离氨基酸的提取或衍生化方法,从而建立茶叶中游离氨基酸对映异构体的理想分析方法。【拟解决的关键问题】查明不同种类茶叶中游离氨基酸的对映异构体分布情况,以期为茶叶风味品质的形成机理研究、加工工艺的提高与定向调控等提供科学的参考依据。
1 材料与方法
1.1 试验时间
本研究于2017—2018年在中国农业科学院茶叶研究所进行。
1.2 试验材料与仪器
茶叶样品为各地市场采集或自行制备,白茶样品5个:白毫银针(BHYZ)、白牡丹(BMD-1,BMD-2)2个、寿眉(SM)、印尼白毫银针(YNBHYZ);乌龙茶样品5个:肉桂(RG)、大红袍(DHP)、铁观音(TGY-1,TGY-2)2个、水仙(SX);黑茶样品1个:普洱(PE)。以上茶样均用研磨机磨粉过40目筛后0—4℃下保存备用,取等量混合样用于分析方法建立、优化以及验证等。
氨基酸标准品:D、L、DL-型天冬氨酸,精氨酸、苯丙氨酸、酪氨酸、谷氨酸、谷氨酰胺、丙氨酸、苏氨酸、色氨酸、丝氨酸、缬氨酸、赖氨酸、胱氨酸、半胱氨酸、亮氨酸、鸟氨酸、组氨酸、精氨酸及L-茶氨酸购自北京百灵威科技有限公司,DL-茶氨酸购自成都博瑞特化学技术有限公司,2.5 μmol∙mL-1的氨基酸标准品盐酸混合溶液购自美国默克公司。
化学试剂:70%高氯酸水溶液(pH 2.0)、PFPA购自上海阿拉丁公司,异丙醇(i-PrOH)、乙腈(CH3CN)、二氯甲烷(CH2Cl2)、氯仿(CHCl3)、四氢呋喃(THF)及无水乙醇(EtOH)购自北京百灵威科技有限公司,含1%叔丁基二甲基氯硅烷的N-(特丁基二甲基硅)-N-甲基三氟乙酰胺(MTBSTFA(1% TBDMSCl))、叔丁基甲基醚(tBuOMe)购自美国默克公司,乙酸乙酯(EtOAc)购自北京伊诺凯公司,70%盐酸购自杭州昕诚生物科技有限公司,纯净水购自杭州娃哈哈集团有限公司。
仪器设备:Waters 600高效液相色谱-waters 717 plus自动进样器-waters 2487双波长检测器(美国Waters公司),Agilent 7890A-5975C气相色谱-质谱联用仪(美国Agilent公司),PL202-L-电子天平(梅特勒-托利多仪器(上海)有限公司),RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂),MTH-100加热恒温混匀仪(杭州米欧仪器有限公司),2.0 mL液相进样瓶(美国Agilent公司),200 μL液相进样瓶内插管(美国Agilent公司),20 mL特制回流冷凝试管(北京欣维尔玻璃仪器有限公司),10/100 mL容量瓶(上海安谱实验科技股份有限公司),10 μL—5 mL移液器(德国艾本德股份公司),15 mL/50 mL离心管(美国康宁公司),FD 5-10真空冷冻干燥机(美国西盟公司),5430R高速离心机(德国艾本德股份公司)。
1.3 试验方法
1.3.1 手性HPLC法(无需衍生化) 高效液相色谱法分离氨基酸对映异构体混合标准品:等量准确称取各氨基酸消旋标准品约10.0 mg放置于100 mL容量瓶中,分别采用蒸馏水、0.1 mol∙L-1盐酸定容至100 mL,静置后转移至1.5 mL液相进样瓶中,分别采用HPLC进行检测。
高效液相色谱法分离茶汤中的游离氨基酸对映异构体:3.0 g混合茶粉溶于150 mL去离子水中,80℃浸提45 min,3×30 mL CHCl3萃取除去多酚、咖啡碱等物质,离心10 min得粗提取液,C18 SPE柱(美国Waters公司)预处理得待测提取液。
HPLC分析条件:采用Waters 600高效液相色谱-waters 717 plus自动进样器-waters 2487双波长检测器进行分析;分析条件为波长:200 nm;流动相:1.0 mL∙min-1HClO4水溶液(pH 2.0);温度:25˚C;色谱柱:大赛璐CROWNPAK® CR(+)手性液相色谱柱(150 mm×3.0 mm×5 μm;日本大赛璐公司);进样量:25 μL。
1.3.2 手性GC-MS法(MTBSTFA硅烷衍生化法) MTBSTFA硅烷衍生化氨基酸混合标准品步骤:用0.1 mol∙L-1盐酸配制1 mmol∙L-1氨基酸消旋体的混合标准品溶液,吸取10 μL氨基酸混合溶液于2 mL的自动进样瓶中,分别加入40 μL的乙腈溶剂及40 μL MTBSTFA 衍生试剂(1% TBDMSCl),100℃下衍生化30 min后,冷却至室温,静置待用。
MTBSTFA硅烷衍生化茶汤中的游离氨基酸步骤:取0.1 g混合茶粉样,加入5 mL超纯水于沸水浴中浸提5 min,5 000 r/min离心10 min得提取液,加入100 μL的CH3CN溶剂及100 μL MTBSTFA衍生试剂(1% TBDMSCl),100℃下衍生化30 min后,冷却至室温,静置待用。
GC-MS测定条件:Agilent 7890A-5975C(美国Agilent公司),Chirasil-L-Val(25 m×0.22 mm×0.12 μm)手性气相色谱柱;进样口温度为250℃;分流进样,分流比为10﹕1,载气为高纯度氦气,纯度≥99.99%;柱箱温度采用程序升温:80℃保持3 min,然后以3℃∙min-1升到200℃保持10 min,流速为1.2 mL∙min-1,进样量为1.0 μL。MS条件:电子轰击离子源,电子能量-70 eV,传输线温度250℃;离子源温度220℃;质量扫描范围(m/z)33—600 u。
1.3.3 手性GC-MS法((酯化-PFP酰化),含衍生化法优化步骤) 标准品的衍生化:分别称取各氨基酸消旋标准品0.1 mol于100 mL容量瓶中,加0.1 mol∙L-1盐酸溶液至刻度线(即各氨基酸标准品浓度为1.0 mol∙L-1),摇匀,静置;用移液枪取100 μL溶液置于15 mL离心管中,加入100 μL盐酸/异丙醇溶液(4 mol∙L-1),分别在40、60、80、100和120℃下恒温反应15、30、45、60、75、90、105和120 min(酯化步骤),反应完毕后,将剩余的试剂旋干浓缩,-56℃下真空冷冻至绝对干燥状态(24 h);在反应物中加入200 μL溶剂(分别采用CH2Cl2、CH3CN、EtOAc、EtOH、tBuOMe、THF等溶剂进行筛选比较)并转移至特制回流冷凝试管中,继而向试管中加入100 μL PFFA,用回流冷凝管密封试管,分别在40、60、80、100和120℃下恒温反应10、20、30、40、50和60 min(酰化步骤),反应完毕冷却至室温后,用50℃旋转蒸发仪将多余的试剂除去,最后用150 μL CH2Cl2溶解转移至含200 μL内插管的2.0 mL液相进样瓶中,静置待用。
样品衍生化:称取茶粉样1.0 g,加入50 mL沸纯净水,100℃浸提5 min后,用离心机低温离心20 min;用移液枪取1 mL上层清液置于15 mL离心管中,加入100 μL盐酸/异丙醇溶液(4 mol∙L-1),100℃下恒温反应105 min,反应完毕后,将剩余的试剂旋干浓缩,-56℃下真空冷冻至绝对干燥状态(24 h);在反应物中加入200 μL THF并转移至特制回流冷凝试管中,继而向试管中加入100 μL PFPA,用回流冷凝管密封试管,100℃恒温反应10 min,反应完毕冷却至室温后,用50℃旋转蒸发仪将多余的试剂除去,最后用150 μL THF溶解转移至含200 μL内插管的2.0 mL液相进样瓶中,静置待用。每个茶样均重复3次。
氨基酸衍生物的GC-MS测定条件同1.3.2。
1.3.4 茶叶中游离氨基酸对映异构体的定性定量分析 根据游离氨基酸对映异构体标准品的保留时间和定性离子,提取出茶样中相应位置的特征离子峰,与标准品的离子峰丰度分布相似度在95%以上的色谱峰即可定性。采用外标法对茶叶中的游离氨基酸对映异构体进行定量分析,选取8个浓度梯度进行衍生化后,绘制氨基酸衍生物浓度与定量离子峰面积间的标准工作曲线,将测得的茶样中各氨基酸对映异构体的定量离子峰面积代入工作曲线即可得出相应的浓度值。
1.3.5 茶叶中游离氨基酸对映异构体的回收率测定 选取浓度线性范围内两个不同等级浓度的游离氨基酸标准品溶液,分别添加到混合茶粉样中,衍生化后进行手性GC-MS分析,测定加标回收率。回收率测定公式如下:Recovery(%)=[(加标茶样中氨基酸对映异构体的浓度-茶样中氨基酸对映异构体的浓度)/添加的氨基酸对映异构体标准品浓度]×100。回收率试验重复测量3次,取平均值并计算相对标准偏差(relative standard deviation,RSD)。
1.3.6 数据分析 采用Excel 2013(美国微软公司)进行数据初步处理(原始数据进行标准化、归一化处理)、绘制柱状图、计算含量及RSD值等。采用SPSS Statistics 20.0(美国IBM公司)、SIMCA-P v. 12.0(瑞典Umetrics公司)及MultiExperiment Viewer 4.8.1(美国Oracle公司)进行多元统计分析。
2 结果
2.1 茶叶中游离氨基酸对映异构体分析方法建立
2.1.1 手性HPLC法分离茶叶中的游离氨基酸对映异构体 采用HPLC法对氨基酸的混合消旋体标准品进行手性分离,仅有酪氨酸、苯丙氨酸及色氨酸的对映异构体可以被分离,而其他氨基酸由于出峰时间过早,有较大程度重叠。此外,虽然茶氨酸与其他氨基酸具有较高的分离度,但其对映异构体无法被分离(图1-A)。对茶汤中游离氨基酸对映异构体的检测结果显示,通过该方法仅能检测到茶氨酸(DL-混合体,81.01%)、L-酪氨酸(9.36%)、L-苯丙氨酸(4.59%)及少量D-酪氨酸(2.16%),其中茶氨酸的含量远高于其他氨基酸(图1-B)。由此可知,氨基酸在液相系统中保留时间过短,大量小分子量的氨基酸色谱峰会严重重叠,无法判断化合物归属。另外,该方法的灵敏度较低,能检测到的氨基酸种类过少,因此,该方法不适用于茶叶中游离氨基酸的对映异构体分析。
2.1.2 手性GC-MS法(MTBSTFA硅烷衍生化法)分离茶叶中的游离氨基酸对映异构体 采用MTBSTFA硅烷衍生化法对游离氨基酸标准品进行衍生化,经结构鉴定发现丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、茶氨酸、蛋氨酸、丝氨酸、苏氨酸、苯丙氨酸、天冬氨酸、谷氨酸、谷氨酰胺、组氨酸及酪氨酸等15种氨基酸可被GC-MS鉴定出。但衍生化之后的氨基酸硅烷衍生物在手性氨基酸专用柱上并未获得良好的分离效果,没有任何氨基酸对映异构体可以被分离(图2)。因此,该方法也不适用于茶叶中游离氨基酸的对映异构体分析。
2.1.3 手性GC-MS法(酯化-PFP酰化衍生法)分离茶叶中的游离氨基酸对映异构体 采用酯化及PFP酰化反应将氨基酸混合标准品衍生化,并通过手性GC-MS分离相应对映异构体。结果表明,丙氨酸、缬氨酸、苏氨酸、异亮氨酸、亮氨酸、脯氨酸、丝氨酸、半胱氨酸、天冬氨酸、蛋氨酸、苯丙氨酸、酪氨酸、赖氨酸、色氨酸及谷氨酸等15种游离氨基酸对映异构体可被成功分离,而茶氨酸以及谷氨酰胺在酯化后形成了与谷氨酸相同的酯化衍生物,因此其色谱峰与谷氨酸的色谱峰完全重合。此外,虽然仍有部分氨基酸存在重叠问题,但由于各氨基酸的特征离子峰不同,因此仍可以通过提取谱图的特征峰离子从而获得良好的分离度(图3)。表1列出了该方法下游离氨基酸对映异构体的各项定性参数。
继而采用该方法将混合茶叶样品衍生化后通过手性GC-MS分析,并依据表1中各氨基酸对映异构体的定性参数进行定性和相对定量。结果表明,在混合茶粉样中可检测到L-丙氨酸、L-缬氨酸、L-苏氨酸、D-苏氨酸、L-异亮氨酸、L-亮氨酸、L-丝氨酸、L-脯氨酸、L-天冬氨酸、L-半胱氨酸、L-苯丙氨酸、D-苯丙氨酸、L-谷氨酸(实为谷氨酸、谷氨酰胺及茶氨酸混合物)、D-谷氨酸(实为谷氨酸、谷氨酰胺及茶氨酸混合物)、L-酪氨酸、L-赖氨酸及L-色氨酸等,以上可检测的游离氨基酸对映异构体均可以获得良好的分离度。其中苏氨酸L/D比值为1.49﹕1,苯丙氨酸L/D比值为37.22﹕1,茶氨酸、谷氨酰胺及谷氨酸混合物L/D比值为306.8﹕1(图1)。除此之外,蛋氨酸的两个对映异构体并未被检测到,推测与样本自身属性有关或其含量未达仪器检测限。由此可见,该方法虽然比其他两种方法更为繁琐,但可以检测出茶叶中常见的大部分游离氨基酸对映异构体,分析方法的可行性较高。由于组氨酸、精氨酸及鸟氨酸等碱性氨基酸在该条件下无法获得衍生化的产物,所以在后续工作中还会继续优化分析方法,以查明这些无法分离的游离氨基酸在茶叶中的对映异构体分布。
2.2 茶叶中游离氨基酸高效衍生化方法建立
酯化-PFP酰化衍生化过程中涉及到两步化学反应(图4-A,以L-苯丙氨酸的衍生化为例),首先采用异丙醇的盐酸溶液将氨基酸的羧基衍生成异丙酯基,然后加入PFPA与异丙酯衍生物的NH2基团(或氨基酸本身含有的OH、NH2、NHR、SH基团)快速反应,最后生成易汽化的氨基酸PFP衍生物。在反应过程中,涉及到溶剂选择、反应温度及反应时间等条件参数,将对氨基酸的衍生化效率产生较大影响,因此需要对溶剂、反应温度及时间等反应条件进行优化。
图2 游离氨基酸标准品(以苏氨酸为例)硅烷化衍生物的总离子流图

表1 游离氨基酸对映异构体定性参数
[1]:保留时间在前的为D-氨基酸;[2]:定性离子中排在第一位的离子为定量离子
[1]: The enantiomer with earlier retention time was identified as D-amino acid; [2]: The qualitative ion of the first rank was determined as the quantitative ion
2.2.1 适宜氨基酸酯化温度及时间选择 当反应温度低于40℃时,酯化反应无法进行,没有任何产物生成;而在60—100℃时,反应效率逐渐上升,在100℃时氨基酸异丙酯的产量最高;当温度升到120℃后,反应效率急剧下降,推测温度过高,生成的副产物增多(图4-B)。因此,100℃为适宜的酯化温度。在15—105 min时,随着反应时间的增加,反应效率相应增加,而当反应时间延长至120 min时,反应效率大幅度降低(图4-C)。因此,105 min为适宜的酯化时间。
2.2.2 氨基酸PFP酰化反应溶剂的筛选 在氨基酸酰化步骤中,溶剂是影响酯化效率的关键因素之一。对于在溶剂中进行的反应,溶剂的改变,必然强烈地影响反应物和过渡态的稳定性,强烈地影响反应过程、反应速度、反应活化能等[23]。因此,反应溶剂的极性、沸点以及结构对反应效率的影响极大。通过试验观察到,当溶剂为CH2Cl2和tBuOMe时,溶剂迅速蒸发,反应结束后基本无溶剂存在,当溶剂为CH3CN及EtOAc时,反应结束后溶剂挥发至一半,而溶剂为THF及EtOH时,反应溶剂基本未减少。不同溶剂的衍生化效率如图4-D所示,当以THF为反应溶剂时,氨基酸的衍生化效率远高于其他溶剂,因此,THF为适宜的氨基酸PFP酰化溶剂。
2.2.3 氨基酸PFP酰化温度及反应时间筛选 氨基酸酰化步骤中,氨基酸异丙酯的NH2基团与PFPA发生剧烈而快速的反应,最终形成易挥发的PFP产物。不同反应温度下氨基酸PFP衍生化效率差异较大,当反应温度为100℃时,氨基酸PFP产物的含量达到最高,而当温度继续上升后,反应效率急剧下降(图4-E)。对反应时间的考察结果表明(图4-F),PFP酰化反应时间与反应效率在一定程度上呈反比,反应时间为10 min时效果最佳,推测生成的产物为易挥发化合物,若反应时间过长,会导致化合物的大量挥发。因此,氨基酸PFP酰化反应的适宜反应时间为10 min。
综合以上结果,最终筛选出氨基酸对映异构体的高效衍生化方法为:各游离氨基酸在100℃下与4 mol∙L-1异丙醇的盐酸溶液反应105 min,将反应液充分干燥后,以THF为溶剂溶解氨基酸异丙酯衍生物并转移至特制试管中,往试管中加入100 μL PFPA试剂,100℃下反应10 min,将残余溶剂浓缩后获得易汽化的氨基酸五氟丙酰胺异丙酯衍生物。
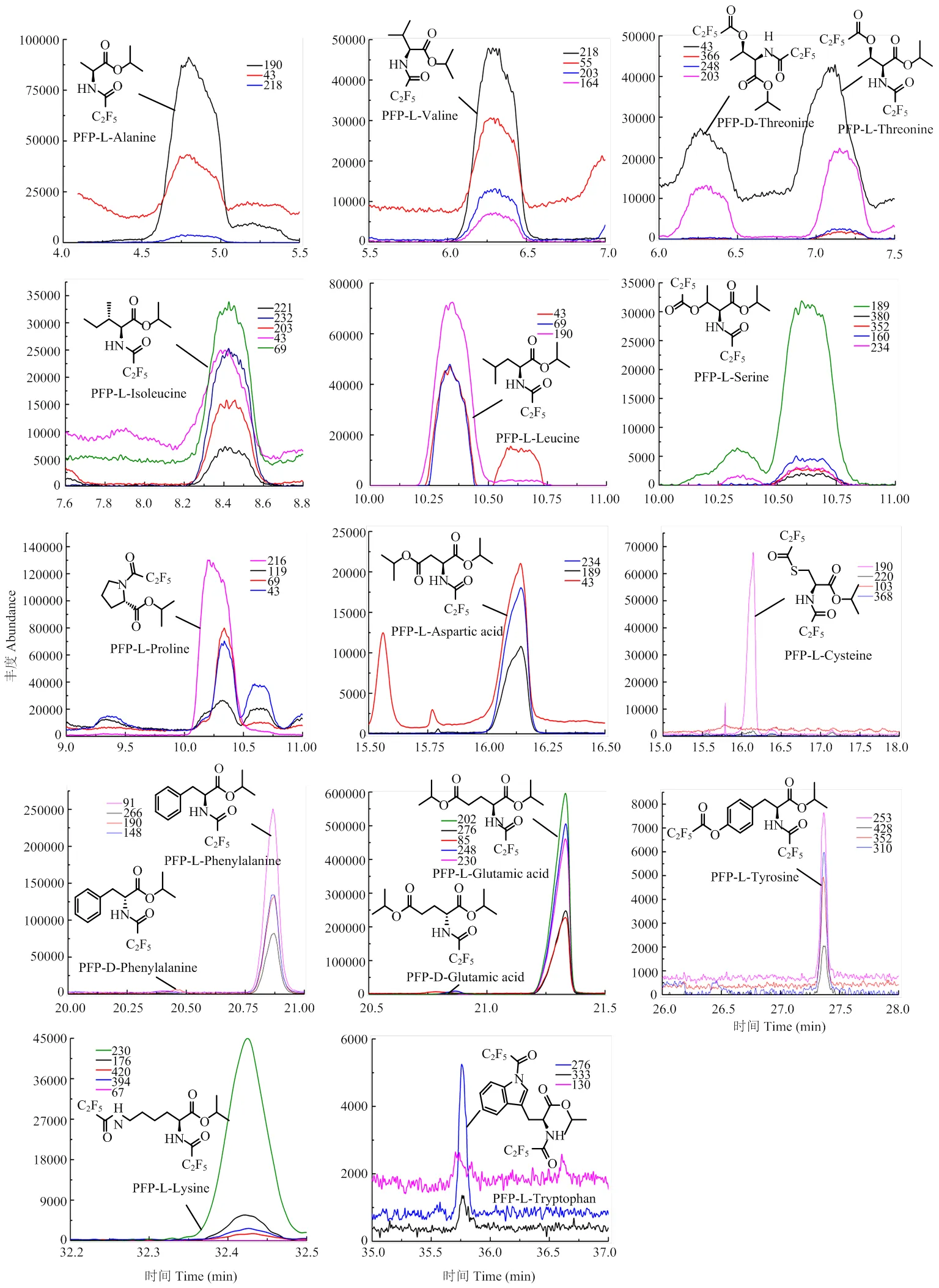
图3 混合茶样中可检测到的游离氨基酸对映异构体

A:氨基酸衍生化反应步骤(以L-苯丙氨酸为例);B:氨基酸酯化温度;C:氨基酸酯化时间;D:氨基酸PFP反应温度;E:溶剂;F:氨基酸PFP反应时间
2.3 茶叶中游离氨基酸对映异构体分析方法的回收率及精密度
在混合茶样中添加较低浓度水平的氨基酸对映异构体标准品后,回收率介于75.26%—123.6%,RSD值介于2.09%—13.12%;添加较高浓度水平的氨基酸对映异构体标准品后,回收率介于81.23%— 121.8%,RSD值介于1.48%—10.59%(表2)。所获得的氨基酸对映异构体的回收率及分析方法的精密度均较为理想,说明分析方法的可靠性较强。
2.4 茶叶中游离氨基酸对映异构体的定性定量分析
2.4.1 白茶中游离氨基酸对映异构体的比例及含量 5个白茶样品的定量分析结果如表3(白茶部分)所示,大部分氨基酸可以检测到1—2个对映异构体,但D-缬氨酸、D-亮氨酸、D-丝氨酸、D-蛋氨酸、D-酪氨酸、D-赖氨酸及D-色氨酸在所有白茶样品中均未被检测到。在各氨基酸的组成上,以各白茶中每种游离氨基酸对映异构体含量的平均值为指标,结果如图5-A所示。L-茶氨酸、L-谷氨酰胺及L-谷氨酸混合物的含量远高于其他氨基酸,含量介于7.50—14.22 mg∙g-1,表现为白毫银针>印尼白毫银针>白牡丹>寿眉的分布趋势。L-天冬氨酸含量仅次于前者,介于1.58—15.58 mg∙g-1,呈现出白毫银针>寿眉>印尼白毫银针>白牡丹的分布趋势。L-半胱氨酸(1.48—2.08 mg∙g-1)、D-半胱氨酸(1.46—1.49 mg∙g-1)、L-丝氨酸(0.15—1.80 mg∙g-1)及D-天冬氨酸(1.02—1.14 mg∙g-1)等在白茶中的含量也普遍较高,但D-半胱氨酸及L-丝氨酸在白牡丹样品1中未被检出,D-天冬氨酸在白牡丹样品2中未被检出。此外,D构型的苏氨酸、苯丙氨酸及谷氨酸(混合物)等在部分白茶中可被检测出,但含量均不高于1.0 mg∙g-1。由于白茶中含量普遍较高的L-茶氨酸、L-谷氨酰胺、L-谷氨酸、L-天冬氨酸在滋味上均显示鲜味特征,L-丝氨酸呈现甜味特征,与白茶表现的鲜醇滋味最为接近,因此,推测以上4种氨基酸是白茶的特征性氨基酸。
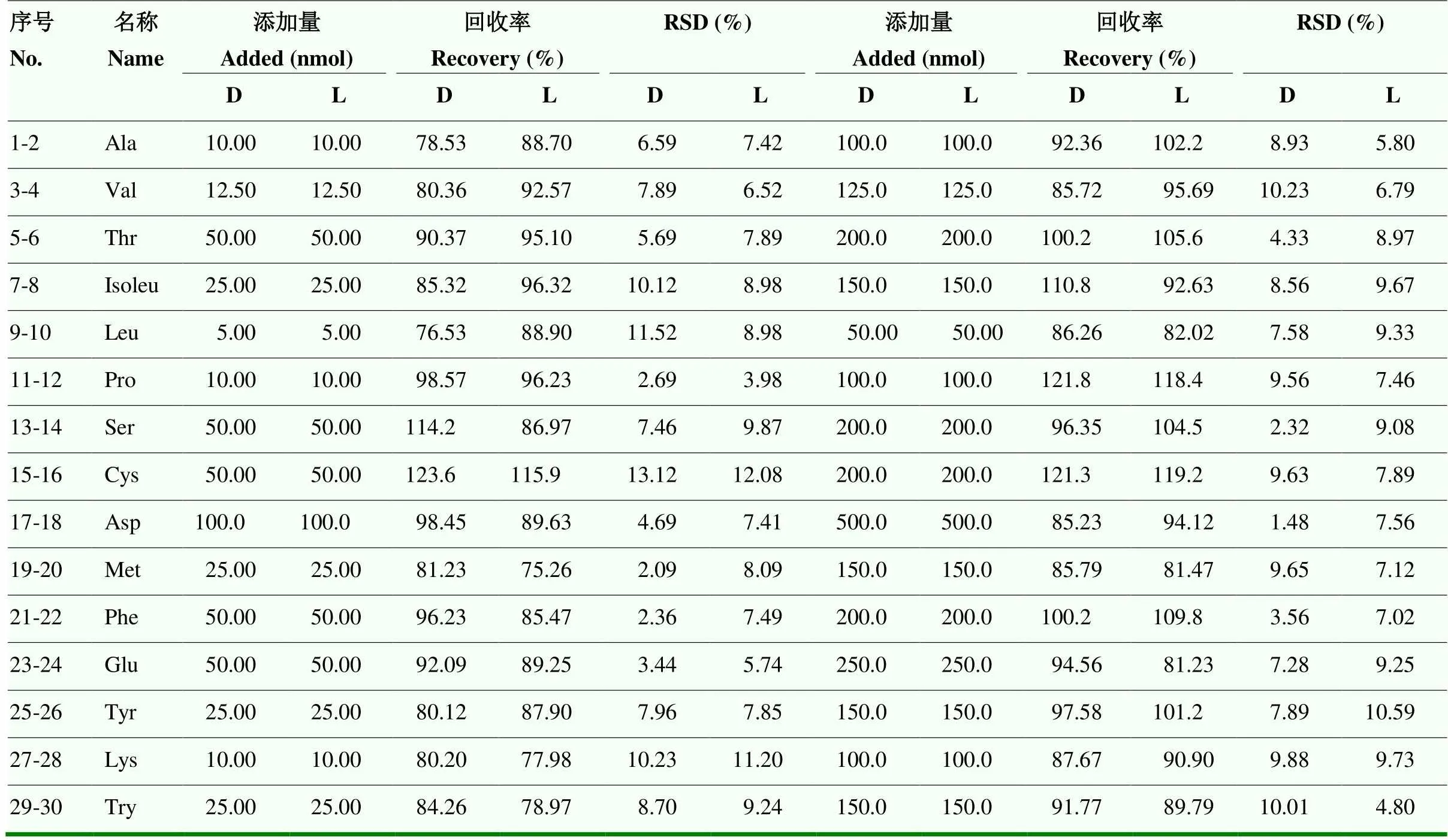
表2 游离氨基酸对映异构体的回收率及RSD值(%)

表3 不同茶类中游离氨基酸对映异构体组成及含量表
在氨基酸总量上(图5-B),嫩度最高的白毫银针的氨基酸对映异构体总和达40.61 mg∙g-1,印尼白毫银针的含量次之(31.67 mg∙g-1),而白牡丹及寿眉样品中氨基酸总量相差不大,介于21.28—23.15 mg∙g-1。分析结果表明,氨基酸总量与鲜叶采摘嫩度呈现一定的正相关性,与传统的认知较为吻合。
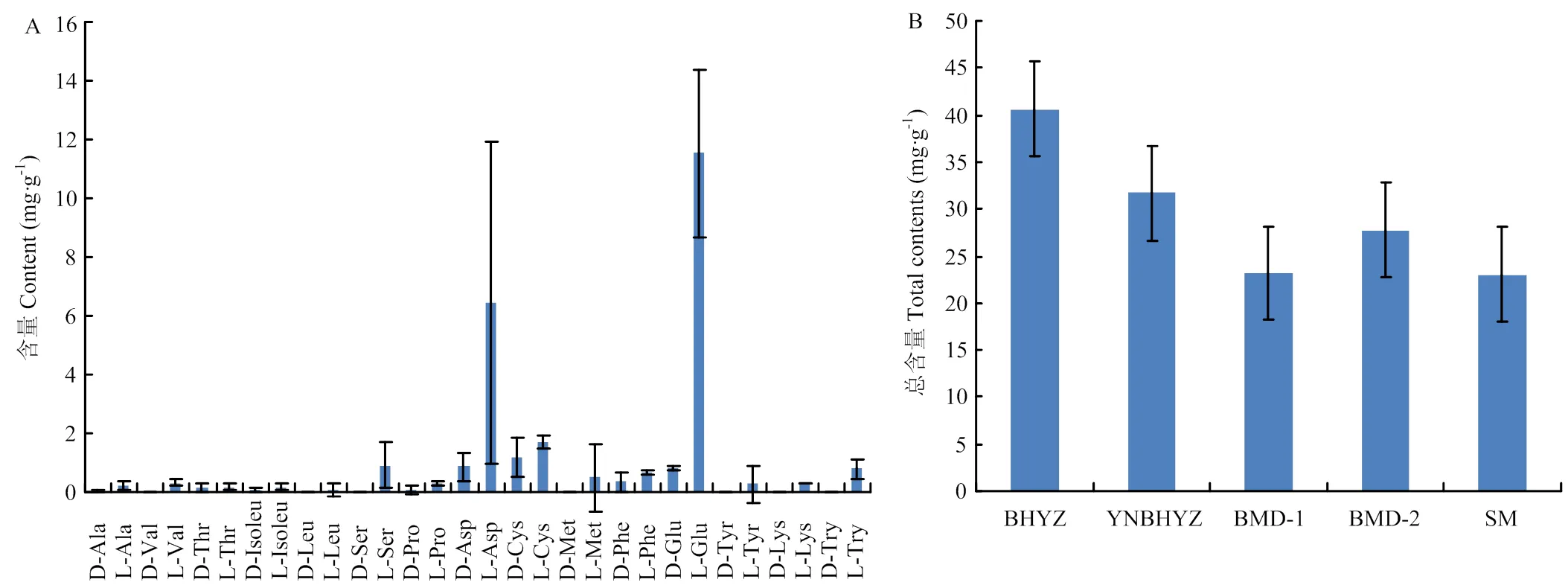
图5 白茶中各游离氨基酸对映异构体的含量分布(A)与不同白茶中游离氨基酸总量分布(B)
2.4.2 乌龙茶中游离氨基酸对映异构体的比例及含量 5个乌龙茶样品的定量分析结果如表3(乌龙茶部分)所示,大部分氨基酸可以检测到1—2个对映异构体,但亮氨酸的两个对映异构体、D-异亮氨酸、D-丝氨酸、D-脯氨酸、D-蛋氨酸、D-赖氨酸及D-色氨酸在所有乌龙茶样品中均未被检测到。在各氨基酸的组成上,以各乌龙茶中各游离氨基酸对映异构体的平均含量数为指标,结果如图6-A所示。与白茶类似,L-茶氨酸、L-谷氨酰胺及L-谷氨酸混合物的含量最高,介于3.85—6.75 mg∙g-1,呈现出水仙>铁观音>大红袍>肉桂的分布趋势。L-天冬氨酸含量(2.75—6.59 mg∙g-1)仅次于前者,在大红袍及铁观音中的含量显著高于水仙样品。L-半胱氨酸(1.52—1.70 mg∙g-1)、D-半胱氨酸(1.45—1.49 mg∙g-1)、L-丝氨酸(1.03—1.50 mg∙g-1)、L-蛋氨酸(1.03—1.52 mg∙g-1)、L-酪氨酸(1.32—1.35 mg∙g-1)及D-天冬氨酸(1.01—1.15 mg∙g-1)普遍在乌龙茶中具有较高含量,且不同乌龙茶样品间含量没有显著性差异。此外,低含量的D-丙氨酸、D-缬氨酸、D-酪氨酸、D-苏氨酸、D-苯丙氨酸及D-谷氨酸(混合物)在部分甚至全部乌龙茶中被检测到。虽然在组成上,白茶中含量较高的几种氨基酸(L-茶氨酸、L-谷氨酰胺、L-谷氨酸、L-天冬氨酸、L-丝氨酸)在乌龙茶中也相对较高,但它们在乌龙茶中的含量明显低于白茶,所以乌龙茶的鲜爽滋味特征明显弱于白茶。在氨基酸总量上(图6-B),5个乌龙茶样品的氨基酸总量相差不大,介于21.14— 25.43 mg∙g-1,其中大红袍与铁观音的氨基酸总量接近,水仙及肉桂的氨基酸总量接近,后两者含量略低于前两者。
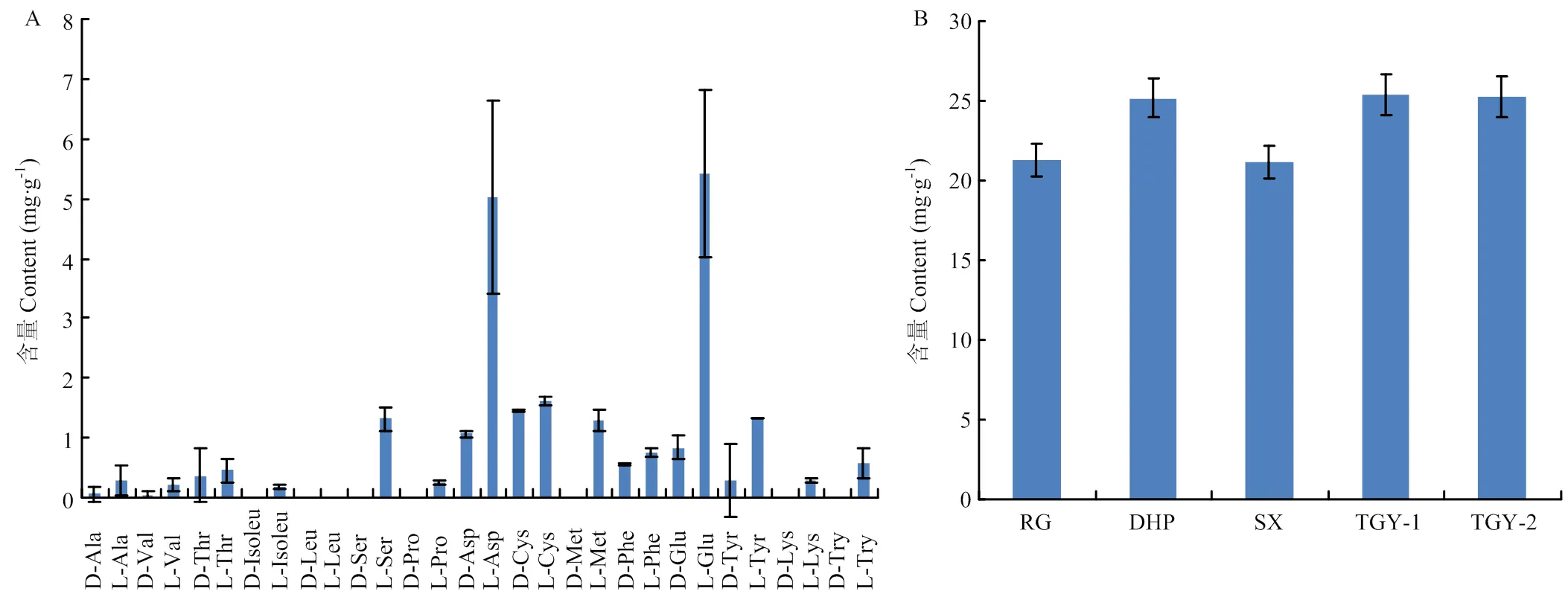
图6 乌龙茶中各游离氨基酸对映异构体的含量分布(A)与不同乌龙茶中游离氨基酸总量分布(B)
2.4.3 普洱茶中游离氨基酸对映异构体的比例及含量 普洱茶的定量分析结果如表3(普洱茶部分)所示。在氨基酸组成上(图7),D-异亮氨酸、D-亮氨酸、D-丝氨酸及D-半胱氨酸被检测出,含量介于0.17—0.46 mg∙g-1。与其他茶类不同的是,普洱茶中L-茶氨酸、L-谷氨酸及L-谷氨酰胺的总含量与其他氨基酸相比并无显著性差异,含量仅为1.04 mg∙g-1。L-苏氨酸、L-色氨酸及L-丝氨酸在普洱中的含量也相对较高,介于0.61—0.84 mg∙g-1,而L-缬氨酸及L-异亮氨酸的含量较低,均不高于0.20 mg∙g-1。在氨基酸总量上,普洱的氨基酸总量为8.01 mg∙g-1,明显低于白茶和乌龙茶。
2.4.4 不同茶类间游离氨基酸对映异构体的含量比较 为了深入了解不同茶类间游离氨基酸对映异构体的具体分布差异,对已获得的数据进行多元统计分析。由于黑茶样本过少(仅1个),未参与到数据分析中。由图8-A可知,采用偏最小二乘法-判别分析法(partial least squares discrimination analysis,PLS-DA)[24]模型可成功区分白茶与乌龙茶样品,且其良好的拟合参数(R2Y=0.901,Q2=0.629),证明了该模型的准确性。为了避免“过拟合”现象,进一步对PLS-DA模型进行200次的交叉验证,结果表明该验证模型Q2回归直线与Y轴的截距均小于零(2=0.267,Q2=-0.198),证明了PLS-DA模型的可靠性。由PLS-DA模型及Mann-Whitney U非参数检验[25]可知,L-茶氨酸、L-谷氨酸及L-谷氨酰胺混合物、L-酪氨酸、L-天冬氨酸、L-色氨酸及L-蛋氨酸的含量在白茶与乌龙茶中具有显著差异性,被认为是该模型的关键变量(关键变量值(variable importance in the projection,VIP)>1,<0.05)。为了更直观体现以上化合物在茶样中的分布情况,对这些氨基酸进行聚类分析[26],结果如图8-B所示。L-茶氨酸、L-谷氨酸及L-谷氨酰胺混合物在白茶中的含量显著高于乌龙茶,这与茶叶的鲜叶原料嫩度选择密切相关,也是白茶鲜爽滋味形成的重要来源[27];除此之外,L-色氨酸、L-天冬氨酸在部分白茶中的含量也显著高于乌龙茶。与前面趋势相反的是,L-酪氨酸与L-蛋氨酸在乌龙茶中的含量普遍高于白茶样品,前者具有一定苦味,后者有硫磺甜味,可能是导致乌龙茶浓醇甘爽的重要原因之一[3]。
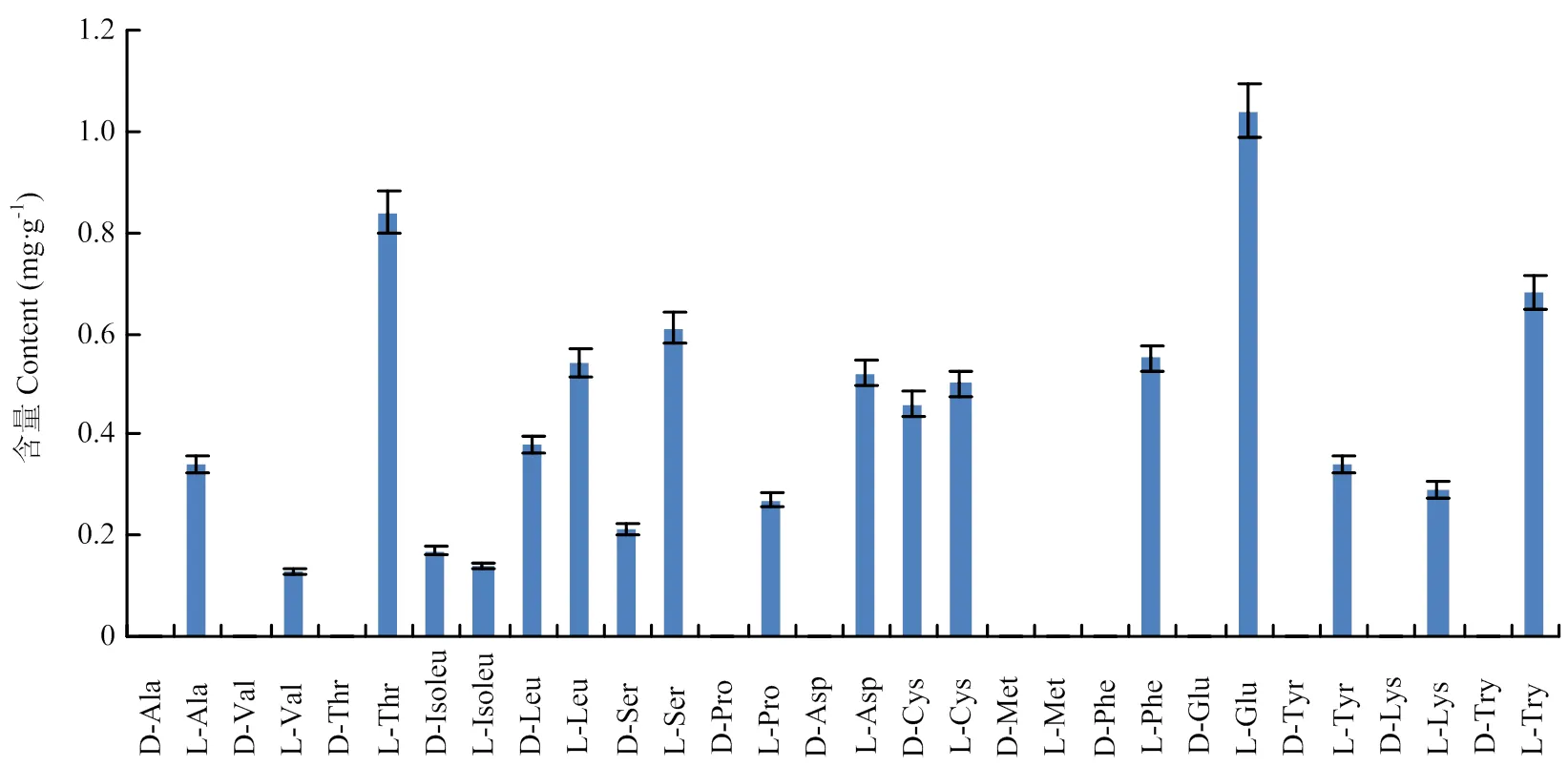
图7 普洱茶中各游离氨基酸对映异构体的含量分布
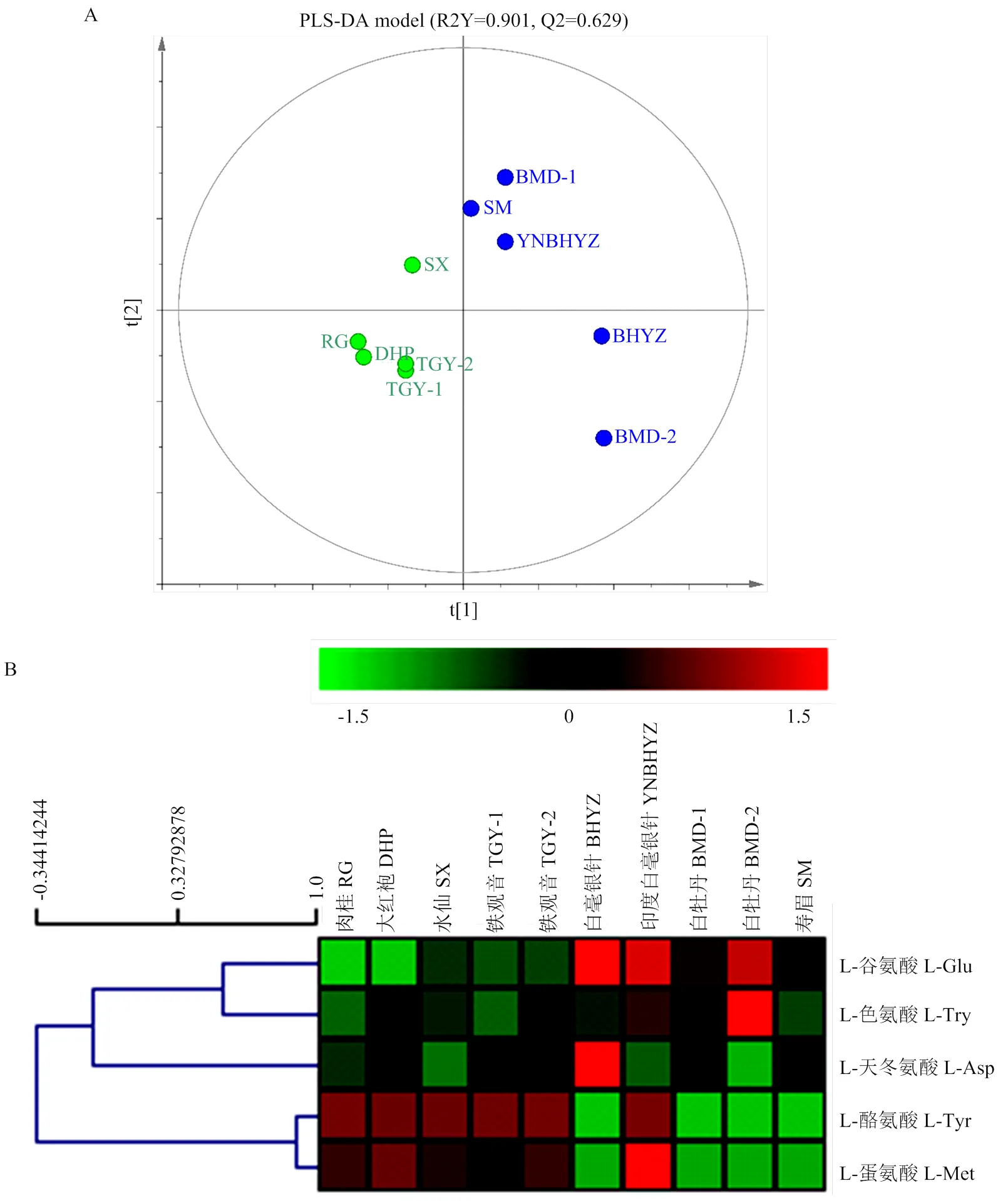
图8 基于白茶及乌龙茶中游离氨基酸对映异构体含量的PLS-DA模型(A)及关键差异性氨基酸对映异构体的含量分布热图(B)
3 讨论
由上述分析结果可知,尽管含量较低,但D-氨基酸普遍存在于不同种类茶叶中,相比L-氨基酸在茶树生命体内有着广泛的分布,其代谢通路及在加工过程中的形成转化途径目前已有了较为广泛的研究报道,目前关于茶叶中D-氨基酸的来源目前尚无明确说法,因此茶叶中D-氨基酸的形成转化途径有着重要的研究意义。来自其他相近植物或食品的研究表明,D-氨基酸可以以天然形式存在于发酵型食品中(如酸奶、酒、奶酪、酱油等)[28-30],它们往往在乳酸发酵过程中形成,尤其是D-天冬氨酸、D-丙氨酸及D-谷氨酸等的含量在发酵后得到大幅度提高[31]。不仅如此,植物或食品加工过程中pH调节、处理时间、热处理和加热时间等均会促进L-氨基酸的消旋化反应(如L-苯丙氨酸、L-酪氨酸、L-丝氨酸、L-苏氨酸等)[32-33],从而生成相应的D-构型氨基酸。此外,还有研究表明,D-氨基酸可能是食品加工过程美拉德反应的葡萄糖-L-氨基酸中间体的Amadori或Heyns重排产物,其数量及含量同样深受pH、加热条件、水分等加工因素影响[33-34],且该反应为可逆反应,直至美拉德反应末期,氨基酸不可逆地转化为环状化合物或多聚物后方可结束。由此可见,茶叶中D-氨基酸的来源有多种可能性,可能天然产生于茶树的次生代谢过程,与茶树品种、产地、生长环境等自身属性相关;也可能在茶叶加工过程中产生,如经高温杀青、长时间高温干燥后通过美拉德反应生成,或L-氨基酸在长时间萎调、大量失水后经消旋化反应转化而来。然而,近期的研究表明,在所测的茶树鲜叶(福鼎大白茶、中茶108)中未检测到D-氨基酸,说明茶叶中D-氨基酸更可能生成于采摘后的阶段[15],但因样本量具有局限性,且暂无其他报道,所以也不能完全排除该来源,还有待进一步验证。D-氨基酸还与茶叶的储藏时间密切相关,随着储藏时间的增加,D/L的含量也会呈现逐渐上升的趋势,也被证实是茶叶中D-氨基酸的重要来源[15]。值得注意的是,由于化学结构上的差异,不同氨基酸的反应活性也不尽相同,如D-天冬氨酸易受加工过程的苛刻条件影响,D-丙氨酸易形成于食品的天然发酵过程中,而D-谷氨酸在以上两种过程中均可以生成[35],因此还需要根据不同化合物的性质进行模拟试验并具体分析,相关内容在下一步工作中将系统研究。
另一方面,前人的研究报道表明,D-氨基酸可能与食品或植物的等级、储藏时间、加工工艺等密切相关[6-9,31,33,36]。在本研究中,发现部分D-氨基酸具有一定的特异性分布,具有作为判别特定茶类标志性化合物的应用潜力,如D-酪氨酸仅在大红袍样本被检测到,且其含量也相对较高。在今后的延续性工作中,将扩大样本量,针对性地对不同类别、不同茶树品种、不同环境因素茶叶中的游离氨基酸对映异构体分布进行研究,以期为茶叶的品种或产地溯源、质量认证及真伪辨析等应用领域提供理论参考依据。
此外,虽然本研究可以有效分离茶叶中高达15种常见的游离氨基酸对映异构体,且是该方法应用于茶叶领域的首次报道,但该分析方法还是存在一定的局限性。首先在氨基酸对映异构体的分离上,由于茶叶中游离氨基酸种类繁多,各氨基酸的化学性质各异,而氨基酸又需要通过衍生化后才可被仪器检测识别,因此很难在同一个色谱体系中将所有氨基酸对映异构体分离开。研究中发现,谷氨酸、谷氨酰胺及茶氨酸的衍生化产物均为五氟丙酰谷氨酸异丙酯,推测可能是在第一步酯化反应时,谷氨酰胺及茶氨酸的酰胺基团在酸性条件下发生了醇解反应,生成了与谷氨酸相同的衍生化双酯类产物。因此,采用本方法虽然可以分离出相应的对映异构体,但获得的谷氨酸对映异构体实为谷氨酸、茶氨酸及谷氨酰胺的混合物,仅可获得三者的总含量信息,它们之间的比例关系无法得知,很大程度上限制了该方法的进一步应用。而且部分碱性氨基酸如组氨酸、精氨酸、鸟氨酸等,在衍生化步骤的强酸性环境下易分解成其他化合物,从而导致衍生化反应失败,因此也无法用本方法进行分离。在接下来的研究工作中,将继续开发更适合的衍生化及手性分析方法,以期分离出茶叶中更多数量的游离氨基酸对映异构体,从而获得更深层次的研究成果。其次,在氨基酸衍生化方法的优化环节,由于本研究仅采用单因素试验进行氨基酸衍生化方法的优化,未考虑到不同参数间可能的相互作用,所筛选出来的各个参数还有进一步的优化空间,后续将采用正交试验进一步优化设计,以期进一步降低氨基酸对映异构体的检测限,实现对茶叶中痕量氨基酸的精确定性定量;另一方面,本研究仅提供了广谱性的分析方法作为参考,并非是针对所有茶类的唯一高效分析方法,在后续具体茶类的系统分析工作中,应根据各茶类中氨基酸的分布特点,对衍生化及氨基酸测定方法的参数进行选择和优化。
4 结论
本研究发现当采用酯化-五氟丙酸酐酰化法结合手性GC-MS技术时,可实现茶叶中高达15种重要游离氨基酸对映异构体的有效分离。继而建立了茶叶中游离氨基酸对映异构体的高效衍生化及定性定量分析方法,并查明了市售11种代表性白茶、乌龙茶及普洱茶中游离氨基酸对映异构体的分布规律。分析结果表明,在白茶中,L-半胱氨酸、D-半胱氨酸、L-丝氨酸及D-天冬氨酸普遍较高;L-半胱氨酸、D-半胱氨酸、L-丝氨酸、L-蛋氨酸、L-酪氨酸及D-天冬氨酸普遍在乌龙茶中具有较高含量;L-苏氨酸、L-色氨酸及L-丝氨酸在普洱茶中的含量相对较高。在氨基酸总量上,各茶类呈现出白茶>乌龙茶>普洱茶的明显规律性。多元统计分析结果表明,L-茶氨酸、L-谷氨酰胺及L-谷氨酸混合物、L-色氨酸及L-天冬氨酸在部分白茶中的含量显著高于乌龙茶,而L-酪氨酸与L-蛋氨酸呈现相反趋势。本研究结果有助于进一步提高茶叶滋味品质化学的研究水平,可为后续茶叶风味品质形成机理研究及茶叶滋味品质的提高与定向调控等应用领域奠定重要的科学理论基础。
[1] 林智, 尹军峰, 吕海鹏. 茶叶深加工技术. 北京: 科学出版社, 2020: 7.
LIN Z, YIN J F, Lü H P. Tea Deep-Processing Technology. Beijing: Science Press, 2020: 7. (in Chinese)
[2] 宛晓春. 茶叶生物化学. 北京: 中国农业出版社, 2003: 32-35.
WANG X C. Tea Biochemistry. Beijing: China Agriculture Press, 2003: 32-35. (in Chinese)
[3] Solms J. Taste of amino acids, peptides, and proteins. Journal of Agricultural and Food Chemistry, 1969, 17(4): 686-688.
[4] WIESER H, JUGEL H, BELITZ H-D. Relationships between structure and sweet taste of amino acid. Z Lebensm Unters Forsch,1977, 164: 277-282.
[5] KATO H, RHUE M R, NISHIMURA T. Role of free amino acids and peptides in food taste//Flavor Chemistry: Trends and Developments. TERANISHI R, BUTTERY R G, SHAHID F, American Chemical Society: Washington, DC, 1989: 158-174.
[6] ZHAO Y s, LI P, GE L, WANG Y, MO T, ZENG X P, WANG X D. Effect of electrolyzed reduced water on chiral theanine and polyphenols in tea. Food Chemistry, 2012, 134 (4): 1761-1766.
[7] FIORI J, PASQUINI B, CAPRINI C, ORLANDINI S, FURLANETTOS, GOTTI R. Chiral analysis of theanine and catechin in characterization of green tea by cyclodextrin-modified micellar electrokinetic chromatography and high performance liquid chromatography. Journal of Chromatography A, 2018, 1562: 115-122.
[8] EKBORG-OTT K H, TAYLOR A., ARMSTRONG D W. Varietal differences in the total and enantiomeric composition of theanine in tea. Journal of Agricultural and Food Chemistry, 1997, 45(2): 353-363.
[9] HORANNI R, ENGELHARDT U H. Enantiomeric analysis of theanine in different teas () using Marfey’s reagent. European Food Research and Technology, 2015, 240: 61-70.
[10] DESAI M J, ARMSTRONG D W. Analysis of derivatized and underivatized theanine enantiomers by high-performance liquid chromatography/atmospheric pressure ionization-mass spectrometry. Rapid Communication in Mass Spectrometry, 2004, 18: 251-256.
[11] 李银花, 李娟, 刘仲华, 黄建安. 配体交换色谱手性固定相法拆分与定量茶氨酸对映体. 福建分析测试, 2010, 19(1): 10-13.
LI Y H, LI J, LIU Z H, HUANG J A. Separation and quantitation of theanine enantiomer on ligand exchange chromatography with chiral stationary phase, Fujian Analysis & Testing, 2010, 19(1): 10-13. (in Chinese)
[12] 李银花, 刘仲华, 黄建安. 配体交换色谱手性流动相法拆分和定量茶氨酸对映体. 茶叶科学, 2006, 26(4): 280-284.
LI Y H, LIU Z H, HUANG J A. Separation and quantitation of theanine enantiomers on ligand exchange chromatography with chiral mobile phase. Journal of Tea Science, 2006, 26(4): 280-284. (in Chinese)
[13] 李银花, 刘仲华, 黄建安. 手性衍生-高效液相色谱法拆分和定量测定茶氨酸对映体. 色谱, 2007, 25(5): 719-722.
LI Y H, LIU Z H, HUANG J A. Separation and quantification of theanine enantiomers using high performance liquid chromatography coupled with chiral derivatization. Chinese Journal of Chromatography, 2007, 25(5): 719-722. (in Chinese)
[14] WANG X Y, WU H H, LUO R Y, XIA D H, JIANG Z J, HAN H. Separation and detection of free D- and L-amino acids in tea by off-line two-dimensional liquid chromatography. Analytical Methods, 2017, 9(43): 6131-6138.
[15] XU Y, LIU Z Y, Liu Z Y, FENG Z H, ZHANG L, WAN X C, YANG X G. Identification of D-amino acids in tea leaves. Food Chemistry, 2020, 317: 126428.
[16] 祝馨怡, 蔡迎春, 陈立仁, 李永民.-氨基酸在-苯丙氨酸手性配体交换色谱固定相上的分离研究. 化学试剂, 2003, 25(2): 65-68.
ZHU X Y, CAI Y C, CHEN L R, LI Y M. Study on the separation of-amino acid using-phenylalanine chiral ligand exchange chromatography as the stationary phase. Chemical Reagent, 2003, 25(2): 65-68. (in Chinese)
[17] GRÜNER B, HOLUB J, PLEŠEK J, VANĚK T, VOTAVOVÁ H. High-performance liquid chromatographic enantiomeric resolution in the ten-vertex carborane series: Comparison of acyetl- and native- cyclodextrin bonded chiral stationary phases. Journal of Chromatography A, 1998, 793(2): 249-256.
[18] 方骏, 夏小庆, 吴勇勇. 使用手性冠醚的高效液相色谱法研究伯胺类药物的手性分离. 中国药物化学杂志, 2003, 13(1): 48-50.
FANG J, XIA X Q, WU Y Y. Study on chiral separation of amino drugs by HPLC utilizing crown ethers. Chinese Journal of Medicinal Chemistry, 2003, 13(1): 48-50. (in Chinese)
[19] KARL B, HALKET J M. Handbook of Derivatives for Chromatography (2nd). Chichester: John Wiley & Sons, 1993.
[20] SHEN X Z, DENG C H, WANG B, DONG L. Quantification of trimethylsilyl derivatives of amino acid disease biomarkers in neonatal blood samples by gas chromatography-mass spectrometry. Analytical and Bioanalytical Chemistry, 2006, 384(4): 931-938.
[21] 何红波, 张威, 解宏图, 侯松嵋, 张旭东. 测定土壤氨基糖和氨基酸手性异构体中氮同位素比值的气相色谱-质谱方法. 土壤学报, 2009, 46(2): 289-298.
HE H B, ZHANG W, XIE H T, HOU S M, ZHANG X D. A Gc/Ms method to assess 15n ratios in soil amino sugars and amino acid enantiomers. Acta Pedologica Sinica, 2009, 46(2): 289-298. (in Chinese)
[22] 邢其毅, 裴伟伟, 徐瑞秋, 裴坚. 基础有机化学(第3版). 北京: 高等教育出版社, 2005.
XING Q Y, PEI W W, XU R Q, PEI J. Basic Organic Chemistry (3rd ed). Beijing: Higher Education Press, 2005. (in Chinese)
[23] 丁永胜, 牟世芬. 氨基酸的分析方法及其应用进展. 色谱, 2004, 22(3): 210-215.
DING Y S, MOU S F. Development of analytical methods for amino acids and their applications. Chinese Journal of Chromatography2004, 22(3): 210-215. (in Chinese)
[24] 陈勤操, 戴伟东, 蔺志远, 解东超, 吕美玲, 林智. 代谢组学解析遮阴对茶叶主要品质成分的影响. 中国农业科学, 2019, 52(6): 1066-1077.
CHEN Q C, DAI W D, LIN Z Y, XIE D C, Lü M L, LIN Z. Effects of shading on main quality components in tea ((L) O. Kuntze) leaves based on metabolomics analysis. Scientia Agricultura Sinica, 2019, 52(6): 1066-1077. (in Chinese)
[25] ZHU Y, SHAO C, LV H, ZHANG Y, DAI W D, GUO L, TAN J F, PENG Q H, LIN Z. Enantiomeric and quantitative analysis of volatile terpenoids in different teas (). Journal of Chromatography A, 2017, 1490: 177-190.
[26] SINGH S K, KOLE P C, MISRA A K, ROY S, ARYA L, VERMA M, BHARDWAJ R, SUNEJA P, VERMA M R, BHAT K V, SINGH R. Characterization of(Linn.) Britt based on morphological, biochemical and STMS markers. Industrial Crops and Products, 2017, 109, 773-785.
[27] 陈宗懋, 杨亚军. 中国茶经. 上海: 上海文化出版社, 2011.
CHEN Z M, YANG Y J. The Classic of Chinese Tea. Shanghai: Shanghai Cultural Publishing House, 2011. (in Chinese)
[28] BRÜCKNER H, HAUSCH M. D-amino acids in dairy products: detection, origin and nutritional aspects. I. Milk, fermented milk, fresh cheese and acid curd cheese. Milchwissenschaft, 1990, 45: 357-360.
[29] ERBE T, BRÜCKNER H. Chromatographic determination of amino acid enantiomers in beers and raw materials used for their manufacture. Journal of Chromatography A, 2000, 881 (1-2): 81-91.
[30] GOGAMI Y, OKADA K, OIKAWA T. High-performance liquid chromatography analysis of naturally occurring D-amino acids in sake. Journal of Chromatography B, 2011, 879(29): 3259-3267.
[31] MARCONE G L, ROSINI E, CRESPI E, POLLEGIONI L. D-amino acids in foods. Applied Microbiology and Biotechnology, 2020, 104(2): 555-574.
[32] PALLA G, MARCHELLI R, DOSSENA A, CASNATI G. Occurrence of D-amino acids in food: detection by capillary gas chromatography and by reversed-phase high-performance liquid chromatography with L-phenylalaninamides as chiral selectors. Journal of Chromatography A, 1989, 475(1): 45-53.
[33] GENCHI G. An overview on D-amino acids. Amino Acids, 2017, 49: 1521-1533.
[34] PÄTZOLD R, NIETO-RODRIGUEZ A, BRÜCKNER H. Chiral gas chromatographic analysis of amino acids in fortified wines. Chromatographia, 2003, 57(Suppl. l): 207-211.
[35] PRANDI B, FACCINI A, LAMBERTINI F, BENCIVENNI M, JORBA M, DROOGENBROEK B V, BRUGGEMAN G, SCHÖBER J, PETRUSAN J, ELST K, SFORZA S. Food wastes from agrifood industry as possible sources of proteins: a detailed molecular view on the composition of the nitrogen fraction, amino acid profile and racemisation degree of 39 food waste streams. Food Chemistry, 2019, 286: 567-575.
[36] ALI H, PÄTZOLD R, BRÜCKNER H. Determination of L- and D-amino acids in smokeless tobacco products and tobacco. Food Chemistry, 2006, 99(4): 803-812.
Enantiomeric Analysis of Free Amino Acids in Different Teas
ZHU Yin, ZHANG Yue, YAN Han, LÜ HaiPeng, LIN Zhi
Tea Research Institute, Chinese Academy of Agricultural Sciences/Key Laboratory of Tea Biology and Resource Utilization of Ministry of Agriculture, Hangzhou 310008
【】Free amino acids are the main chemical compositions in teas, and they are closely related to the taste quality of tea. In account of the existence of stereogenic centers, most amino acids contain two enantiomers (D and L configurations) with obviously different taste characteristics and biological activities. However, due to the limitation of detection technology, the studies of L-amino acids were focused in the previous work, and the D-amino acids have been rarely studied. Therefore, the study on the enantiomers of free amino acids in teas is very important for deepening the theoretical system of tea chemistry and is beneficial for improving and controlling of tea taste quality. 【】In this study, the separation performance of free amino acid enantiomers (Chiral HPLC, Silanization of mtbstfa and Esterification PFP acylation) was compared by using three different analytical methods. A total of 15 pairs of amino acids, including alanine, valine, threonine, isoleucine, leucine, proline, serine, cysteine, aspartic acid, methionine, phenylalanine, glutamic acid, tyrosine, lysine and tryptophan, were effectively separated by using esterification- pentafluoropropionic acylation combined with chiral gas chromatography-mass spectrometry (GC-MS). Furthermore, the efficient derivatization, qualitative and quantitative analysis approaches were established, and the distribution regularities of amino acids enantiomers in 11 representative commercial white, oolong and pu-erh teas were investigated. 【】The derivatization conditions were showed as follows: the reaction mixture was esterified at 100ºC for 105 min, and then further acylated by pentafluoropropionic anhydride using tetrahydrofuran as the solvent at 100ºC for 10 min. Recoveries of the free amino acid enantiomers were ranged from 75.26% to 123.6% (low concentration) and from 81.23% to 121.8% (high concentration), and the corresponding RSDs were ranged from 2.09% to 13.12% (low concentration) and from 1.48% to 10.59% (high concentration). The analysis results indicated that 1-2 enantiomers of most amino acids could be detected, and D-amino acids were frequently distributed in most tea samples, especially D-threonine, D-aspartic acid, D-cysteine, D-phenylalanine, and the mixture of D-theanine, D-glutamic acid and D-glutamine. On the contrary, D-methionine, D-lysine and D-tryptophan were unable to be detected in all samples. As for the detailed content distributions, in addition to the mixture of L-theanine, L-glutamic acid and L-glutamine and L-aspartic acid, L-cysteine (1.48-2.08 mg∙g-1), D-cysteine (1.46-1.49 mg∙g-1), L-serine (0.15-1.80 mg∙g-1) and D-aspartic acid (1.02-1.14 mg∙g-1) presented higher contents in white teas, L-cysteine (1.52-1.70 mg∙g-1), D-cysteine (1.45-1.49 mg∙g-1), L-serine (1.03-1.50 mg∙g-1), L-methionine (1.03-1.52 mg∙g-1), L-tyrosine (1.32-1.35 mg∙g-1) and D-aspartic acid (1.01-1.15 mg∙g-1) were abundant in oolong teas. In pu-erh teas, no significant differences on the contents between the mixture of L-theanine, L-glutamic acid and L-glutamine (1.04 mg∙g-1) and other amino acids, and L-threonine, L-tryptophan, and L-serine presented relatively high content levels ranging from 0.61 to 0.84 mg∙g-1. The content distribution of the total amino acids were presented the following tendency: white tea (up to 40.61 mg∙g-1) > oolong tea (up to 25.43 mg∙g-1) > pu-erh tea (8.01 mg∙g-1). Moreover, multivariate statistical analysis results indicated that the mixture of L-theanine, L-glutamic acid and L-glutamine, L-tryptophan, L-aspartic acid, L-tyrosine and L-methionine showed significant content differences, and the first three enantiomers were abundant in white teas, and other compounds were rich in oolong teas.【】D-amino acids could be detected in most teas, indicating their potential impact on the taste quality of tea infusion. However, no significant differences on the content distribution of D-amino acids were observed among different kinds of teas used in our study.
tea; free amino acids; enantiomers; gas chromatography-mass spectrometry; pentafluoropropionic anhydride

10.3864/j.issn.0578-1752.2021.04.012
2020-05-19;
2020-09-27
国家自然科学基金(31701702)、浙江省自然科学基金(LQ15C160007)、现代农业产业技术体系建设专项资金(CARS-19)、中国农业科学院创新工程(CAAS-ASTIP-2014-TRICAAS)
朱荫,Tel:0571-87967281;E-mail:zhuy_scu@tricaas.com。通信作者林智,Tel:0571-86650617;E-mail:linzhi@caas.cn
(责任编辑 赵伶俐)
