柚皮素对脂肪间充质干细胞增殖的影响
2021-03-08吴雅廷刘海亮
吴雅廷,刘海亮,2
(1.石河子大学生命科学学院新疆植物药资源利用教育部重点实验室,新疆 石河子 832003;2.同济大学附属东方医院再生医学研究所,上海 200123)
柚皮素是一种黄酮类化合物,主要存在于柑橘类的水果中[1-2],国内外研究表明柚皮素具有抗氧化[3]、抗癌[4]、抗衰老[5]、神经保护[6]等多种生物活性功能。研究发现柚皮素对多种细胞的活力有一定的调控作用,例如对血管内皮细胞活力具有明显的促进作用[7];对神经小胶质细胞的增殖具有一定的促进作用[8],并且能够抑制神经细胞凋亡[9]。相关研究提出柚皮素对脂肪间充质干细胞(adipose-derived stem cell,ADSC)中相关基因的表达具有一定的调控作用[10-11],因此探究柚皮素对脂肪间充质干细胞细胞活力是否具有一定的影响具有一定的研究意义。
ADSC因其具有自我更新速度快、能够稳定增殖、具备多项分化潜能的特点[12],作为临床上较为理想的干细胞治疗的细胞来源[13],有关其维持细胞干性功能的研究具有非常重要的意义[14-15]。
本实验通过柚皮素对体外培养的ADSC的干预作用探究其对ADSC增殖情况的影响。该实验过程中通过探究柚皮素对ADSC的细胞周期及与ADSC增殖相关的P16ink4a的蛋白表达情况、活性氧类(ROS)含量、细胞衰老状况的影响,了解了柚皮素对ADSC增殖的影响。
1 材料与方法
1.1 材料
成人脂肪间充质干细胞来源于同济大学表观遗传学实验室,细胞鉴定工作在实验室前期相关实验中已经完成[16]。
DMEM/F12培养基和胎牛血清沟自于美国Gibco公司。柚皮素(HPLC>98%)购自于北京世纪奥科生物技术有限公司。CCK-8试剂盒、细胞周期试剂盒、活性氧(ROS)检测试剂盒、β-半乳糖苷酶染色试剂盒购自于碧云天生物技术有限公司、P16ink4a-抗体及兔抗体购自英国Abcam公司。
1.2 方法
1.2.1 细胞培养与药物处理 ADSC培养于含10%胎牛血清的DMEM/F12培养基中,培养条件为37℃、5%CO2的细胞培养箱。当细胞浓度达到80%~90%时,用0.25%Trypsin EDTA消化细胞,按照1∶3的比例对细胞进行传代培养。按照作用于细胞的柚皮素浓度不同,以低浓度(6.25μmol/L)、中间浓度(25μmol/L)、高浓度(100μmol/L)的浓度梯度加入96孔板处理细胞24h,其中对照组以等体积的PBS取代柚皮素对细胞进行干预。
1.2.2 CCK-8法检测细胞增殖 收集对数生长期的细胞以5×103/孔接种于96孔板,每组设置5个复孔,贴壁培养过夜后柚皮素干预24h和48h后,每孔加10μL CCK-8溶液并使其混合均匀。使用酶标仪在450nm波长处检测吸光值。该实验进行3次以上统计分析。
1.2.3 流式细胞仪检测细胞周期 收集对数生长期的细胞以1×104/孔接种于6孔板,每组设置3个复孔,贴壁培养过夜后柚皮素干预24h后,终止培养,用0.25%Trypsin EDTA消化细胞,离心(离心半径13.5cm,1000r/min,5min)并弃上清液,预冷PBS洗涤细胞3次。用预冷的70%无水乙醇固定过夜,再加入碘化丙啶(propidium iodide,PI)染色液200μL,避光染色 30min,用流式细胞仪在激发波长488nm波长处检测染色结果,用FlowJo软件分析细胞周期。该实验进行3次以上统计分析。
1.2.4 Western印迹法检测P16ink4a的表达水平 收集对数生长期的细胞以1×104/孔接种于6孔板,每组设置3个复孔,贴壁培养过夜后柚皮素干预24h后,终止培养吸去上清加入无酶RIPA细胞裂解液置于冰上裂解10min,4℃离心(离心半径13.5cm,12000r/min,10min)收集蛋白,利用BCA蛋白浓度测定试剂盒测定hADSC蛋白浓度,调整蛋白浓度保持一致加蛋白上样缓冲液混匀并煮沸。进行SDS-PAGE电泳(120V,60min),根据三色预染蛋白marker和P16ink4a蛋白大小进行切胶,按照转膜的“三明治”结构进行转膜(60V,80min),封闭液室温封闭1h,加P16ink4a抗体按1∶1000稀释好后4℃孵育过夜并洗去多余的一抗,再用兔抗体(1∶10000)孵育2h。利用化学发光法检测蛋白表达情况,利用雅酶试剂盒将发光液(A液∶B液=1∶1)加到PVDF膜上,孵育3min。吸去多余的液体在化学发光成像系统(ImageQuant LAS)进行灰度分析。该实验进行3次以上统计分析。
1.2.5 β-半乳糖苷酶染色 收集对数生长期的p16代次的细胞以5×103/孔接种于12孔板,每组设置3个复孔,在37℃、5%CO2细胞培养箱贴壁培养过夜后,用含柚皮素的培养基培养细胞24h后,无菌PBS洗涤12孔板中贴壁细胞3次,每孔加入4%多聚甲醛细胞固定液100μL室温固定细胞30min并吸去固定液,用PBS冲洗2遍。用细胞β-半乳糖苷酶染色试剂盒进行染色,每孔加染色液100μL(A液1%、B液1%、C液93%、X-Gal染液5%),37℃培养箱避光染色过夜,PBS冲洗2遍,用DAPI(0.1%)染色液染核,PBS冲洗2遍,每孔再加500μL无菌PBS使细胞保持湿润,在倒置荧光显微镜下观察细胞染色结果,观察过程中选取5个规定区域,对每个区域总细胞进行计数和染色细胞计数取平均值。该实验进行3次以上统计分析。
1.2.6 细胞内ROS检测 收集对数生长期的细胞以5×103/孔接种于96孔板,每组设置5个复孔,在37℃,5%CO2细胞培养箱贴壁培养过夜后柚皮素干预24h后,再加入ROS检测试剂5μL避光继续培养30min。使用iD3酶标仪在480、525nm 处检测吸光值分析ADSC内ROS含量。
1.2.7 mRNA测序 6孔板培养脂肪间充质干细胞,浓度为25μmol/L柚皮素处理细胞24h后吸去培养基,用PBS冲洗2~3次,加入一定量TRIzol(美国Invitrogen公司)裂解细胞并提取总RNA,并用分光光度计(美国Thermo公司)对总RNA进行定量。对符合质量标准(A260/A280>1.8)的样品进行测序。数据分析基于高通量测序结果,建立参照基因组索引:Bowtie v2.0.6(bowtie-bio.source-forge.net/bowtie2)计算每个样本的基因表达水平。差异基因表达通过热图和KEGG(Kyoto Encyclopedia of Genes and Genomes;https:∥www.genome.jp/kegg)进行分析。KEGG分析时,P<0.05作为判断基因显著富集的阈值。测序数据可以根据需要联系通信作者,予以提供。
1.3 统计学处理
2 结 果
2.1 柚皮素对ADSC增殖的影响
不同浓度柚皮素干预24、48h后ADSC的细胞活性检测结果如图1所示,当不同浓度柚皮素干预24h后,与对照组相比,当柚皮素在低浓度(6.25μmol/L) 时增殖率为95.8%,与对照组之间差异无统计学意义,在中间浓度(25μmol/L)时明显促进了细胞的增殖(P<0.01),细胞的增殖速率为120.3%;在高浓度(100μmol/L) 时增殖率为51.6%(P<0.01),对细胞增殖具有明显的抑制的作用。干预48h后细胞活力检测结果如图1所示,在低浓度(6.25μmol/L)时增殖率为97.9%,与对照组相比,差异无统计学意义;在中间浓度(25μmol/L)时增殖率为114.6%与对照组相比具有明显的促进作用(P<0.05),在高浓度(100μmol/L)时增殖率为48%(P<0.01),对细胞增殖具有明显的抑制作用。柚皮素干预细胞24、48h后,检测结果均表现出浓度为25μmol/L时对细胞增殖具有明显的促进作用,而在低浓度 (6.25μmol/L) 时对细胞增殖无明显的促进作用,在高浓度(100μmol/L)时对细胞的增殖具有明显的抑制作用。
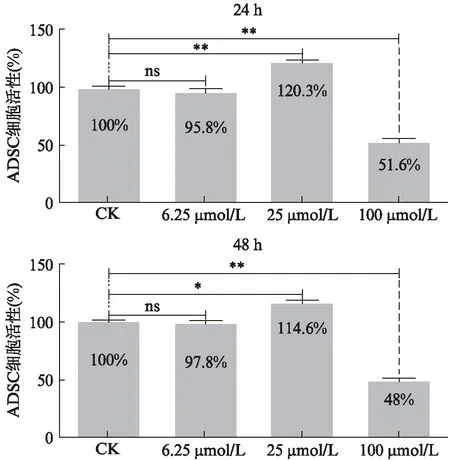
图1 不同浓度柚皮素干预下ADSC的增殖情况Fig.1 Effects of different concentrations of naringenin on cell proliferation*P<0.05,**P<0.01;ns:差异无统计学意义
2.2 柚皮素对ADSC细胞周期的影响
根据2.1的结果,即柚皮素浓度为25μmol/L时促进了细胞的增殖,进一步检测了不同浓度对ADSC细胞周期的影响。药物干预后细胞周期变化情况如图2所示,流式细胞术结果表明,当柚皮素浓度为 25μmol/L 干预细胞后,与对照组相比,G1期细胞比例减少,快速进入S期,S期细胞比例增加,G2/M期细胞所占比例差异无统计学意义。细胞流式数据统计分析结果表明,柚皮素浓度为25μmol/L时,在G0/G1期细胞所占比例明显低于对照组(P<0.05),S期细胞所占比例明显高于对照组,G2/M差异无统计学意义。同时从图中可以看出,当柚皮素浓度为6.25、100μmol/L时对细胞周期无明显影响。

图2 柚皮素对ADSC细胞周期的影响Fig.2 Effect of naringenin on cell cycle of ADSC*P<0.05;不同浓度均含2个重复样品
2.3 柚皮素对P16ink4a的表达水平的影响
P16ink4a的表达对细胞周期具有一定的影响,因此进一步通过Western印迹法对P16ink4a蛋白在细胞中的表达情况进行了检测。实验结果表明浓度当浓度为25μmol/L时的柚皮素干预24h后,与对照组相比P16ink4a的蛋白明显下调(P<0.05),见图3。

图3 柚皮素干预后P16ink4a的蛋白表达水平的变化Fig.3 Changes of the P16ink4a expression of ADSC following exposure to naringenin*P<0.05
2.4 柚皮素对细胞衰老的影响
通过β-半乳糖苷酶染色检测柚皮素对细胞衰老情况的影响。选取衰老代次细胞(p16代)并用柚皮素处理细胞24h后观察细胞衰老的结果。β-半乳糖苷酶染色实验结果如图4所示,实验组衰老的细胞明显少于对照组在正常情况下衰老的细胞,3次染色统计结果对照组与实验组相比差异有统计学意义(P<0.01),该结果进一步表明柚皮素能够促进hADSC增殖而抑制其衰老。

图4 柚皮素对衰老细胞的影响Fig.4 Effect of naringenin on the aging of ADSC**P<0.01
2.5 柚皮素对细胞内活性氧含量的影响
氧化应激对细胞的增殖具有重要的影响,其中细胞内ROS含量的变化是一个非常重要的检测指标。柚皮素干预24h后,ADSC细胞内ROS含量受到了影响,与对照组相比当柚皮素浓度为25μmol/L 时抑制了细胞内ROS含量的增加(下降到70%,P<0.01)。
2.6 mRNA测序结果分析
根据2.1~2.5实验结果,对柚皮素干预后的ADSC进行了mRNA测序。当柚皮素浓度为25μmol/L 时处理ADSC后与对照组相比较有933个差异表达的基因,其中表达上调的基因有288个,表达下调的基因有645个。KEGG信号通路富集分析结果如图5A所示,结果显示核苷酸结合寡聚结构域样受体信号通路、吞噬小体、蛋白多糖及矿物吸收受到明显的调控。其中结瘤样受体信号通路对细胞增殖具有一定的调控作用[17-18],基因集富集分析结果如图5B所示,基因集标准富集得分NES值为2.37(P=0.003),基因集成员显著聚集在顶部,表明柚皮素处理对该信号通路中基因基因富集情况有明显影响;并对受该信号通路调控的基因通过热图进行了差异表达分析,结果如图5C所示,当柚皮素浓度为25μmol/L时处理ADSC后与对照组相比较,DPP4、STAT1、SFRP4、SOD2的表达量被上调了,其中SOD2的表达上调受到ROS含量降低的调控[19-20],因此SOD2上调与2.5实验结果相一致。
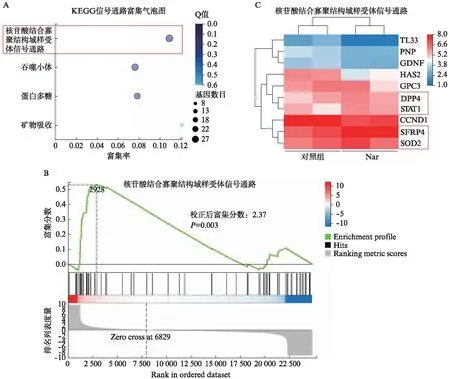
图5 mRNA测序结果分析Fig.5 Analysis of RNA-seq resultA:信号通路富集气泡图;B:基因集富集图;C:差异基因表达热图
3 讨 论
本研究通过检测不同浓度的柚皮素对体外培养的ADSC干预24h(P<0.01)和48h(P<0.05)后在浓度为25μmol/L时均能够明显促进ADSC增殖,而在低浓度6.25μmol/L时对细胞的增殖无明显影响,在高浓度100μmol/L时对细胞的增殖具有明显抑制作用。同时可以发现干预24h的增殖速率高于 48h,这一趋势与相关研究中提出的随着柚皮素干预时间的增加,相对应地,对细胞的作用效果逐渐减弱[21]的规律相一致,与此同时也可能与细胞对柚皮素的吸收效率[22]及对细胞的最佳作用时间[23]有密切联系。
接下来探究了不同浓度柚皮素对细胞周期的影响,结果表明柚皮素对ADSC细胞周期有一定的影响,当柚皮素浓度为25μmol/L时能够促进细胞周期快速从G0/G1期快速进入S期(P<0.05),即显著促进细胞进入增殖期使细胞快速增殖。癌基因P16ink4a与hADSC的增殖密切相关,阻断P16ink4a基因的表达有助于改善生理性衰老对干细胞功能的抑制,P16ink4a基因在细胞中的表达情况在一定程度上能够反映出ADSC是否存在增殖停滞或增殖缓慢[24]。因此,在接下来的实验中对P16ink4a蛋白表达情况进行了检测,检测结果表明,与对照组相比柚皮素干预后P16ink4a蛋白表达量明显下调(P<0.05)。P16ink4a蛋白的表达情况与细胞的衰老状况紧密相关[25-26],因此对柚皮素干预后细胞的衰老状况进行了检测,实验结果表明柚皮素对ADSC的衰老具有明显的抑制作用(P<0.01),这也进一步证明柚皮素对ADSC的增殖有一定的促进作用。同时有研究表明抑制细胞衰老对细胞增殖具有一定的促进作用[27],其重要原因表现在细胞衰老是由于细胞周期阻滞使细胞增殖速度变慢[28]、P16ink4a基因的高表达等因素促进了细胞的衰老使细胞增殖活性降低[29]。因此,该实验结果对细胞衰老与细胞增殖之间的关系进行了验证。
另外,氧化应激对细胞的增殖也具有十分重要的调节作用,过度的氧化应激对ADSC的增殖具有明显抑制作用[30],ROS含量升高则会引起细胞功能障碍,导致细胞衰老[31]。进一步对细胞内ROS水平进行检测,结果发现与对照组相比,柚皮素干预后细胞内ROS水平明显降低(P<0.05),即柚皮素能够降低氧化应激对细胞带来的损伤。
以上实验结果表明柚皮素通过促进细胞周期从G0/G1期进入S期、下调P16ink4a基因的表达、抑制β-半乳糖苷酶含量的升高及下调细胞内ROS含量促进了ADSC的增殖。mRNA测序结果表明柚皮素干预ADSC后核苷酸结合寡聚结构域样受体信号通路受到明显的调控,相关研究表明该信号通路对细胞的增殖具有一定的调控作用[32-33]。并且进一步发现该信号通路能够激活SOD2基因表达,SOD2的表达受ROS的调控,ROS含量降低能够激活SOD2表达[34-35]。因此与前面结果中柚皮素能够促进ROS水平降低的结果相一致。测序结果表明,柚皮素能够通过激活核苷酸结合寡聚结构域样受体信号通路上调SOD2基因的表达,从而促进ADSC的增殖。
干细胞因其具有自我更新速度快、能够稳定增殖、具有多向分化潜能的特点,已被广泛应用于多种退行性疾病治疗的研究当中。尤其是ADSC在干细胞治疗领域具有极为广泛的研究,例如对脊髓损伤[36]、脑中卒[37]等疾病具有较为明显的治疗效果,另外,与其他来源的间充质干细胞相比较,ADSC来源较为广泛且取材比较容易[38],自体来源可避免发生免疫排斥,因此可作为临床上较为理想的干细胞治疗的细胞来源。但是,近年来研究发现ADSC在体外传代培养的过程中随着传代次数增加细胞有衰老的倾向[39],同时在体内也会随着个体的衰老出现功能的衰退[40],因此维持细胞干性功能的研究具有非常重要的意义[41]。
近年来,关于天然小分子化合物生物活性的研究越来越广泛,其中柚皮素作为一种研究较为广泛的小分子化合物,研究发现其具有抗肿瘤[42]、心脏保护[43]、抗氧化[44]、抗炎[45]等多种生物活性成分。另一方面,ADSC作为一种有潜力的间充质干细胞,具有广泛的应用前景,因此促进它在体外增殖速度,增强其增殖能力,将在ADSC的临床干细胞治疗方面提供一定的应用基础。
