竹节参水提物对宫颈癌Hela 细胞凋亡的影响
2021-03-07刘滢,黄宙
刘 滢,黄 宙
(1.湘潭医卫职业技术学院,湖南湘潭 411102;2.湘潭市中心医院,湖南湘潭 411100)
竹节参为五加科植物,性温、味甘、味苦,具有滋补强壮、散瘀止痛及止血祛痰功效[1-4],广泛用于产后虚弱、咳嗽痰多及跌打损伤患者中[5]。现代药理结果表明[6],竹节参具有抗炎、延缓衰老、降血糖及抗肿瘤作用。皂苷是竹节参的主要活性成分(约占23.6%),且三萜类皂苷具有较高含量,具有解热、抗菌、抗癌等生物作用。国内学者研究表明[7],天然药物具有较低的毒副作用,临床使用时不宜产生耐药性,且对实体瘤具有良好的疗效,但是在宫颈癌中的作用机制研究相对较少。因此,本研究以宫颈癌Hela 细胞作为对象,探讨竹节参水提物在宫颈癌Hela细胞中的作用机制及对细胞凋亡的影响,以期为宫颈癌治疗提供新思路。
1 材料
1.1 细胞 宫颈癌Hela 细胞购于中国科学院细胞库,将其接种在含10% 胎牛血清的RMPI-1640 培养基中,在含5%CO2的37 ℃培养箱中培养,待细胞融合80%后进行传代培养,取第3 代对数生长者,备用。
1.2 药材 竹节参产地湖北恩施,购于恩施竹节参种植基地,经专家鉴定为正品。将药材根茎干燥粉碎后纯净水回流提取3 次,滤液浓缩,即得提取物,提取率为25.8%,加入 DMEM 培养基依次制成 0(阴性对照)、50、100、150 μg/mL。
1.3 仪器 见表1。
表1 仪器信息
2 方法
2.1 细胞处理 取第3 代培养的宫颈癌Hela 细胞,0.25%EDTA 进行消化,调整细胞浓度为1×105/mL,接种在96 孔细胞培养板中,每孔100 μL,于37 ℃、5% CO2培养箱中至单层细胞。将0(阴性对照)、50、100、150 μg/mL 竹节参提取物分别加入宫颈癌Hela 细胞中(100 μL/孔),每种质量浓度设置5 个复孔,将培养板放置在37 ℃、5%CO2培养箱中,连续进行48 h 培养[8]。
2.2 细胞凋亡测定 采用一步法TUNEL 染色测定。取各组处理后的细胞,加入0.25% EDTA-胰蛋白酶完成细胞消化,调整细胞密度为2×105/mL,接种在96 孔板中,每孔200 μL,放入培养箱中48 h。在12、24、36、48 h 后向细胞中滴加TUNEL 检测液(含TdT 酶2 μL、荧光标记液48 μL),避光孵育,荧光显微镜下观察细胞情况,并且在波长480 nm、发射光540 nm 处测定OD值,每张图片取5 个视野,在400 倍下完成凋亡细胞核计数,获得凋亡率[9]。
2.3 细胞周期测定 采用流式细胞计数仪测定。取生长良好的宫颈癌Hela 细胞,调整细胞浓度为1×105/mL,接种在6 孔培养板中,连续培养24 h 后换入新鲜培养基,连续培养48 h 后加入不含乙二胺四乙酸(EDTA)的0.25%胰蛋白酶消化悬浮,4 ℃下收集细胞。采用预冷的PBS 缓冲液(pH 值为7.4)对细胞冲洗2 次,加入-20 ℃预冷的乙醇3 mL,吹打均匀后放置在-20 ℃冰箱中固定24 h。测定前对各组细胞离心10 min(1 424×g),PBS 缓冲液冲洗2次,去除上层清液后重悬于200 μL 0.1 mmol/L EDTA 溶液中,30 min 避光孵育后加入35 μL 2% Tritonx-100、114 μL 150 μg/mL PI 溶液,充分混合后避光反应10 min,将最终获得的混合液于EPICS XL 型流式细胞仪中完成细胞周期测定[10]。
2.4 细胞形态观察 采用Hoechst 33342 荧光染色观察。取不同质量浓度竹节参水提物处理后的细胞,离心10 min后去除上层清液,加入10 g/L Hoechst 33342 荧光染色液,避光染色10 min 后去除染液,PBS 洗涤2 次后涂片,晾干后在荧光显微镜下观察,波长为340 nm,保存结果[11]。
2.5 凋亡相关基因测定
2.5.1 RNA 提取 向各组处理后的细胞中加入500 μL trizol,混合、均匀后加入氯仿0.2 mL,剧烈振荡15 s,常温下静置2~3 min 后离心15 min(12 000 r/min),获得3层液体(上层为水相,中间层与下层为有机相)。取RNA沉淀,转移到新的EP 管中,加入0.5 mL 异丙醇,混合后放在-20 ℃冰箱中,10 min 离心(1 194×g),获得凝胶状沉淀(即为RNA)。充分洗涤RNA,加入250 μL DEPC、750 μL 乙醇,乙醇冲洗沉淀,离心5 min(2 315×g),取沉淀放入工作台上干燥20 min。利用紫外分光度仪检测RNA 浓度,并完成RNA 提纯(以核糖核酸酶作为空白对照),在260 nm 波长处测定吸光度。采用脱氧核糖核酸酶处理RNA 后,放入冰箱中[12]。
2.5.2 PCR 检测 采用半定量逆转录-聚合酶链反应(RTPCR)法测定P53、Bax、Casepase-3 mRNA 表达水平,引物序列见表2。设定PCR 反应条件为30 ℃,10 min;42 ℃,30 min;99 ℃,5 min;5 ℃,5 min,连续进行35个循环,最后在72 ℃下完成10 min 延长。扩增产物放入1.5%琼脂凝胶中电泳,完毕后采用UVP 凝胶图像完成灰度值的测定,以β-actin为内参[13]。

表2 引物序列
2.6 统计学分析 通过SPSS18.0 软件进行处理,计数资料以百分率表示,组间比较采用卡方检验;计量资料以()表示,组间比较采用t检验。P<0.05 表示差异有统计学意义。
3 结果
3.1 竹节参水提取物对宫颈癌Hela 细胞增殖的抑制作用 竹节参水提取物对宫颈癌Hela 细胞增殖具有明显的抑制作用,并呈浓度、时间依赖性,36 h 后可达50.0%以上,见表3。
3.2 竹节参水提取物对宫颈癌HeLa 细胞周期的影响 竹节参水提取物主要作用于宫颈癌Hela 细胞G0/G1期与S期,随着其剂量升高逐渐集中于G0/G1期,见表4。
3.3 竹节参水提取物对宫颈癌HeLa 细胞形态的影响 Hoechst 33342 荧光染色显示,0 μg/mL 竹节参水提物下Hela细胞形态均一,结构相对完整;在50、100、150 μg/mL下,Hela 细胞开始出现凋亡,细胞形态固缩,可见凋亡小体,并且剂量越高,细胞凋亡越明显,见图1。
表3 竹节参水提取物对宫颈癌Hela 细胞增殖的抑制作用(%,, n=4)

表3 竹节参水提取物对宫颈癌Hela 细胞增殖的抑制作用(%,, n=4)
注:与0 μg/mL 比较,∗P<0. 05;与12 h 比较,#P<0.05。
表4 竹节参水提取物对宫颈癌Hela 细胞周期的影响(%,, n=4)
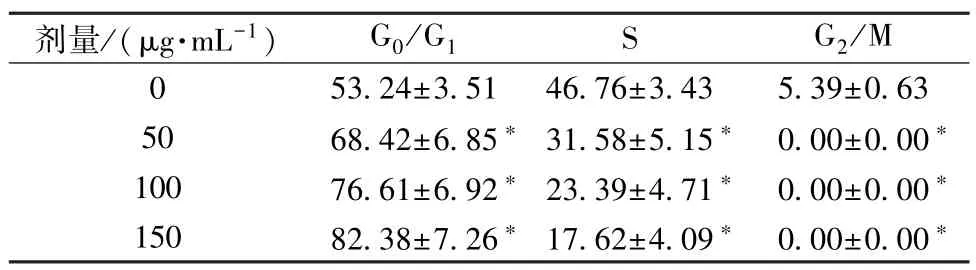
表4 竹节参水提取物对宫颈癌Hela 细胞周期的影响(%,, n=4)
注:与0 μg/mL 比较,∗P<0.05。

图1 不同剂量竹节参水提取物下宫颈癌Hela 细胞形态
3.4 竹节参水提取物对宫颈癌HeLa 细胞凋亡基因表达的影响 竹节参水提取物可增加宫颈癌Hela 细胞中P53、Bax、Caspase-3 mRNA 表达,并呈浓度依赖性,见表5、图2。
表5 竹节参水提取物对宫颈癌Hela 细胞凋亡基因表达的影响(, n=4)

表5 竹节参水提取物对宫颈癌Hela 细胞凋亡基因表达的影响(, n=4)
注:与0 μg/mL 比较,∗P<0.05。
4 讨论
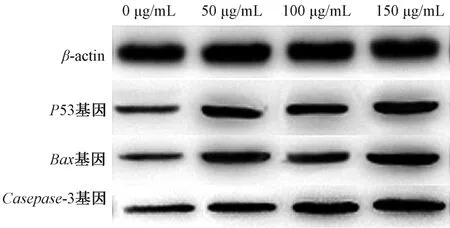
图2 不同剂量竹节参水提取物下宫颈癌HeLa细胞凋亡基因表达
宫颈癌是女性发生率较高的恶性肿瘤,具有发病率高、治愈率低、致死率高等特点[14]。目前,化疗、手术与放疗占据宫颈癌治疗的主要地位,但是无论何种方法均存在明显的局限性,且治疗均无法做到彻底、副作用较大,患者治疗后复发率较高,导致患者远期生存率较低[15]。竹节参是临床上常用的中药,具有滋补强壮、散瘀止痛、止血祛痰等作用[16]。体外及动物实验结果表明[17],竹节参水提物对于肝癌、鼻咽癌、肺癌及胃癌等实体瘤具有良好的抗肿瘤作用,能抑制肿瘤细胞的增殖与生长,诱导肿瘤细胞凋亡。同时,竹节参水提物能抑制血管的形成,有助于增强机体免疫功能。有研究表明[18]:竹节参具有抗炎及潜在的抗肿瘤作用,其水提物能显著增强机体免疫水平,能抑制肿瘤细胞的生长。因此,本研究基于当前研究,分析了竹节参水提物对于宫颈癌HeLa 细胞的作用机制,结果表明:竹节参水提取物对宫颈癌Hela 细胞增殖具有明显的抑制作用,且呈浓度依赖性,能促进细胞凋亡,且细胞的凋亡率随着竹节参水提取物浓度、作用时间的延长增加,36 h时竹节参水提取物对宫颈癌Hela 细胞增殖抑制基本达到50.0%以上;竹节参水提取物作用于宫颈癌Hela 细胞G0/G1期与S 期;随着竹节参水提取物浓度升高,竹节参水提取物对于宫颈癌Hela 细胞作用集中于G0/G1期,说明竹节参水提物能抑制宫颈癌HeLa 细胞的增殖、生长,能促进细胞凋亡,药物多作用于细胞生长初期,且药物浓度越高,作用效果越明显。
细胞凋亡指为维持内环境稳定,由基因控制的细胞自主、有序的死亡。细胞凋亡有别于细胞坏死,其过程不是被动的过程,而是主动的过程,多涉及基因的激活、表达与调控作用,是为了更好的适应生存而主动争取的一种死亡过程[19]。但是,对于肿瘤细胞而言其生长无限增殖,导致细胞凋亡紊乱,会对宿主产生明显的不适,严重者可危及生命。P53 基因属于人体抑癌基因,含有大量的脯氨酸,其失活对肿瘤的形成具有重要的意义。临床研究表明[20],P53 基因是相对重要的抗癌基因,其野生型能诱导细胞凋亡,防止癌变的发生,亦可辅助细胞基因修复。但是,P53基因发生突变后,则会增加癌变发生率。Bax 基因属于兔抗人单克隆抗体,属于Bcl-2 基因家族中细胞凋亡的促进基因,其过度表达能拮抗Bcl-2 的保护效应,能使得细胞趋于死亡。研究表明:Bax 基因是人体主要凋亡基因,可与Bcl-2 形成异二聚体,能抑制Bcl-2 的产生,是人体相对重要的促细胞凋亡基因之一。Caspase-3 在细胞凋亡中具有不可替代的作用,可以被多种因素活化,在CTL 细胞杀死中发挥重要作用。临床研究表明:Caspase-3 与DNA 修复、基因完整性监护等有关。本研究中,Hoechst 33342 荧光染色结果表明:竹节参水提物0 μg/mL 时HeLa 细胞形态均一且结构相对完整;而竹节参水提取物 50、100、150 μg/mL下HeLa 细胞开始出现凋亡,细胞形态固缩,可见凋亡小体;竹节参水提取物能增加宫颈癌HeLa 细胞中凋亡相关基因P53、Bax、Caspase-3 mRNA 表达,且竹节参水提取物浓度越高,凋亡相关基因P53、Bax、Caspase-3 mRNA 表达越高,说明竹节参水提物能诱导细胞凋亡,能增加凋亡基因表达水平,进一步促进肿瘤细胞凋亡。
综上所述,竹节参水提物体外能抑制宫颈癌HeLa 细胞增殖,能诱导癌细胞的自噬与凋亡,可能与调控凋亡相关基因mRNA 表达有关,具有潜在的抗癌作用。