BVDV、BRV 和BCoV TaqMan 三重RT-qPCR 检测方法的建立
2021-03-07孙亚杰关平原周伟光徐晓静希尼尼根于景丽
孙亚杰,关平原,周伟光,徐晓静,希尼尼根,于景丽
(1.内蒙古农业大学兽医学院,农业农村部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018;2.内蒙古大学生态与环境学院,内蒙古呼和浩特 010021)
近年来,犊牛腹泻的发病率呈上升趋势,给养牛业造成了巨大经济损失。牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)、牛轮状病毒(bovine rotavirus,BRV)和牛冠状病毒(bovine coronavirus,BCoV)是引起牛腹泻性疾病的3 种重要病原[1-3]。这些病原广泛分布于世界各地[1-4]。BVDV 主要侵害幼龄牛。牛感染BVDV 的临床症状主要表现为腹泻、肺炎、繁殖障碍和黏膜病等。该病传播迅速,感染率和发病率均较高[1]。BRV主要感染1~10 日龄犊牛。犊牛感染后临床表现为水样腹泻、严重脱水和酸中毒,成年牛感染后多呈隐性经过[2]。BCoV 是引起犊牛腹泻、成年牛冬血痢和呼吸道疾病的主要病原,主要导致新生犊牛出血性腹泻,成年牛冬季严重水样腹泻等[4-6]。
BVDV、BRV 和BCoV 混合感染频率较高,感染后患畜临床症状极为相似且不易识别[1-3,7],因此建立一种针对BVDV、BCoV 和BRV 的快速准确、灵敏度高、特异性强的检测方法势在必行。传统的病原分离鉴定及血清学诊断方法不仅耗时费力,而且敏感性和特异性都较差[8],已不能满足临床诊断需要。随着分子生物学的快速发展,PCR成为检测病原的首选方法。而多重PCR 方法可在同一PCR 反应体系中实现多种病原体或基因的同步检测,大大缩短了检测时间,节省了试剂用量[9]。实时荧光定量PCR(qPCR)在原有PCR 基础上与荧光检测方法结合,实现了PCR 从定性到定量的飞跃,具有灵敏度高、特异性强的优点[10-13],还有效规避了普通PCR 污染环境和检测结果容易出现假阳性的弊端。鉴于此,本研究根据GenBank 中已登录的BVDV 5'-UTR、BRVNSP5和BCoVN基因序列设计特异性引物和探针,通过优化反应体系和条件[9-14],建立同时检测3 种病毒的TaqMan 三重RT-qPCR 检测方法,为快速鉴别牛腹泻性疾病病原奠定基础,亦可为多种病原混合感染的诊断提供方法。
1 材料与方法
1.1 核酸样品
BVDV-1 型核酸样品,由本实验室保存;BRV、BCoV 核酸样品,均由哈尔滨兽医研究所馈赠;BVDV-2 型、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)、牛副流感病毒(bovine parainfluenza virus,BPIV)以及魏氏梭菌(Clostridium perfringens,Cp)A 型、B 型、D型(CpA、CpB、CpD)和多杀性巴氏杆菌(Pasteurella multocida,Pm)A 型、B 型(PmA、PmB)核酸样品,均由金宇保灵生物公司馈赠;用于临床样品检测的29 份牛腹泻粪便拭子样本,采自内蒙古地区规模化牛场,所提取的核酸样品由本实验室保存。
1.2 主要试剂
One Step PrimeScript ™ RT-PCR Kit(Perfect Real Time)、DL500 DNA Marker、pMD19-T 载体、DH5ɑ 感受态细胞,均购自TaKaRa 公司;质粒小量提取试剂盒、琼脂糖凝胶DNA 回收试剂盒,均购自南京诺唯赞生物科技有限公司。
1.3 引物设计与合成
参照GenBank 中已登录的BVDV-1 5'-UTR(AF091605.1、M96751.1、NC_001461.1、KT896495.1、KR866116.1)、BVDV-2 5'-UTR(KC963968.1、AF502399.1、GQ888686.2、FJ527854.1、AF002227.1)、BRVNSP5(GU937876.12、FJ206081.1、FJ206054.1、MF940692.1、JN831208.1)以及BCoVN(EU401981.1、EU401980.1、EF193074.1、KT318096.1、KM985634.11)基因序列,使用DNAstar 软件进行序列比对,通过确定每个基因中相对保守的区域来设计3 种病毒对应的特异性引物以及由不同发光基团标记的探针(表1)。引物和探针均由上海生工生物有限公司合成。
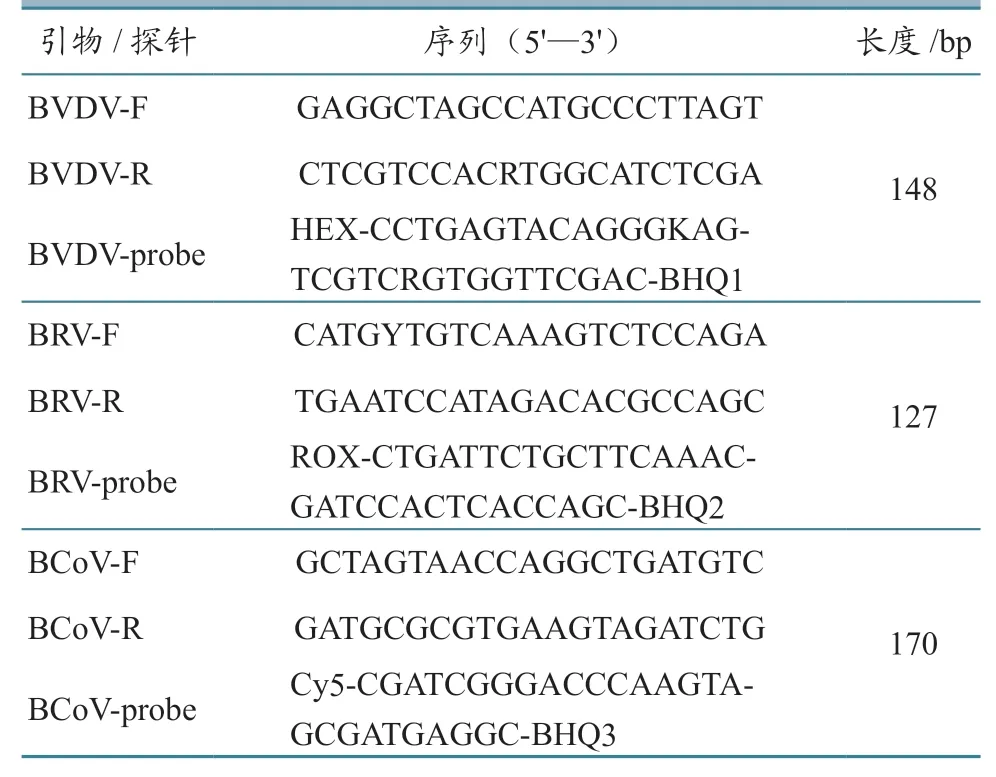
表1 TaqMan 三重RT-qPCR 的引物和探针序列
1.4 重组质粒标准品制备
以BVDV、BRV 和BCoV RNA 样品为模板,利用表1 中的引物,采用One Step PrimeScript ™RT-PCR 反应试剂盒进行RT-PCR 扩增。使用25.0 μL反应体系:2×One Step RT-PCR Buffer Ⅲ 12.5 μL,ExTaqHS 0.5 μL,PrimeScript RT Enzyme Mix Ⅱ0.5 μL,上、下游引物(10 μmol/L)各1.0 μL,模板2.0 μL,ddH2O 补至25.0 μL。反应条件为:52 ℃ 15 min,95 ℃ 2 min;94 ℃ 30 s、58 ℃ 30 s、72 ℃ 30 s,35 个循环;72 ℃ 7 min。PCR 产物纯化回收后,克隆至pMD19-T 载体构建重组质粒,选取测序正确的阳性重组质粒pMD19-T-BVDV、pMD19-T-BRV 和pMD19-T-BCoV 作为标准品。测定重组质粒浓度,并根据拷贝数计算公式换算成拷贝数备用[9]。
1.5 TaqMan 三重RT-qPCR 检测方法建立
1.5.1 反应条件优化
1.5.1.1 BVDV、BRV、BCoVTaqMan 单重RTqPCR 反应体系和条件优化 使用25.00 μL 反应体 系:2×one step RT-PCR buffer III 12.50 μL,ExTaqHS 0.50 μL,PrimeScript RT Enzyme Mix II 0.50 μL,BVDV、BRV 与BCoV 上下游引物用量(50 μmol/L)设置5 个梯度(0.12、0.14、0.16、0.18、0.20 μL),BVDV、BRV 与BCoV 探针用量(10 μmol/L)设置5 个梯度(0.60、0.70、0.80、0.90、1.00 μL),模板2.00 μL,最后ddH2O 补充至25.00 μL。设置5 个退火温度梯度:52、54、56、58 和60 ℃。对BVDV、BRV 与BCoV 分别进行TaqMan 单重RT-qPCR 反应条件优化。
1.5.1.2 BVDV 与BCoVTaqMan 双重RT-qPCR反应体系和条件优化 使用25.00 μL 反应体系:2×one step RT-PCR buffer III 12.50 μL,ExTaqHS 0.50 μL,PrimeScript RT Enzyme Mix II 0.50 μL,确定BVDV 与BCoV 单重RT-qPCR 反应体系后,使用矩阵法将BVDV 引物用量(50 μmol/L)设置3 个浓度梯度(0.16、0.20、0.24 μL),将BCoV 引物用量(50 μmol/L)设置3 个梯度(0.16、0.20、0.24 μL),BVDV 的探针用量(10 μmol/L)设置3 个梯度(0.80、1.00、1.20 μL),BCoV的探针用量(10 μmol/L)设置3 个梯度(0.50、0.70、0.90 μL),模板2.00 μL,最后ddH2O 补充至25.00 μL。设置5 个退火温度梯度:52、54、56、58、60 ℃。对BVDV 与BCoV 进行TaqMan双重RT-qPCR 反应条件优化。
1.5.1.3 BVDV、BRV 与BCoVTaqMan 三重RTqPCR 反应体系和条件优化 使用25.00 μL 反应体系:2×one step RT-PCR buffer III 12.50 μL,ExTaqHS 0.50 μL,PrimeScript RT Enzyme Mix II 0.50 μL,确定BVDV 与BCoV 双重RT-qPCR 反应体系后,使用矩阵法调节BVDV 与BCoV 的引物用量为0.24 μL、0.24 μL(50 μmol/L),将BRV 引物用量(50 μmol/L)设置9 个浓度梯度(0.12、0.14、0.16、0.18、0.20、0.22、0.24、0.26、0.28 μL),BVDV 与BCoV 的探针用量为1.20、0.70 μL(10 μmol/L),BRV 探针用量(10 μmol/L)设置9 个梯度(0.50、0.60、0.70、0.80、0.90、1.00、1.10、1.20、1.30 μL),模板2.00 μL,最后ddH2O补充至25.00 μL。设置5 个退火温度梯度:52、54、56、58、60 ℃,对BVDV、BRV 与BCoV 进行TaqMan 三重RT-qPCR 反应条件优化。
1.5.2 标准曲线建立 将1010拷贝数的pMD19-T-BVDV、pMD19-T-BRV 和pMD19-T-BCoV 等量混合后进行10 倍倍比稀释,选取108~101拷贝数的混合重组质粒标准品作为模板,ddH2O 为阴性对照,每组进行3 个重复。用优化的TaqMan 三重RT-qPCR 体系及扩增程序进行RT-qPCR 扩增,绘制标准曲线。
1.5.3 特异性试验 以BVDV-1、BVDV-2、BRV、BCoV 的核酸作为阳性对照、以IBRV、BPIV、CpA、CpB、CpD、PmA 和PmB 的核酸为模板,ddH2O 为阴性对照,用本研究建立的TaqMan 三重RT-qPCR 方法进行特异性检测,以评价该方法的特异性。
1.5.4 敏感性试验 将1010拷贝数的pMD19-TBVDV、pMD19-T-BRV 和pMD19-T-BCoV 等 量混合后进行10 倍倍比稀释,选取108~100拷贝的混合重组质粒标准品作为模板,ddH2O 为阴性对照,利用本研究建立的TaqMan 三重RT-qPCR 方法进行敏感性检测,以评价该方法的敏感性。同时将1010拷贝数的pMD19-T-BVDV、pMD19-T-BRV和pMD19-T-BCoV 分别进行10 倍倍比稀释,选取108~100拷贝的重组质粒标准品作为模板,ddH2O为阴性对照,采用本实验室建立的常规RT-PCR 进行检测,并比较两种方法的敏感性。
1.5.5 重复性试验 选取3 个不同拷贝数的混合重组质粒标准品,即以104、105、106拷贝/μL为模板,每个浓度重复3 次,用本研究建立的TaqMan 三重RT-qPCR 方法进行组内重复试验;选取3 个不同时间,用本研究建立的TaqMan 三重RT-qPCR 方法对上述3 个不同浓度的混合重组质粒标准品进行组间重复性试验,根据试验结果得到的Ct 值来计算组内组间变异系数,评估该方法的重复性。
1.6 2 种TaqMan RT-qPCR 符合率比较试验
采用本研究建立的TaqMan 三重RT-qPCR 与OIE 推荐的BVDVTaqMan 单重RT-qPCR 以及文献[6]和文献[10]报道的BCoV 和BRV 的TaqMan单重RT-qPCR,对内蒙古地区某养殖场的29 份牛粪便拭子核酸样品进行检测和符合率分析,以验证本研究建立的TaqMan 三重RT-qPCR 方法的实用性。
1.7 BVDV、BRV 与BCoV 混合感染分析
对本研究建立的TaqMan 三重RT-qPCR 所检出的BVDV、BRV 与BCoV 阳性样品,进行混合感染分析。
2 结果
2.1 质粒标准品构建
以BVDV、BRV 和BCoV 的RNA 样品为模板,利用表1 中的引物进行RT-PCR 扩增,结果获得预期大小的目的片段。目的片段回收纯化后,克隆至pMD19-T 载体,选取测序正确的阳性重组质粒pMD19-T-BVDV、pMD19-T-BRV 和pMD19-T-BCoV 作为标准品,计算出的拷贝数分别为3.08×1010,2.98×1010和3.19×1010拷贝/μL
2.2 TaqMan 荧光定量RT-qPCR 方法反应条件优化
2.2.1 BVDV、BRV、BCoVTaqMan 单重RT-qPCR反应条件优化TaqMan 单重RT-qPCR 反应条件经优化后,确定BVDVTaqMan 单重RT-qPCR 的反应体系为25.0 μL:2×One Step RT-PCR Buffer Ⅲ12.5 μL,ExTaqHS 0.5 μL,PrimeScript RT Enzyme Mix Ⅱ 0.5 μL,BVDV 上、下游引物(10 μmol/L)各1.0 μL,BVDV 探针用量(10 μmol/L)为1.0 μL,模板2.0 μL,ddH2O 补至25.0 μL。最佳反应条件为:42 ℃ 5 min;95℃ 10 s;95 ℃ 5 s、60 ℃ 30 s,共40 个循环;退火阶段收集荧光信号。确定BRVTaqMan 单重RT-qPCR 的反应体系25.0 μL:2×One Step RT-PCR Buffer Ⅲ 12.5 μL,ExTaqHS 0.5 μL,PrimeScript RT Enzyme Mix Ⅱ 0.5 μL,BRV上、下游引物(10 μmol/L)各0.9 μL,BRV 探针用量(10 μmol/L)为0.9 μL,模板2.0 μL,ddH2O 补至25.0 μL。最佳反应条件为:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s、60 ℃ 30 s,共40 个循环;退火阶段收集荧光信号。确定BCoVTaqMan 单重RT-qPCR 的反应体系25.0 μL:2×One Step RT-PCR Buffer Ⅲ12.5 μL,ExTaqHS 0.5 μL,PrimeScript RT Enzyme Mix Ⅱ 0.5 μL,BCoV 上、下游引物(10 μmol/L)各1.0 μL,BCoV 探针用量(10 μmol/L)为0.7 μL,模板2.0 μL,ddH2O 补至25.0 μL。最佳反应条件为:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s、60 ℃ 30 s,共40 个循环;退火阶段收集荧光信号。
2.2.2 BVDV 与BCoVTaqMan 双 重RT-qPCR反应条件优化TaqMan 双重RT-qPCR 反应条件经优化后,确定反应体系为25.0 μL:2×One Step RT-PCR Buffer Ⅲ 12.5 μL,ExTaqHS 0.5 μL,PrimeScript RT Enzyme Mix Ⅱ 0.5 μL,BVDV 上、下游引物(10 μmol/L)各1.2 μL,BVDV 探针用量(10 μmol/L)为1.2 μL,BCoV 上、下游引物(10 μmol/L)各1.2 μL,BCoV 的探针用量(10 μmol/L)为0.7 μL,模板2.0 μL,ddH2O 补至25.0 μL。最佳反应条件为:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s、60 ℃ 30 s,共40 个循环;退火阶段收集荧光信号。
2.2.3 BVDV、BRV 和BCoVTaqMan 三重RTqPCR 反应条件优化 BVDV、BRV 和BCoVTaqMan 三重RT-qPCR 反应条件经优化后,确定反应体系25.00 μL:2×One Step RT-PCR BufferⅢ 12.50 μL,ExTaqHS 0.50 μL,PrimeScript RT Enzyme Mix Ⅱ 0.50 μL,BVDV 与BCoV 上、下游引物(50 μmol/L)各0.24 μL,BRV 上、下游引物(50 μmol/L)各0.20 μL,BVDV、BCoV 与BRV的探针用量(10 μmol/L)分别为1.20、0.70、1.00 μL,模板2.00 μL,ddH2O 补至25.00 μL。最佳反应条件为:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s、60 ℃ 30 s,共40 个循环;退火阶段收集荧光信号。
2.3 标准曲线绘制
用优化的TaqMan 三重RT-qPCR 体系及扩增程序进行RT-qPCR 扩增,绘制标准曲线。结果(图1)显示:BVDV、BCoV 与BRV 的相关系数R2分别为0.998、0.998 和0.999,扩增效率E分别为94.7、95.2 和92.1,均在90%~110%之间,具有良好的线性关系;BVDV、BCoV 与BRV 的回归方程分别为y1=-3.456x1+42.833、y2=-3.442x2+40.670和y3=-3.527x3+39.776,因此可以根据所检临床样品的Ct 值,并参照标准曲线对临床样品进行阴阳性判定。
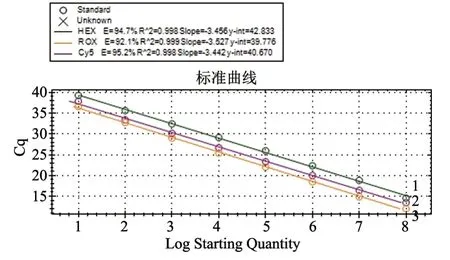
图1 BVDV、BRV 和BCoV TaqMan三重RT-qPCR 标准曲线
2.4 特异性试验
利用本研究建立的TaqMan 三重RT-qPCR 方法 对BVDV-1、BVDV-2、BRV、BCoV、IBRV、BPIV、CPA、CPB、CPD、PmA 和PmB 核酸进行检测。结果(图2)显示,仅BVDV-1、BVDV-2、BRV、BCoV 阳性对照出现S 型扩增曲线,Ct 值均小于35,而其他病毒的核酸与阴性对照均未出现扩增曲线,说明本研究建立的BVDV、BRV、BCoVTaqMan三重RT-qPCR方法具有良好的特异性。
2.5 敏感性试验
2.5.1TaqMan 三重RT-qPCR 敏感性检测 用本研究建立的TaqMan 三重RT-qPCR 方法对108~100拷贝/μL 的混合重组质粒标准品进行敏感性检测。结果(图3)显示,BVDV、BCoV 与BRV 的最低检测限均为10 拷贝/μL,表明本研究所建立的TaqMan 三重RT-qPCR 检测方法灵敏性高。
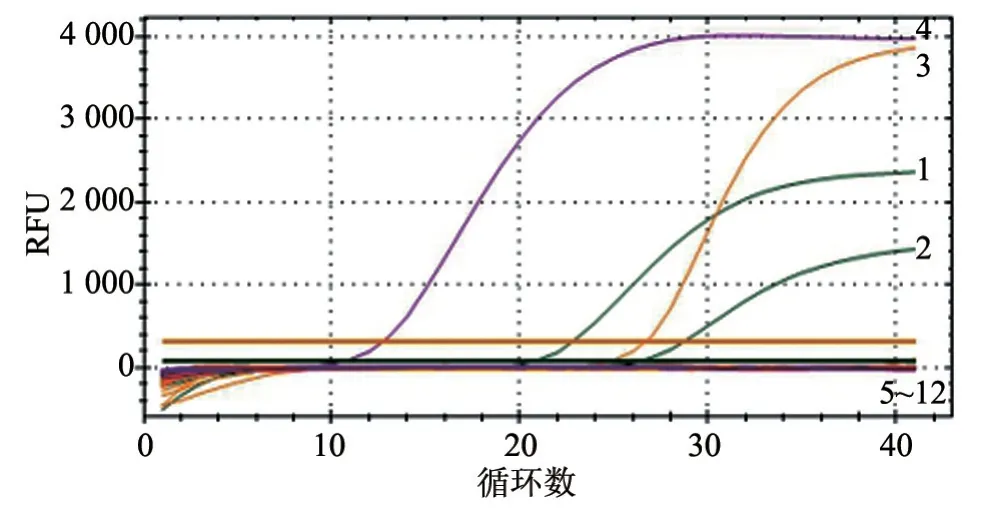
图2 TaqMan 多重RT-qPCR 特异性扩增曲线
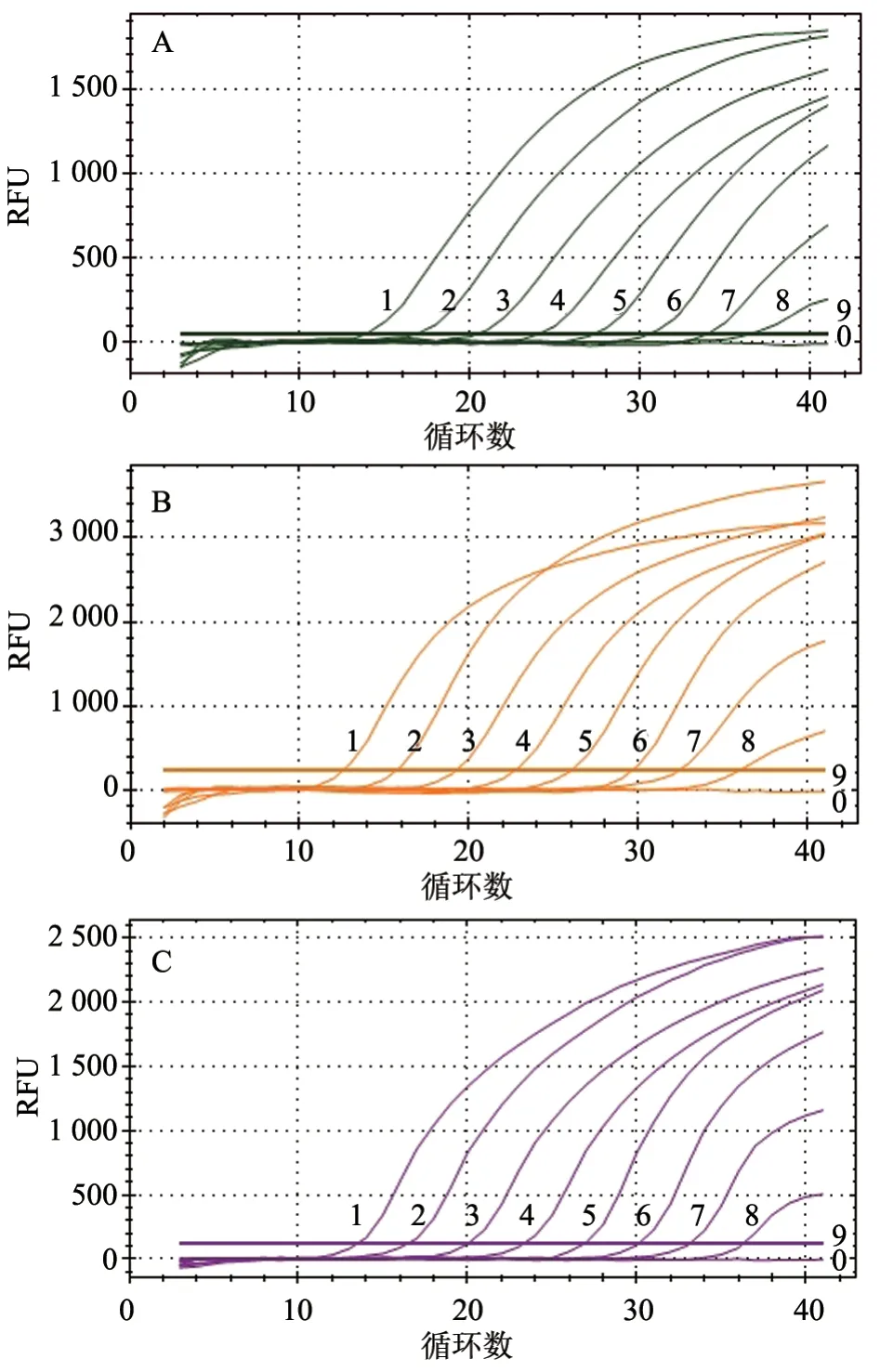
图3 BVDV、BRV、BCoV TaqMan三重RT-qPCR 敏感性试验结果
2.5.2 常规RT-PCR 敏感性试验结果 采用常规RT-PCR 方法对108~100拷贝/μL 的重组质粒标准品进行敏感性检测。结果(图4)显示,BVDV、BCoV 与BRV 的最低检测限均为103拷贝/μL。本研究所建立的TaqMan 三重RT-qPCR 的检测敏感性与之比较,敏感性提高了100 倍。
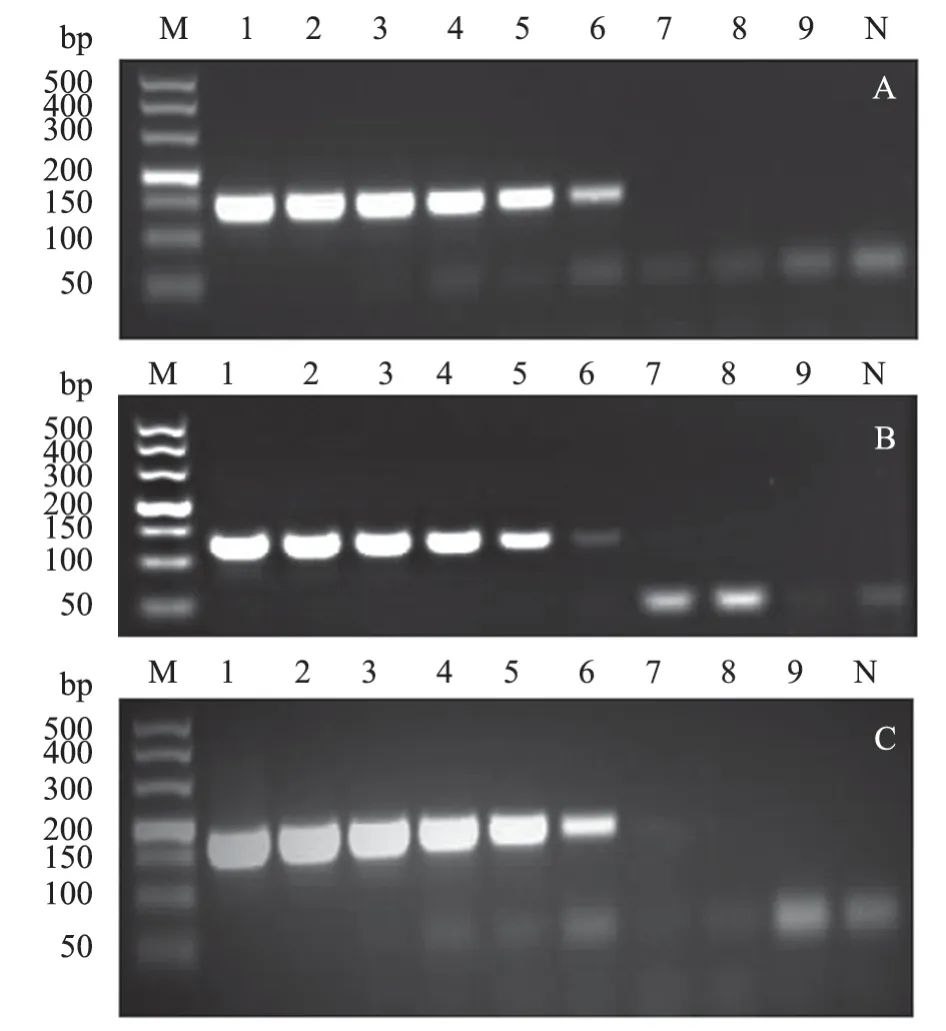
图4 BVDV、BRV 以及BCoV 常规RT-PCR 敏感性结果
2.6 重复性试验
用本研究建立的TaqMan 三重RT-qPCR 方法,对104~106拷贝的混合质粒标准品进行组内和组间重复试验。结果(表2)显示,BVDV、BRV和BCoV 的组内、组间重复试验变异系数均小于2%,表明本研究建立的TaqMan 三重RT-qPCR 检测方法重复性较好。
2.7 两种TaqMan RT-qPCR 符合率的比较试验
利用两种TaqMan RT-qPCR 对29 份牛粪便拭子核酸样品进行检测,所检样品Ct 值小于35 时判定为阳性,Ct 值大于35 时判定为阴性。结果(表3)显示,BVDV 检出率分别为62.1%(18/29)、62.1%(18/29),符合率为100%;BRV 检出率分别为20.7%(6/29)、17.2%(5/29),符合率为96.5%;BCoV 检出率分别为27.6%(8/29)、27.6%(8/29),符合率为100%。结果表明,本研究建立的TaqMan 三重RT-qPCR 方法检测结果较可靠,准确性较高,可以用于临床检测。
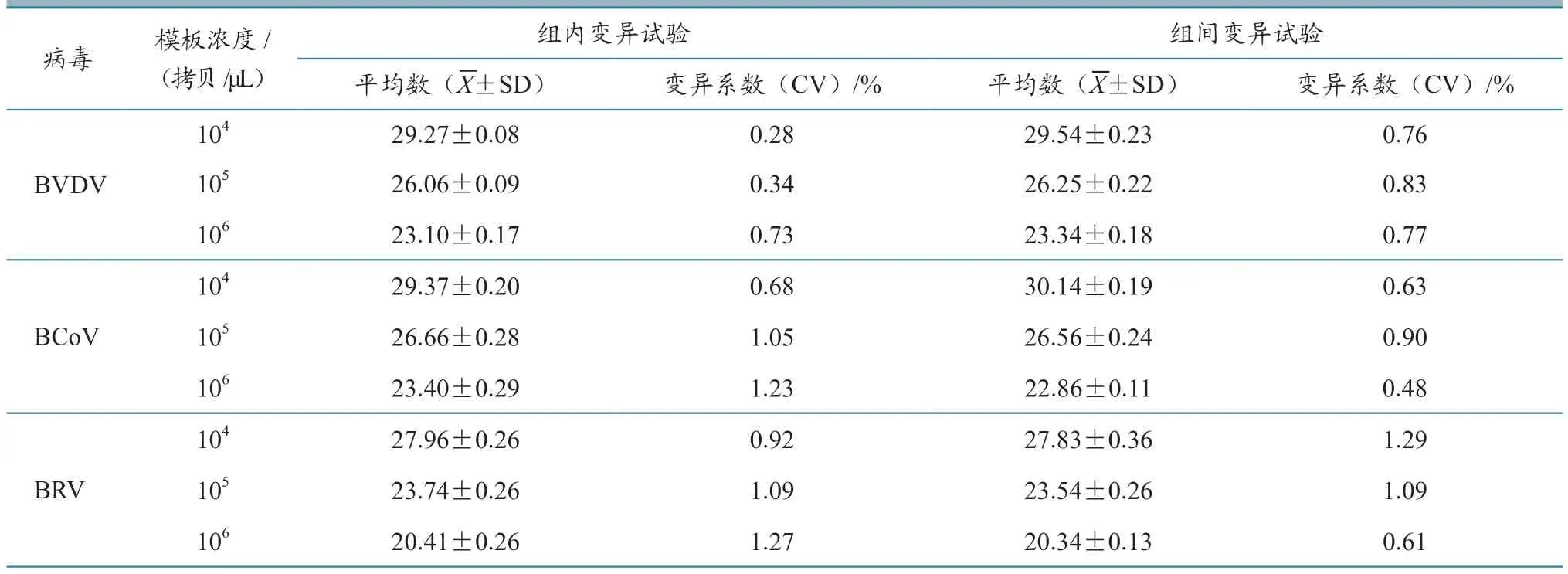
表2 TaqMan 三重RT-qPCR 方法组内和组间重复性结果
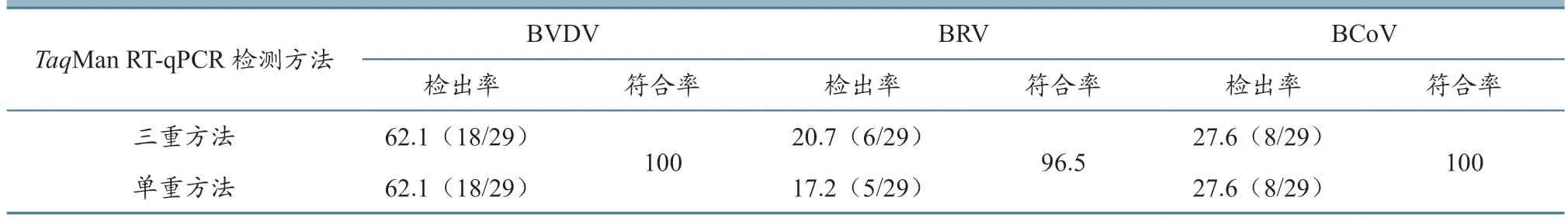
表3 两种TaqMan 荧光定量RT-qPCR 方法的检测结果比较 %
2.8 BVDV、BRV 与BCoV 混合感染
对利用本研究建立的TaqMan 三重RT-qPCR检出BVDV、BRV 与BCoV 的阳性样品进行混合感染分析。结果(表4)显示,29 份临床样品中存在BVDV+BRV、BVDV+BCoV、BRV+BCoV、BVDV+BRV+BCoV 4 种混合感染型,其混合感染率分别为10.3%(3/29)、27.6%(8/29)、10.3%(3/29)、3.4%(1/29),总混感率为51.7%(15/29)。结果表明,该养殖场牛群中存在BVDV、BRV 与BCoV 的混合感染,在不同的混合感染型中,以BVDV+BCoV 最为突出。

表4 29 份临床样品中BVDV、BRV 与BCoV混合感染统计结果
3 讨论
本研究首次建立了针对BVDV、BCoV 和BRV 的TaqMan 三重RT-qPCR 方法,有效规避了2013 年林初文等[13]建立的BVDV、BCoV 和BRV三重RT-PCR 方法不能定量和易出现假阳性的弊端,具有灵敏度高、假阳性低的优点。本研究建立的三重RT-qPCR 方法与OIE 推荐的BVDVTaqMan单重RT-qPCR 方法相比,符合率为100%,与文献[6]和文献[10]分别报道的BCoV 和BRV 的TaqMan 单重RT-qPCR 方法相比,BRV 符合率为96.5%,BCoV 符合率为100%,说明本研究建立的TaqMan 三重RT-qPCR 方法相比原有的TaqMan 单重RT-qPCR 方法更准确,且大大缩减了检测时间,减少了试剂用量,从而降低了检测成本。
本研究建立的BVDV、BRV、BCoVTaqMan三重RT-qPCR 方法仅能对BVDV-1、BVDV-2、BRV、BCoV 进行特异性检测,对IBRV、BPIV、CPA、CPB、CPD、PmA 和PmB 检测呈阴性,说明BVDV 5'-UTR、BRVNSP5和BCoVN基因序列高度保守。其对应的引物和探针序列特异性强,且与犊牛腹泻其他相关病毒性或致病性细菌无交叉反应,是针对3 个靶标基因的最佳引物与探针,这与文献[12]、文献[10]和文献[13]分别报道的结果一致。
敏感性和重复性是衡量多重qPCR 方法优劣的重要指标。本研究建立的TaqMan 三重RT-qPCR方法对BVDV、BRV 和BCoV 的检测敏感度均达到了10 拷贝/μL,比2011 年范晴等[11]建立的BVDV 与BRVTaqMan 双重RT-qPCR 方法的敏感度提高了10 倍;与2019 年王莎莎等[12]建立的BCoVTaqMan 单重RT-qPCR 方法的敏感性相当,但后者只能实现对BCoV 的单重检测。因此,本研究建立的TaqMan 三重RT-qPCR 方法比TaqMan单重及双重RT-qPCR 方法敏感性更强。BVDV、BRV 和BCoV 的组内和组间变异系数均小于2%。该变异系数低于文献[6]和文献[12]报道的变异系数(<3%~5%),说明该方法重复性好、稳定性很强,在用于临床样品检测时比较可靠。
利用本研究建立的TaqMan 三重RT-qPCR方法,对29 份临床样品进行检测,共检出4 种混合感染型:BVDV+BRV、BVDV+BCoV、BRV+BCoV 二重感染和BVDV+BRV+BCoV 三重感染,其混合感染率分别为10.3%(3/29)、27.6%(8/29)、10.3%(3/29)和3.4%(1/29),总混合感染率为51.7%(15/29),表明该养殖场牛群中存在严重的BVDV、BRV 和BCoV 感染,且混合感染情况严重。这为牛腹泻病的临床诊断提供了方向,当判定为BVDV、BRV、BCoV 单重感染时,还应考虑是否存在混合感染情况,以便对牛腹泻性疾病进行准确治疗与预防。本研究建立的TaqMan 三重RT-qPCR 方法可在一份样品中同时检测BVDV、BRV 和BCoV 三种病原,为今后由BVDV、BRV 和BCoV 共感染引起的牛腹泻性疾病的鉴别诊断和流行病学调查提供了新的技术手段。
