肾被膜下胰岛移植治疗1 型糖尿病模型小鼠的研究
2021-03-07
(广医科大学第一附属医院胃肠腺体外科,广西 南宁 530021)
1 型糖尿病(T1DM)由于自身β 细胞免疫损伤被破坏,导致胰岛素绝对分泌不足[1]。而胰岛移植是可以将胰岛素水平维持在生理上适当范围内的糖尿病治疗方式[2]。2000 年Edmonton 方案提出以及在临床上的成功应用,使胰岛移植在治疗糖尿病方面得到广泛关注[3]。本研究结合本课题组夏小林等[4]前期小鼠胰岛肾被膜移植研究的基础上,采用胆管逆行灌注联合胰腺原位灌注射改良了胰腺分离消化方法,在移植过程中采用低位肾被膜开口移植技术,旨在探索新的胰岛移植操作方法与方法,并对提取的胰岛细胞功能及移植效果进行评价。
1 材料与方法
1.1 实验动物和主要试剂
1.1.1 实验动物 选择SPF 级,8~10 周龄的C57BL/6J雄性小鼠60 只,由广西医科大学动物试验中心提供。
1.1.2 主要试剂与仪器 Hanks 缓冲液与D-Hanks 缓冲液(美国Boster 公司);血糖仪(美国欧姆龙公司);倒置显微镜(日本OLYMPUS 公司);内径0.58 mm聚乙烯管PE50(美国Becton Dickinson 公司);胶原酶V、双硫腙(Dithizone,DTZ)、台盼蓝、淋巴细胞分离液(Histopaqueo-1077)及链脲佐菌素(Streptozotocin,STZ)购自美国Sigma 公司;RPMI-1640 培养基及胎牛血清(四季青);小鼠胰岛素酶联免疫吸附试验(ELISA)(上海酶联公司)。主要试剂的配制:①灌注液:50000 U 肝素钠+200 U 胰岛素+Hanks 液500 ml,过滤器过滤,定pH 为7.3,4 ℃保存;②消化液:6 mg 胶原酶+5 ml 灌注液,浓度为1.2 mg/ml,现配现用;③终止液:5000 U 肝素+200 U 胰岛素+Hanks 液500 ml+50 ml 胎牛血清,经过滤器过滤,定pH 为7.3,4 ℃保存。
1.2 方法
1.2.1 胰岛的分离 ①胰腺的灌注:1%戊巴比妥钠按0.01 ml/g 腹腔注射麻醉,酒精消毒,腹部切口打开腹腔,剪断胸骨和膈肌,翻转肝脏至胸腔内,便于充分暴露肝门。在视显微镜下,找胆总管与十二指肠交汇处,在交汇处将靠近胆总管两边的胰腺组织各撕开一小口,用止血钳穿过两开口夹闭肠管,小心分离胆总管近端便于逆行灌注消化液。用胰岛素注射器于近端胆总管处穿刺,用镊子固定针头防止针头刺破胆总管,缓缓推注消化液1 ml,重复2 次,使胰体尾膨胀,迅速将整个胰腺连带脾脏切除,再对胰腺进行多点灌注使胰腺尾部进一步充盈,将灌注好的胰腺放入50 ml 离心管冰盒中保存,重复操作1 次;②胰腺的消化:将灌注好的胰腺在37.5 ℃水浴箱中水浴,灵活掌握水浴时间,直至胰腺组织消化为细小泥沙状。水浴完成后,迅速加入30 ml 终止液重悬洗涤,4 ℃、700 g,离心1 min,倒掉上清,重复1 次。
1.2.2 胰岛的纯化 离心管内加入5 ml 分离液,重悬混匀,将离心管大约10°角平放在冰上,顺着管壁缓慢加入D-hanks 缓冲液5 ml,避免震动,再将试管缓慢竖直,可在分离液和缓冲液之间看到明显的分离界面,调节离心机加减速全部为0,4 ℃、700 g,离心12 min,离心结束后会看到胰岛细胞悬浮在两分离液面之间,巴氏管小心吸取悬浮物至新的15m 离心管中,加10 ml 1640 培养基(含10%胎牛血清)重悬洗涤,离心机设置同上离心1 min,倒掉上清,重复洗涤1 次;挑选250 个胰岛为1 组,冰上保存。
1.2.3 胰岛活性、数量、纯度与功能检测 ①胰岛活性测定:台盼蓝染色法,台盼蓝对活性细胞不染色,死亡细胞染为蓝色。胰岛细胞成活率=未染色细胞/细胞总数×100%;②胰岛数量及纯度测定:纯度:DTZ染色计算胰岛细胞纯度=胰岛细胞数/总细胞细数×100%。计数:将胰岛细胞制成细胞悬液,用移液枪重复3 次取样,50 ml/次,胰岛数=(3 次阳性总数/3)×20×样本量(ml),150 μm 左右大小的的胰岛细胞团为1 个当量(IEQ)[5,6];③胰岛细胞功能测定:葡萄糖刺激胰岛素释放试验测定胰岛细胞功能。挑选100个50~200μm 大小,质量高的胰岛细胞团,分为高糖组和低糖组,每组5 孔,分别置于含16.7 mmol/L 和3.3 mmol/l 的葡萄糖的培养基中进行培养,37.5 ℃,体积分数5%的CO2培养箱培养60 min,采集上清液,用小鼠胰岛素酶联免疫吸附试验进行测定分析。
1.2.4 胰岛移植 ①糖尿病小鼠模型的建立及分组:造模前夜间禁食10~12 h,但保证水的供应,STZ 溶液现配现用,腹腔内注射,剂量为170 mg/kg,注射后2 h 给予喂食。注射后5 d 取小鼠尾静脉血,检测随机血糖,连续两天随机血糖>16.7 mmol/L 认为造模成功,7 d 后选取血糖稳定的小鼠进行肾被膜下胰岛移植,但要求血糖>20 mmol/L。随机数字表法分为空白对照组(n=13)和实验组(n=13),为1 型糖尿病模型小鼠并给予同种异体胰岛细胞肾被膜下移植;②肾被膜下胰岛移植:受体小鼠麻醉消毒备皮,于左肋下取一2 cm 切口,暴露肾脏,用显微镊在靠近肾下极处轻轻撕开一2 mm 低位肾被膜开口,移植前肾被膜需用生理盐水提前浸泡的细玻璃棒充分分离。将人工挑选好的一组胰岛细胞用微量注射器吸入内径0.58 mm 的聚乙烯软管内[7,8],低温离心1 min使胰岛细胞团聚集一起便于移植,用微量注射器将胰岛细胞缓慢打入肾被膜下,电凝器烧灼低位肾被膜开口,防止胰岛细胞从开口流出至腹腔,缝合肌层皮肤复温至麻醉苏醒。
1.2.5 胰岛移植后效果评估 ①血糖检测:术后前7天,每天随机时间取小鼠尾静脉血测血糖,以后每周测1~2 次血糖,如果连续2 次随机血糖<11.1 mmol/L,可以认为小鼠糖尿病逆转治愈;②葡萄糖耐量检测:移植术后第10 天,在两组小鼠中分别随机选取4 只小鼠做葡萄糖耐量检测,检测前小鼠夜间禁食但保证水供应,腹腔注射葡萄糖,剂量为2.0 g/kg,分别于0、15、30、60、90、120 min 尾静脉取血测定血糖;③肾被膜下胰岛组织评估:移植术后第29 天切除实验组小鼠左肾,继续监测两组小鼠随机血糖,并观察胰岛组织在肾被膜下大体形态,取下的左肾经4%多聚甲醛固定、脱水、包埋、切片,苏木素-伊红(HE)染色后观察肾被膜下移植物的组织学形态。
1.3 统计学方法 采用SPSS 20.0 和GraphPad Prism8.0 软件分析数据作图,计量资料以()表示,两组间比较用t检验,P<0.05 表示为差异有统计学意义。
2 结果
2.1 胰岛产量和活性 每只小鼠可获得(200.23±30.18)个高质量胰岛细胞团;胰岛细胞团经DTZ 染色后显示纯度>90.00%;经台盼蓝染色活性良好,活性>90.00%,见图1。
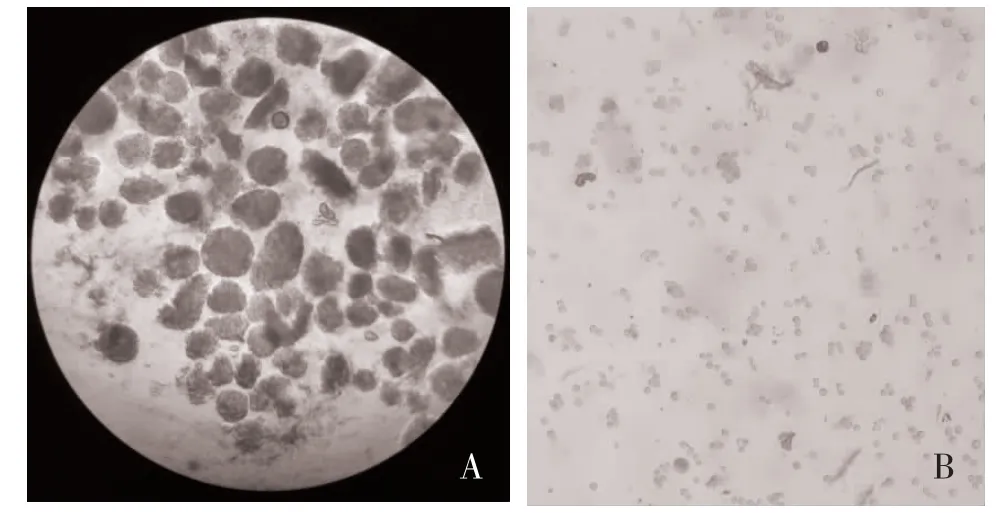
图1 胰岛染色
2.2 葡萄糖刺激胰岛素释放试验结果 高糖组检测每个胰岛素释放量为(1.98±0.20)ng/胰岛,低糖组检测每个胰岛素释放量为(0.69±0.11)ng/胰岛,高糖组为低糖组的2.87 倍,差异有统计学意义(P<0.05)。
2.3 小鼠成模结果 15 只受体小鼠按170 mg/kg 腹腔注射STZ 后,低血糖死亡1 只,1 只血糖<16.7 mmol/L,剩余13 只小鼠血糖值都>16.7 mmol/L,并出现“三多一少”的现象,造模成功率为86.73%。
2.4 移植后小鼠血糖结果 移植术后实验组血糖第1、2 天逐步下降,第3 天全部降至正常范围内(<11.1 mmol/L),移植术后第4、6、7、14、21、28 天两组血糖水平比较,差异无统计学意义(P>0.05);实验组小鼠移植术后第29 天摘除左肾后血糖明显上升,并于摘除左肾术后第2 天血糖全部>16.7 mmol/L,两组血糖比较,差异有统计学意义(P<0.05),见表1、表2、图2。
表1 两组移植术后血糖水平比较(,mmol/L)
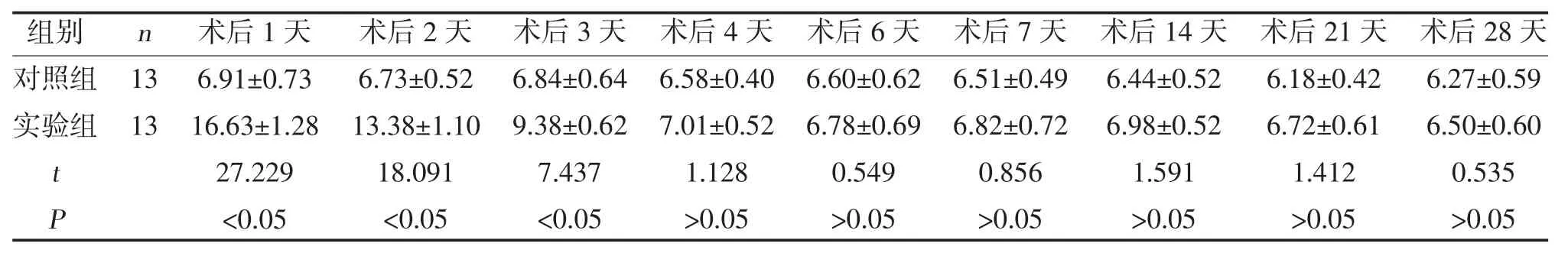
表1 两组移植术后血糖水平比较(,mmol/L)
表2 两组左肾摘除术后血糖水平比较(,mmol/L)

表2 两组左肾摘除术后血糖水平比较(,mmol/L)
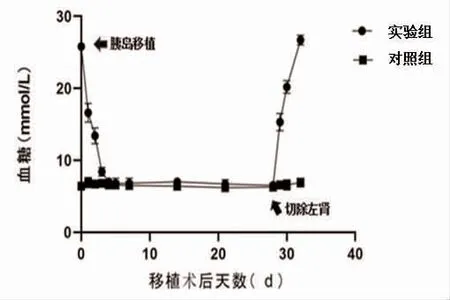
图2 两组移植后血糖比较
2.5 葡萄糖耐量检测结果 两组小鼠在腹腔注射葡萄糖后血糖迅速升高,15 min 血糖值到达高峰,随后血糖值逐步下降,在90 min 血糖值恢复到11.1 mmol/L以下,两组不同时间血糖值比较,差异无统计学意义(P>0.05),见图3、表3。
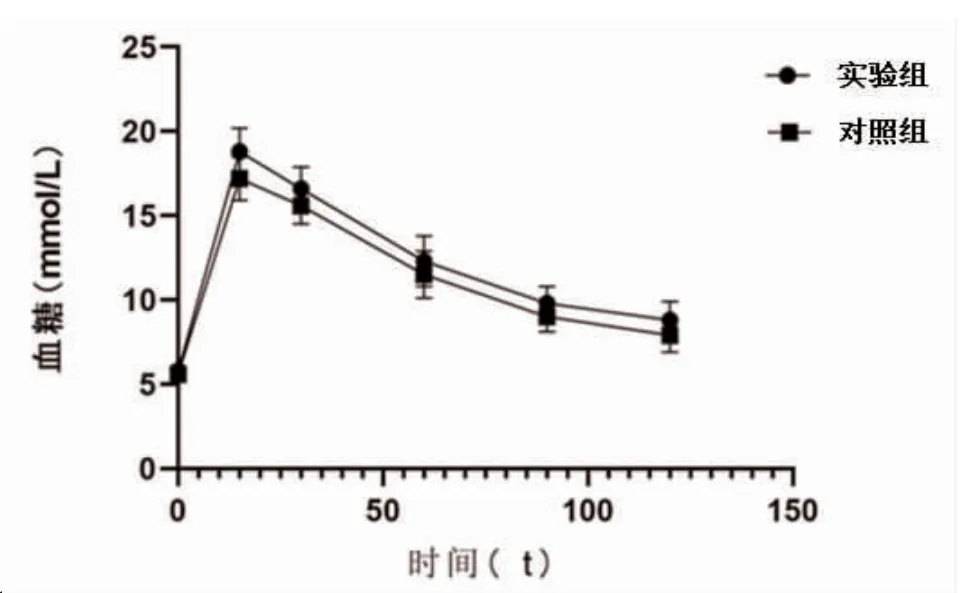
图3 两组葡萄糖耐量血糖比较
表3 两组小鼠葡萄糖耐量结果比较(,mmol/L)

表3 两组小鼠葡萄糖耐量结果比较(,mmol/L)
2.6 胰岛组织学评价 实验组左肾体式显微镜下见胰岛细胞团明显存在于在肾上极背膜下,并且移植物表面已有新生血管生成(图4A 黑色箭头所示);移植物切片HE 染色镜下观察移植胰岛细胞与肾实质分界模糊,部分胰岛细胞仍保持团状聚集(图4B黑色箭头所示),移植胰岛细胞内部发现较多血细胞,说明移植物内部也有毛细血管生成(图4B 灰色箭头所示),说明移植物已建立血液循环存活良好。

图4 体式显微镜下移植物大体观
3 讨论
虽然肾被膜胰岛移植的动物模型技术早已建立,但影响移植模型成功与否的因素有很多,如胰岛的分离消化,胰岛细胞的产出数量、纯度活性,以及术者移植操作技术是否熟练也是影响因素之一。
本实验根据传统肾被膜下胰岛移植技术做了部分改良,在分离阶段采用胆总管逆行灌注联合离体多点注射灌注法。胶原酶原位灌注法比离体灌注可获得较多的胰岛细胞产量[9],有些学者采用单一胆总管原位灌注法[10,11]。而本研究操作中发现,虽然原位灌注可将胰腺组织灌注充盈,但小鼠胰尾靠近脾脏部充盈程度较胰头体部较差。本实验采用联合两种方法进行灌注,在一定程度上解决了这个问题,可使整个胰腺充分膨胀,进而使胰腺组织在水浴过程中更充分消化,相比于本实验室前期报道[4],提高了单只小鼠胰腺组织获取胰岛细胞的数量,而且胰岛细胞的活性及产生胰岛素的功能也都表现良好。同时联合灌注法可在胆总管穿刺失败时进行补救性灌注,也可获得一定数量的胰岛细胞,节省动物成本。
移植阶段有些学者采用肾上极背膜开口移植胰岛[8,12,13],而采用肾上极背膜开口极易使胰岛细胞在注入时从穿刺口流出,导致肾被膜下移植量出现差异,影响后续实验结果。改良采用肾被膜低位开口注入胰岛,由于分离的肾被膜面积较大,可使胰岛细胞团被肾被膜轻松包裹,从而解决了移植物从穿刺口流出这一问题。肾被膜下胰岛移植是在缺氧环境下进行[14,15],低位肾被膜开口产生的较大肾被膜移植面积,使注入的胰岛细胞具有更大的活动空间,在一定程度上避免了由于胰岛细胞团堆积引起的严重的缺氧而导致的移植物凋亡丢失。葡萄糖刺激胰岛素释放试验结果提示提取的胰岛细胞分泌胰岛素水平良好;移植术后,实验组小鼠随机血糖在术后第3天即可全部恢复至正常水平,且能长期保持稳定,说明小鼠肾被膜下异体胰岛移植可以逆转1 型糖尿病小鼠血糖值,而葡萄糖耐量检测结果说明移植胰岛细胞团分泌胰岛素能力与正常小鼠无差异。切除实验组小鼠左肾后,小鼠血糖有明显升高且恢复到移植前水平,说明实验组小鼠前期的血糖下降是由移植的胰岛细胞产生的胰岛素引起,葡萄糖耐量测定也表明实验组小鼠降血糖效果和正常小鼠无差异,移植后组织评价也表明移植胰岛细胞能在肾被膜下良好存活,符合课题组改良移植技术后的实验预期。
综上所述,改进的肾被膜下胰岛移植技术可以获得更多胰岛细胞量,可使移植物在肾被膜下稳定定植产生胰岛素,提高模型成功率,为下一步的药物干预筛选奠定了良好的基础。
