人源化食管癌移植瘤模型的建立△
2021-03-07胡瑞瑞秦玉芬张红梅王全义洪丰
胡瑞瑞,秦玉芬,张红梅,王全义,洪丰
济宁医学院附属医院1消化内科,2消化内镜室,3病理科,4肝病研究中心,山东 济宁 272000
食管癌是消化道常见及高发的恶性肿瘤之一,目前因动物模型研究和开发的滞后,临床上对食管癌的发生、发展及肿瘤免疫学机制尚缺乏深入系统的认识,严重影响疾病的精准治疗与预后判断。合适的动物模型是改变这一现状的关键因素之一。近年来,肿瘤类器官培养体系突破性提高了肿瘤细胞在体外培养的效率并最大程度再现了肿瘤细胞在体内的生物学特性,“基于类器官的恶性肿瘤疾病模型”被列为2021年“十四五”国家重点研发计划之一。本研究在此基础上,采用了新型3D微载体——microcarrier 6与人原代食管癌细胞共同孵育,构建三维生长的“肿瘤类器官”,并进一步建立了患者来源的正常免疫功能小鼠移植瘤模型,为转化医学人源化动物模型的建立提供了新的思路。
1 材料与方法
1.1 实验动物
C57BL/6小鼠40只,雄性,8周龄,体重24~25 g,购自济南朋悦实验动物繁育有限公司[实验动物质量合格证号37009200003571],饲养于济宁医学院附属医院SPF级实验动物中心,所有动物实验过程均符合济宁医学院附属医院动物伦理委员会相关规定。
1.2 食管癌标本
选取济宁医学院附属医院4例食管癌患者的手术标本,术前胃镜活检病理及术后标本病理检测均为鳞状细胞癌。本研究经医院伦理委员会批准,且所有患者均对本研究知情同意,并签署知情同意书。
1.3 微载体
microcarrier 6由美国ELYON BioTechnologies LLC公司提供。该新型微载体呈多层孔状结构,由带正电化的有机复合多聚物组成,不含杂质,不易污染,具备低免疫原性、生物兼容性良好、可代谢性等优点,能为细胞生长提供稳定的微环境。
1.4 主要试剂
DMEM培养基、胶原酶B、10%胎牛血清、红细胞裂解液、磷酸盐缓冲液(phosphate buffered solution,PBS)、青链霉素均购自美国Gibco公司。鼠抗人p40、CK5/6单克隆抗体均购自无锡东源公司。
1.5 人原代食管癌细胞分离与提取
食管癌标本于手术中取出后放置于无菌生理盐水中,30 min内送至实验室进行处置。首先以无血清的DMEM培养液冲洗标本3次,洗去表面血性物或糜烂物质,将标本用组织剪机械性剪碎,加入0.05%胶原酶,放置于37℃温箱中消化。每30~60 min观察组织消化情况,并反复用移液管吹打。1 h后,加入无血清的DMEM培养液,稀释并吹打组织混合物,以400 r/min离心5 min,留取上清,其余组织加入胶原酶继续放置温箱中消化。将取出的上清液加入含10%胎牛血清的DMEM培养基终止消化,70 μm滤网过滤,以1200 r/min速度离心8 min,弃上清,加入红细胞裂解液,30 min后加入DMEM培养液,以1000 r/min离心8 min,提取第一批食管癌细胞。以后重复上述步骤,提取消化2~3 h的食管癌细胞(图1)。
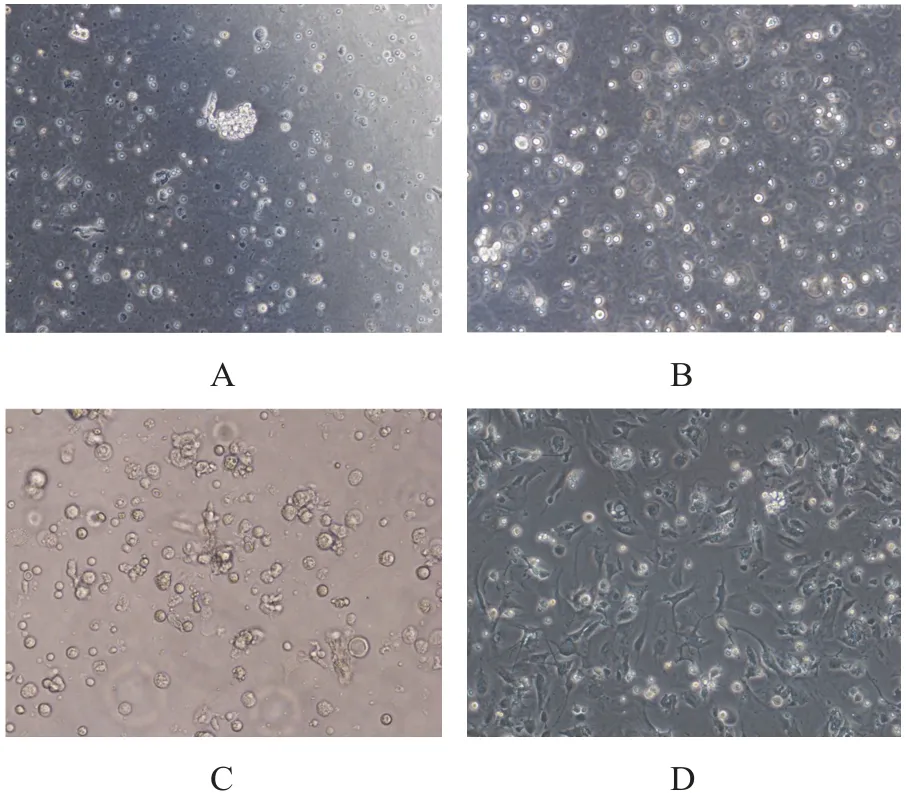
图1 人原代食管鳞状细胞癌细胞提取及培养
1.6 三维细胞培养模型的建立
将microcarrier 6浸泡于75%乙醇中24 h,用1×PBS清洗3遍,于DMEM培养基中孵育24 h;用基质细胞衍生因子-1α(stromal cell derived factor-1α,SDF-1α)和血管内皮生长因子(vascular endothelial growth factor,VEGF)对微载体进行修饰,孵育3 h,浓度调整为100 ng/ml。将提取的食管鳞状细胞癌细胞放置于含10%胎牛血清及1%青链霉素的DMEM培养基中,吹打成单细胞悬液,将细胞浓度调整为2×10/ml,以细胞与载体约3∶1的比例加入微载体,然后放置于37℃、5%CO培养箱中孵育12~24 h,镜下观察细胞与微载体结合达饱和状态(图2)。
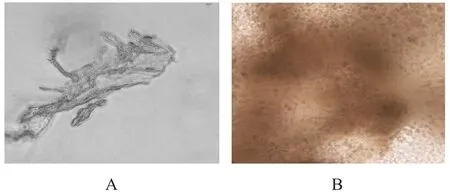
图2 微载体及肿瘤细胞与微载体结合饱和后的状态
1.7 动物模型制备及观察指标
因食管癌标本大小有限,分4次实验进行,每次用10只小鼠,按是否接种微载体与食管癌细胞复合物分为实验组和对照组,每组各5只小鼠。实验组将微载体与食管癌细胞复合物接种到正常免疫小鼠右侧腋下,每只100 μl;对照组仅接种微载体,皮下种植到正常免疫小鼠右侧腋下,每只100 μl。接种后观察小鼠精神状态、活动度、饮食情况,观察记录小鼠局部肿瘤的成瘤时间、肿瘤大小。肿瘤长出后每天测量肿瘤的长径(a)和短径(b),根据肿瘤体积公式V=1/2×a×b计算出肿瘤体积。18天后脱颈处死移植瘤小鼠,完整取出肿瘤组织,记录肿瘤的体积、质地以及坏死程度(图3)。肿瘤组织用10%中性福尔马林固定,送至病理科行苏木素-伊红(hematoxylin-eosin,HE)染色和免疫组化染色,其中,免疫组化使用Envision二步法检测反映人食管癌特征的p40、CK5/6。
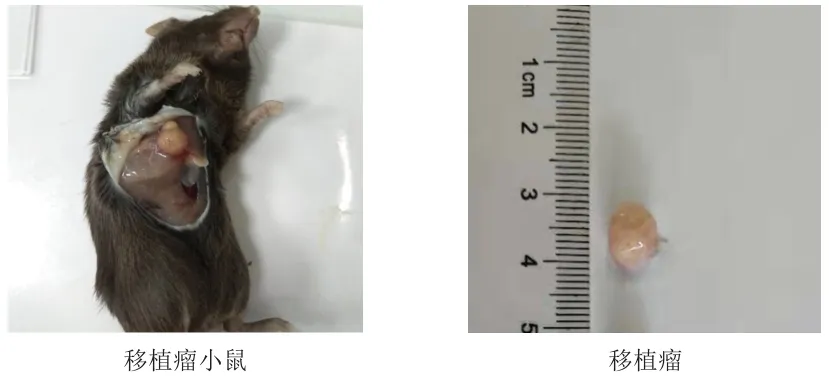
图3 移植瘤小鼠及移植瘤
1.8 统计学方法
2 结果
2.1 接种后小鼠的一般状况
实验组接种2~3天后小鼠食欲变差、活动度减少、精神状态变差,小鼠体重随着生长日期的延长而略有增加,整个过程中无小鼠死亡,不同时间实验组与对照组小鼠体重比较,差异均无统计学意义(P
>0.05)(表1)。
表1 不同时间两组小鼠体重及移植瘤直径(±s)
2.2 成瘤时间及大小、成瘤率
实验组:10~12天可在小鼠腋下触摸到直径大于0.4 cm的硬质结节,13~18天结节生长迅速,成瘤直径可达0.8~1.2 cm。于18天时脱颈处死移植瘤小鼠,取出异位肿瘤,发现瘤体多数呈圆形或椭圆形,质地韧或硬,切开后发现肿瘤切面多为灰白色。成瘤率为80%(16/20)。
对照组:共有3只小鼠在解剖时于右侧腋下发现0.3 cm左右的质软结节,剖开后见疏松的黄色载体物质流出,其余对照组小鼠在生长过程中均未触及异位肿瘤。
2.3 HE染色结果
移植瘤镜下观察可见大小不一、排列杂乱无章的异型细胞,细胞多呈椭圆形,细胞核大、畸形、深染,细胞质中等,背景中可见淋巴细胞、异物巨细胞。镜下亦可见肿瘤细胞侵及肌肉、神经、脂肪等组织,在肿瘤中央可见坏死灶,肿瘤周边见毛细血管分布。(图4)
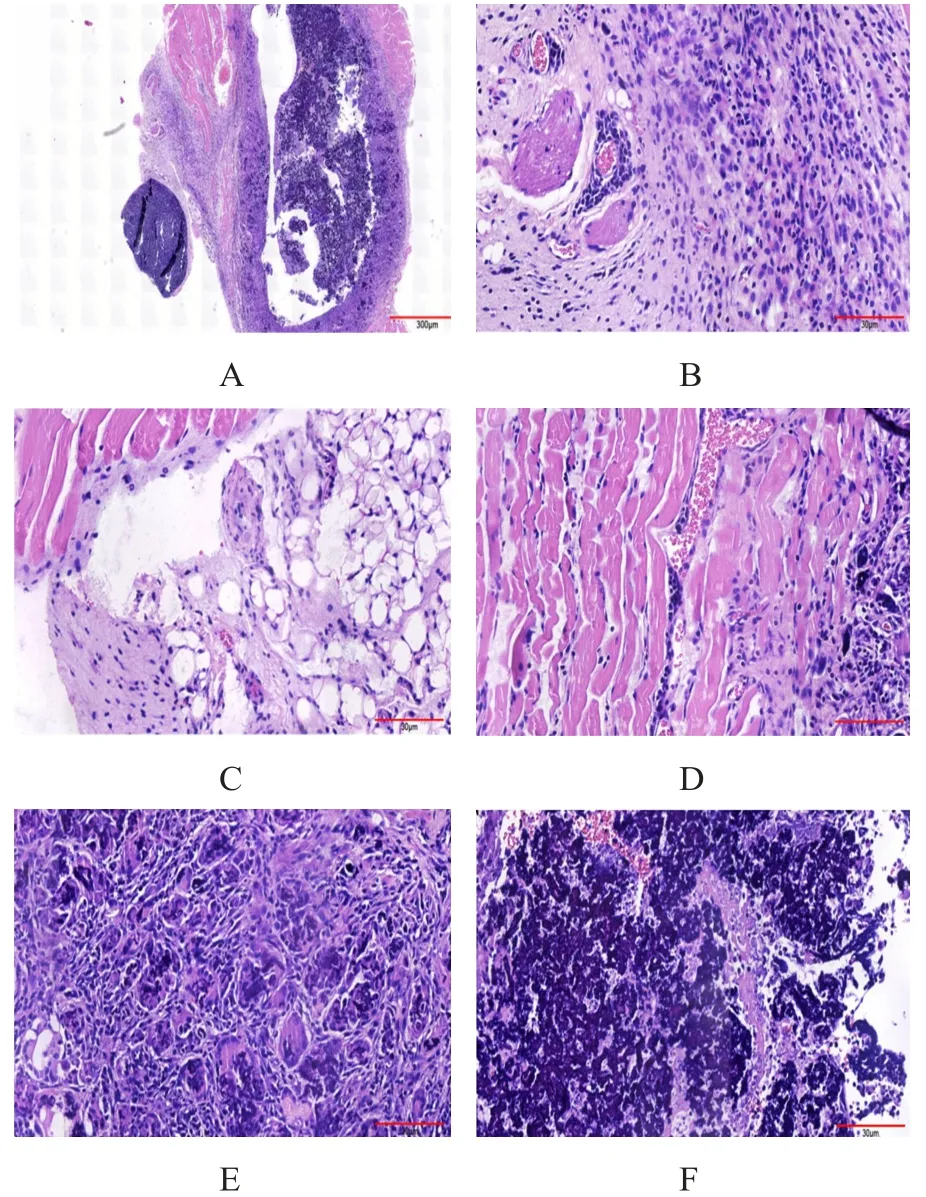
图4 移植瘤镜下图(HE染色)
2.4 免疫组化检测结果
实验组免疫组化结果显示p40、CK5/6表达阳性,证实异型细胞为人来源食管鳞状细胞癌细胞。(图 5)

图5 移植瘤免疫组化图(免疫组化染色,×20)
3 讨论
食管癌是世界上病死率较高的恶性肿瘤。其病理类型大多数为鳞状细胞癌,少部分为腺癌。目前对食管癌的发病及转移机制研究尚不充分,合适的实验动物模型能为疾病发病机制的探讨、药物新靶点的研究以及临床前药效学评价提供重要的平台基础,因此,理想动物模型的建立对成功开展转化医学有重要意义。
长期以来,人类肿瘤细胞系和移植瘤裸鼠动物模型一直作为肿瘤研究和抗癌新药研发的主要平台,但由于细胞系所形成的肿瘤组织缺少间质细胞,而间质细胞在肿瘤的发展和转移过程中发挥着重要作用,因此很难准确模拟临床患者的真实病情。近年国外学者将患者的新鲜肿瘤手术标本移植到免疫缺陷小鼠,建立了新的模型,命名为肿瘤患者来源的移植瘤模型。这些模型成功地再现了患者肿瘤的分子生物学、组织学和病理学特点。
本实验前期阶段单纯以人原代食管癌细胞接种于小鼠体内,结果发现,即便增加细胞数量,也无法生长出移植瘤,考虑为人鼠异种移植排斥反应所致。3D微载体体系弥补了上述缺陷,该微载体是一种支持细胞生长的支撑物,由带正电化的有机复合多聚物构成,具备多层孔隙结构,质地疏松,有利于细胞的快速附着和扩增,且可在短时间内起到屏障作用,阻挡免疫细胞直接杀伤肿瘤细胞,并且经VEGF和SDF-1α修饰后,能够诱导血管长入,为肿瘤的快速增长提供营养。以上条件均为肿瘤细胞的稳定生长提供良好的基础。3D肿瘤细胞培养系统能够模拟肿瘤生长的微环境,已成为目前研究的热点。
在此基础上,本实验采用了人原代食管鳞状细胞癌细胞与新型3D微载体——microcarrier 6共同孵育,构建三维生长的“肿瘤类器官”,进而建立了患者来源的正常免疫小鼠移植瘤模型,弥补了因免疫缺陷小鼠缺乏免疫细胞(特别是T淋巴细胞)而不能准确模拟机体免疫系统对肿瘤的免疫攻击等重要缺点,从而更准确地还原患者肿瘤组织的分子生物学和组织学特点及肿瘤微环境。
本实验结果发现,基于microcarrier 6复合人原代食管鳞状细胞癌细胞构建正常免疫小鼠移植瘤模型的成瘤率为80%。该模型的特点是肿瘤成瘤较快,重复性良好,操作相对简便。在本实验造模方法中,提出下列关键因素:①标本处理,手术标本尽量贴近无菌环境,标本取出后放置无菌生理盐水或DMEM培养液中,标本取出后尽快处理,以免细胞过多失活或死亡。②提取细胞,胶原酶浓度定为0.05%,前期预实验阶段曾提高胶原酶浓度,发现消化时间稍长时,细胞会死亡或处于失活状态,细胞消化时间一般不超过4 h。③肿瘤细胞与微载体饱和状态,该项是造模成功的最关键因素,分离提取的肿瘤细胞要与微载体孔径充分饱和,这样在异位接种时才能更好地生长。肿瘤细胞与微载体孵育时间一般为12~24 h,期间要多次显微镜下观察二者的饱和状态。本实验显示,移植瘤在10~12天就可长出,13~18天为其生长高峰期。病理学HE染色提示大量异型核细胞的浸润生长,可侵及脂肪、肌肉、神经等组织,肿瘤中央因肿瘤细胞生长过速,血供不足,看见坏死灶,在肿瘤周边还可以看见毛细血管分布。这些均符合人肿瘤生长特点。免疫组化检测则显示p40、CK5/6表达阳性,进一步证实异型细胞来源于人食管鳞状细胞癌细胞。
综上所述,本实验基于3D微载体在正常免疫功能小鼠成功建立了移植瘤动物模型,该模型保留了小鼠正常免疫功能体系及人源性肿瘤的特点,为新型造模方法提供了思路,可待进一步探究与扩展。
