64Cu标记单链DNA及其体内分布的初步研究
2021-03-06段晓燕都义日翁兆平王相成王春梅李剑波
段晓燕 都义日 翁兆平 王相成 王春梅 王 涛 李剑波
(内蒙古医科大学附属医院 呼和浩特010050)
脱氧核糖核酸(DeoxyriboNucleic Acid,DNA)作为遗传信息的载体,在所有生命系统中发挥着重要作用。然而,在纳米领域中,通过纳米技术创造出人工的、多样的DNA多面体结构在纳米技术、自组装材料、分子电子技术和生物医学等领域同样发挥着重要作用[1-5]。
利用DNA分子内和分子间Watson-Crick碱基配对构建出可预测、可编辑的纳米结构,设计出具有不同维度、形状和尺寸的复杂结构,如DNA二十面体结构[6]、DNA立方体结构[7]、DNA三角双锥结构[8]、DNA四面体结构[9]等。DNA多面体结构表现出优异体内特性,包括毒性小、免疫原性低和优异生物稳定性[10]等。尤其在药物递送系统中,DNA多面体结构具有更加广阔前景,具有较长药物体内半衰期、生物利用度高和在特定组织中积累等特性,减少剂量依赖性和副作用。因为DNA多面体结构在分子探针、药物载带等方面存在着巨大潜力,引起了国内外研究人员的关注[11-15]。
在前期研究中[16],采用二氯亚锡还原法对单链DNA(single-stranded DNA,ssDNA,A20)进行99mTc标记,得到标记ssDNA(99mTc-ssDNA);再将99mTcssDNA(A20)与含有T20手臂链的DNA三角双锥结构(DNA Bipyramid Nanostructures,DBNs)混合杂交,得到99mTc-DBNs。通过一系列的体内外实验,探索了99mTc-DBNs在昆明鼠体内的分布和代谢情况。研究结果显示DNA三角双锥结构具备发展成为
SPECT(Single-Photon Emission Computed Tomography)分子探针的潜力。锝-99m属于单光子核素,采用SPECT设备进行信号采集;而PET设备采集正电子核素所产生的两个背向光子,分辨率更高,图像更为清楚。所以在本研究中,基于前期99mTc(金属放射性核素)标记DNA单链的研究成果,我们选用发射正电子的放射性金属核素取代99mTc进行DNA单链的标记研究,而64Cu成为最佳的候选PET核素之一。在制备基于DNA多面体结构的PET分子探针时,拟采用与制备99mTc-DBNs相似的标记方法,即首先将64Cu标记ssDNA,得到64Cu-ssDNA;再将64Cu-ssDNA与含有手臂链的DNA多面体结构混合杂交,从而制备出64Cu标记的DNA多面体结构,所以64Cu标记ssDNA的制备就成为制备基于DNA多面体结构的PET分子探针的关键一步。
本文在前期研究基础和以上实验设想上,将探索64Cu标记ssDNA的最佳标记条件;同时通过体内分布实验,研究64Cu标记ssDNA在昆明鼠体内的分布代谢情况,为后续64Cu标记DNA多面体结构PET分子探针的制备及分子探针在实验动物体内的生物性质研究提供有价值的实验依据和实验对照信息。
1 方法与材料
1.1 材料
DNA寡聚核苷酸单链(ssDNA)于Takara生物医 学 技 术 公 司(北 京);p-SCN-Bn-NOTA于Macrocyclics公司(Plano,TX,USA);昆明鼠(雌性,4~6周,18~20 g)于内蒙古大学实验动物中心;其他化学试剂于国药集团化学试剂有限公司(上海)。
1.2 单链DNA的放射性标记
在对单链DNA(ssDNA)进行64Cu标记之前,需要先将ssDNA与螯合剂p-SCN-Bn-NOTA进行偶联[17]。首先对ssDNA的5’端进行氨基修饰(Takara生物医学技术公司提供);然后将一定量的氨基修饰ssDNA溶解于磷酸盐缓冲液(Phosphate Buffered Saline,PBS)中,制成0.1 mmol·L-1ssDNA溶液;量取0.5 mg p-SCN-Bn-NOTA粉末溶解在DMSO中,加入ssDNA溶液中,碳酸钠缓冲液调节混合液pH至8.5~9.0。反应混合液在室温下持续振荡2 h。反应 结 束 后,利 用NAP-5脱盐柱(GE Healthcare,Fairfield,CT,USA)对反应混合液进行纯化,1xPBS作为洗脱缓冲液,得到纯化的偶联NOTA的ssDNA(NOTA-ssDNA)。NOTA-ssDNA的浓度由UV-VIS光谱仪(Agilent Cary 60,Agilent Technologies,Santa Clara,CA,USA)测量,其中DNA的浓度确定后,用于后续标记实验。
将64Cu溶液(溶于0.1 mol·L-1HCl)与100μL醋酸钠溶液(0.05 mol·L-1,pH 5.5)混匀,加入500μL NOTA-ssDNA溶液后,在37°C下反应1 h。在反应期间,利用放射性高效液相色谱(Radio-HPLC)检测放射性标记反应的程度。反应结束后,将混合溶液通过NAP-5脱盐柱纯化,乙二胺四乙酸钠溶液(0.05 mol·L-1)用作流动相,得到纯化的目标产物64Cu标记ssDNA(64Cu-ssDNA),用于后续的生物学评价实验。
1.3 体外稳定性实验
将纯化后64Cu-ssDNA(100μL)分别与PBS溶液(200μL)和小鼠血清(Mouse serum,200μL)孵育一定时间,利用薄层色谱(Thin Layer Chromatography,TLC)在不同时间点(0.5 h、1.0 h、2.0 h、4.0 h、6.0 h)检测64Cu-ssDNA的放化纯度,计算64Cu-ssDNA的体外稳定性。
1.4 体内分布实验
将3.7×106Bq64Cu-ssDNA通过小鼠尾静脉注射到昆明鼠体内,在注射后30 min和180 min后,将昆明鼠(n=3/每组)麻醉后处死,收集感兴趣器官或者组织进行称重,并用γ计数器(PerkinElmer)测量64Cu-ssDNA的摄取量。每个器官或组织中的示踪剂摄取量表示为每克组织注射剂量的百分比(%ID·g-1)。
动物实验的研究方案已经得到内蒙古医科大学医学伦理委员会批准。动物实验按照“Guide for the Care and Use of Laboratory Animals”进行[18]。
2 结果与讨论
2.2 单链DNA的放射性标记及体外稳定性
ssDNA的放射性标记按照图1所示进行。首先将氨基修饰ssDNA与双功能螯合剂p-SCN-Bn-NOTA进行偶联,得到NOTA-ssDNA溶液;再将NOTA-ssDNA溶 液 与64Cu溶 液 混 匀,反 应1 h后Radio-HPLC(Dionex UltiMate 3000)检测,放化标记率为(66.4±2.85)%(n=3),如图2所示。64Cu-ssDNA保留时间为9~10 min,而游离铜保留时间在15~16 min;利用NAP-5脱盐柱对反应溶液进行纯化,得到64Cu-ssDNA溶液,放化纯度大于95%。

图1 ssDNA放射性标记示意图Fig.1 Schematic diagram of ssDNA radiolabeling
将纯化后64Cu-ssDNA分别与PBS溶液(v/v=1/2)和小鼠血清(v/v=1/2)孵育一定时间,利用TLC检测64Cu-ssDNA的放化纯度,结果如图3所示,64CussDNA在PBS和小鼠血清中至少能稳定存在6 h,且在小鼠血清中孵育4 h后,64Cu-ssDNA的放化纯度大于90%。
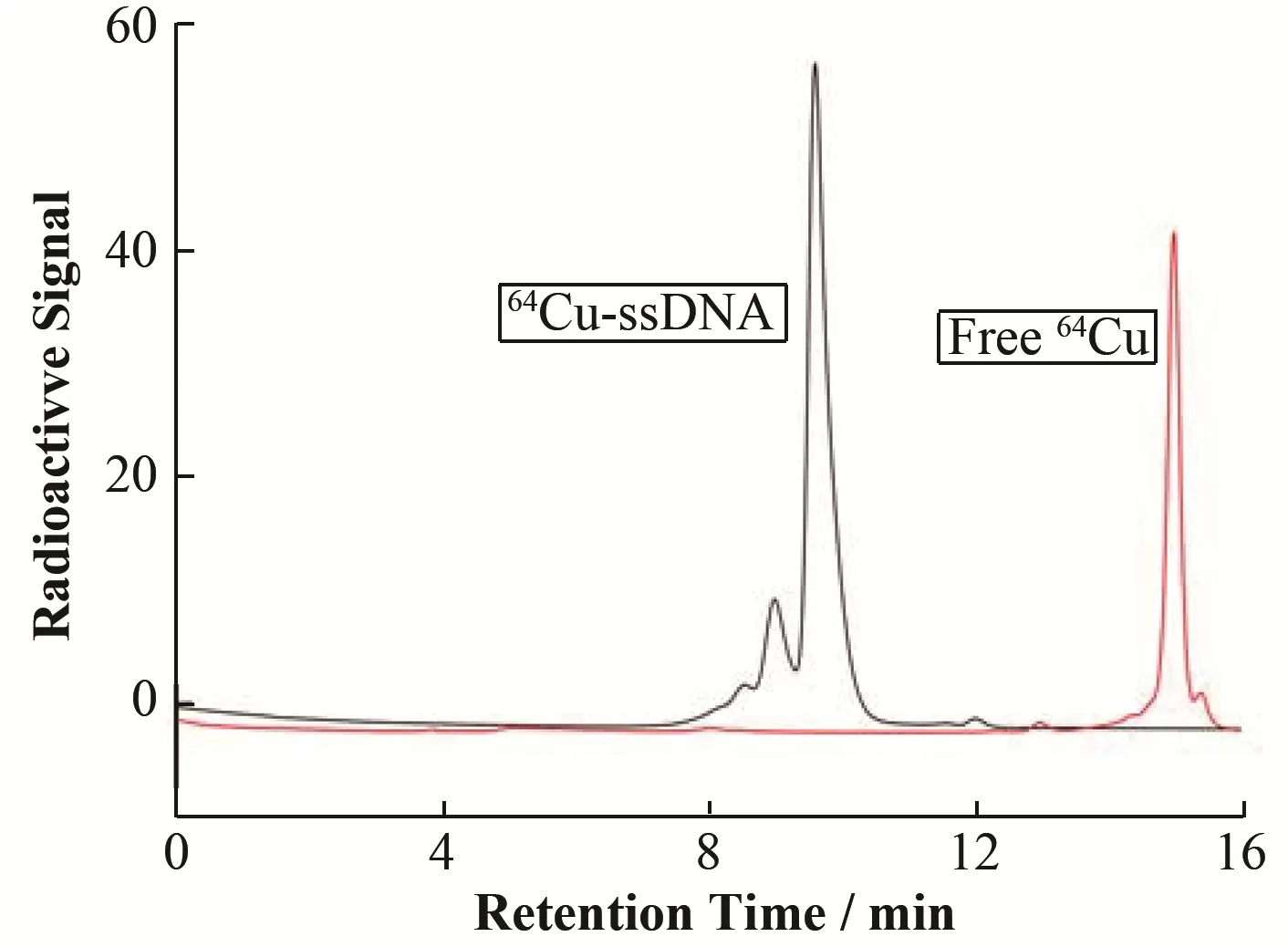
图2 64Cu-ssDNA的放射性HPLC分析Fig.2 Radio-HPLC analysis of 64Cu-ssDNA

图3 64Cu-ssDNA在PBS溶液和小鼠血清中的稳定性研究Fig.3 Stability of 64Cu-ssDNA in PBS and mouse serum
2.3 体内分布实验
将纯化后64Cu-ssDNA(3.7×106Bq)溶液通过尾静脉注射到昆明鼠体内,在注射后30 min和180 min,将该时间点昆明鼠(n=3)麻醉后处死,取感兴趣组织或者器官,研究各组织或器官64Cu-ssDNA的摄取量,数值用%ID·g-1进行表示。实验结果如图4所示。注射64Cu-ssDNA 30 min后,心脏中放射性摄取量为(3.53±0.30)%ID·g-1,在180 min后,心脏中的摄取量为(2.33±0.36)%ID·g-1,64Cu-ssDNA进入血管后,随着血液循环运送到各个脏器或器官。注射64Cu-ssDNA 30 min和180 min后,肌肉和脑组织放射性摄取量低,摄取量值均低于1%ID·g-1;注射后30 min,肝脏和脾脏有一定量的放射性摄取,摄取 量 分 别 是(6.99±0.77)% ID·g-1和(3.11±0.42)%ID·g-1,注射后180 min,肝脏和脾脏中的摄取量有些降低,摄取量分别是(5.66±0.89)%ID·g-1和(1.49±0.33)%ID·g-1。胃肠道的放射性摄取量从注射后30 min的(3.64±0.30)%ID·g-1到180 min后的(21.37±4.50)%ID·g-1,说明一部分64Cu-ssDNA通过昆明鼠的胃肠道代谢。注射64Cu-ssDNA 30 min后,肾脏中出现高放射性摄取量((12.87±1.56)%ID·g-1),说明64Cu-ssDNA通过尾静脉进入昆明鼠体内后,经过肾脏过滤进入膀胱,此时间点膀胱中的放射性摄取量达到了(38.36±4.65)%ID·g-1;180 min后,肾脏中的摄取量较30 min时的摄取量降低,而膀胱中的放射性摄取量进一步增大,达到了(63.84±5.86)%ID·g-1,结果说明64Cu-ssDNA进入昆明鼠体内后,主要通过泌尿系统代谢排出体外。

图4 64Cu-ssDNA在昆明鼠体内的分布研究(n=3)Fig.4 Biodistribution of 64Cu-ssDNA in Kunming mice(n=3)
3 结语
本研究成功对ssDNA进行了铜-64标记,得到了目标产物64Cu-ssDNA(纯化后放化纯度>95%),为后期基于DNA多面体结构的PET分子探针的制备解决了关键的一步;同时本文也对64Cu-ssDNA在昆明鼠体内的分布代谢情况进行了研究,了解64CussDNA进入昆明鼠体内后,主要通过泌尿系统代谢排出体外,为后续研究64Cu标记DNA多面体结构的体内分布代谢提供一定的实验依据和实验对照。
