二氢欧山芹通过调节自噬保护高糖诱导的足细胞损伤
2021-03-06师朗宋志霞张雅飞
师朗 宋志霞,2 张雅飞
1三峡大学第一临床医学院,宜昌 443003; 2宜昌市中心人民医院肾内科 443003
糖尿病肾病(diabetic nephropathy,DN)是糖尿病病程发展中的一种破坏性微血管的并发症,其发病特征以持续性蛋白尿、肾小球滤过率受损及肾功能进行性下降为主[1]。相关研究表明终末期肾病病因中DN占比高达40%[2]。最近的一项研究表明,在北京和上海等大城市,慢性肾脏病病因分析中,糖尿病相关性肾脏病所占比例超过了肾小球肾炎[3]。目前,临床上对DN的发生和发展尚无特效措施,仍有大量患者进展为终末期肾病,给患者及社会造成很大的经济负担。因此,深入探究DN的发病机制,开发相关预防或延缓DN进展的治疗策略十分重要。
DN发生发展的机制截至目前尚未完全阐明,传统观点认为与肾小球滤过屏障受损严重程度有关[4]。足细胞是肾小球滤过屏障的重要组成部分,位于肾小球基底膜的外侧[5]。我们课题组及其他学者的研究证实,足细胞损伤可能是促进DN的发生和发展的重要原因[6-7]。由于足细胞为终末分化细胞,几乎无再生能力,因此,细胞内降解系统对维持其内环境稳定就显得尤为重要。自噬是细胞降解异常细胞内物质过程的统称,其作为细胞内降解系统,是一种保守的稳态过程,在各种条件下对维持细胞内稳态至关重要[8]。早期研究表明,自噬与多种代谢性疾病相关,且在调节哺乳动物的糖脂代谢中发挥重要作用[9]。最近研究表明,自噬异常亦与足细胞损伤有关,可能是DN大量蛋白尿的重要机制[10-11]。
二氢欧山芹(columbianetin,CBT)属于呋喃香豆素类化合物,最早从中药材独活中分离出来的[12]。目前已证实CBT广泛存在于独活、当归等多种药用植物中,且在独活中的含量较多,是其主要质量控制成分[13-14]。药理研究表明CBT具有抗炎、镇痛及抗肿瘤等作用[15]。另外,CBT被证明具有抑制巨噬细胞活化,稳定肺泡巨噬细胞的分离,诱导结肠癌细胞凋亡和坏死等作用[16]。CBT还可以诱导细胞色素的RNA和蛋白表达,同时足细胞中细胞色素蛋白的释放参与了足细胞损伤[17-18]。由此可以看出 CBT在疾病治疗中起重要作用,且对足细胞的损伤有一定作用,但目前CBT与DN的相关研究报道较少。本研究拟探讨CBT对高糖诱导的足细胞损伤是否有保护作用,其机制是否与调节自噬有关。
材料与方法
一、材料
小鼠永生系足细胞MPC5由上海酶研科技有限公司提供。二氢欧山芹购自北京百奥莱博科技有限公司。
胎牛血清(北京百奥莱博科技有限公司);RPMI-1640 培养液(杭州吉诺生物医药技术有限公司)。抗体Nephrin、Podocin、Beclin-1、Desmin、P62、p-JNK(CST公司,美国);羊抗兔二抗(Santa Cruz公司,美国)。GFP-LC3-Ⅱ质粒(赛默飞科技中国有限公司),TLR4 siRNA(sc-156001)、control siRNA、SP600125(sc-200635)及转染试剂购自Santa Cruz公司。
二、方法
1.足细胞培养 将永生性小鼠足细胞系MPC-5在含有10% FBS和100 U/mL IFN-γ的PMI-1640培养基中在33℃,5% CO2条件下培养增殖,然后在37℃,5% CO2条件下在无IFN-γ的RPMI-1640中孵育14 d,诱导细胞分化。
2.蛋白质印迹法 MPC-5细胞在冷RIPA缓冲液中裂解,用10%SDS-PAGE分离蛋白,然后转移到聚偏二氟乙烯膜(Thermo Fisher,Waltham,MA,USA)。再用含5%脱脂奶粉的磷酸缓冲盐溶液在4°C孵育3 h,4°C与所用一抗孵育过夜,再与荧光标记的二抗在37°C孵育1 h,采用化学发光法进行检测并采用Image-Pro plus软件(Media Controbernetics Inc,Rockville,MD)分析相关蛋白的表达,选用甘油醛-3-磷酸脱氢酶作为内参照。
3.免疫荧光 吸取100 μL细胞悬液加至6孔板中继续传代培养。待细胞贴壁后,将足细胞传代种植于96孔板上,细胞贴壁融合达 60%后,以DMEM培养基孵育,以脂质体Lip 2000转染 GFP-LC3-Ⅱ质粒,按照说明书每孔加入4 g/mL 浓度的 GFP-LC3-Ⅱ质粒转染 6 h 后,更换正常培养基培养24 h,之后分别予以 5.0 mmol/L、30.0 mmol/L 葡萄糖培养48 h后,在荧光显微镜下观察足细胞自噬情况。
4.siRNA转染 用脂质体Lip2000将TLR4 siRNA导入足细胞中,具体操作步骤按Lipofectamine 2000说明书进行。将生长状态良好的细胞均匀地接种在6孔板上,培养过夜后细胞融合达60%,换为Opti-MEM培养基培养。TLR4 siRNA与Lipo 2000的稀释液混匀后常温静置20 min,加入孔板中,4 h后加入DMEM培养液、无关片段转染复合物或TLR4 siRNA(40 nmol/L)转染复合物,转染后48 h后进行后续实验。
三、统计学方法
采用GraphPad 8.0软件进行统计分析,计量资料以Mean±SD表示,多组之间比较采用单因素方差分析检验,独立样本采用t检验;以P<0.05 为差异有统计学意义。
结 果
一、高糖诱导足细胞损伤及自噬水平下降
首先把足细胞分为正常浓度组:NG(5 mmol/L)、高糖组:HG(30 mmol/L)和甘露醇渗透压对照组:NG+M(5 mmol/L+25 mmol/L)进行处理,然后采用蛋白质印迹法检测及定量分析Desmin、Nephrin、Podocin、Beclin-1、P62等相关蛋白表达,结果显示,与正常浓度组相比,甘露醇渗透压对照组相关检测蛋白表达差异无统计学意义。而高糖组Nephrin、Podocin表达显著下降,Desmin表达升高,说明高糖刺激足细胞引起足细胞损伤。而P62表达明显增高、Beclin-1表达则显著下降,表明高糖可抑制足细胞自噬。(图1)
二、2.2 CBT 对高糖诱导的足细胞损伤及自噬的影响
为了探讨CBT对足细胞损伤及自噬的影响,首先设定天然提取物CBT浓度梯度为0.5μg/mL,10 μg/mL,20 μg/mL,40 μg/mL,80 μg/mL,以Beclin-1为观察指标,观察到自噬增强较为明显的浓度为20 μg/mL,且20~80 μg/mL之间无明显差异,固选用20 μg/mL为实验浓度(图2A、2B)。然后把足细胞分为正常浓度组:NG(5 mmol/L)、高糖组:HG(30 mmol/L)和CBT组:HG+CBT(30 mmol/L+20 μg/mL)进行处理,再采用蛋白质印迹法检测及定量分析结果显示与高糖组相比,CBT处理后足细胞Nephrin、Podocin蛋白表达显著升高,Desmin蛋白表达下降,表明CBT可抑制足细胞损伤。同时P62蛋白表达下降、Beclin-1表达升高,表明 CBT可诱导足细胞自噬。(图2C、2D)

注:NG:正常浓度葡萄糖;HG:高糖;M:甘露醇;αP<0.05,bP>0.05。图1 NG、NG+M和HG各组足细胞相关蛋白、损伤标志物和自噬相关标记物的表达 1A.足细胞Desmin、Nephrin、Podocin、Beclin-1和P62蛋白表达(蛋白质印迹法);1B、1C.图1A定量分析

注:NG:正常浓度葡萄糖;HG:高糖;CBT:二氢欧山芹;aP<0.05,bP>0.05。图2 NG、HG和HG+CBT各组足细胞相关蛋白、损伤标志物和自噬相关标记物的表达 2A.不同浓度CBT组Beclin-1蛋白表达(蛋白质印迹法印迹);2B.图2A定量分析;2C.足细胞Desmin、Nephrin、Podocin、Beclin-1和P62蛋白表达(蛋白质印迹法);2D、2E.图2C定量分析
三、CBT可上调TLR4、P-JNK的表达
已有研究证实,TLR4在糖尿病患者高糖诱导炎症反应中起关键作用。本研究检测了CBT对足细胞内TLR4表达及p-JNK磷酸化水平的影响。结果显示,与正常浓度葡萄糖组相比,CBT可显著促进足细胞内TLR4蛋白表达以及p-JNK蛋白磷酸化激活。说明CBT可通过TLR4/ P-JNK信号通路发出信号。(图3)

注:NG:正常浓度葡萄糖;HG:高糖;CBT:二氢欧山芹;aP<0.05。图3 NG、HG和HG+CBT各组TLR4及p-JNK蛋白的表达 3A.足细胞TLR4及p-JNK蛋白的表达(蛋白质印迹法);3B.图3A定量分析
四、siRNA TLR4阻断CBT的保护作用
TLR4 siRNA抑制TLR4表达同时可抑制的p-JNK蛋白激活(图4A、4B)。按预设分组处理足细胞,通过蛋白质印迹法检测及定量分析Desmin、Nephrin、Podocin、Beclin-1、P62等相关蛋白表达,结果显示,相比于CBT组,加入TLR4 siRNA(40 nmol/L)能使Nephrin、Podocin表达显著下降,Desmin表达升高,说明TLR4 siRNA能够有效地阻断CBT对高糖诱导的足细胞损伤的保护作用。同时P62蛋白表达升高、Beclin-1表达下降,表明TLR4 siRNA也阻断了CBT诱导足细胞自噬的作用(图4C、4E)。
五、JNK抑制剂SP600125阻断CBT的保护作用
为了进一步探讨TLR4/p-JNK信号通路对CBT保护足细胞的影响,我们加用JNK酶特异性抑制剂SP600125(10 μmol)。采用蛋白质印迹法检测及定量分析Desmin、Nephrin、Podocin、Beclin-1、P62 等相关蛋白表达,结果显示SP600125亦阻断了CBT对高糖诱导的足细胞损伤的保护作用,足细胞中Nephrin、Podocin及Beclin-1蛋白表达显著下降,同时Desmin及P62蛋白表达显著增高,该结果提示CBT通过TLR4/p-JNK调节自噬,进而改善高糖诱导的足细胞损伤。(图5)
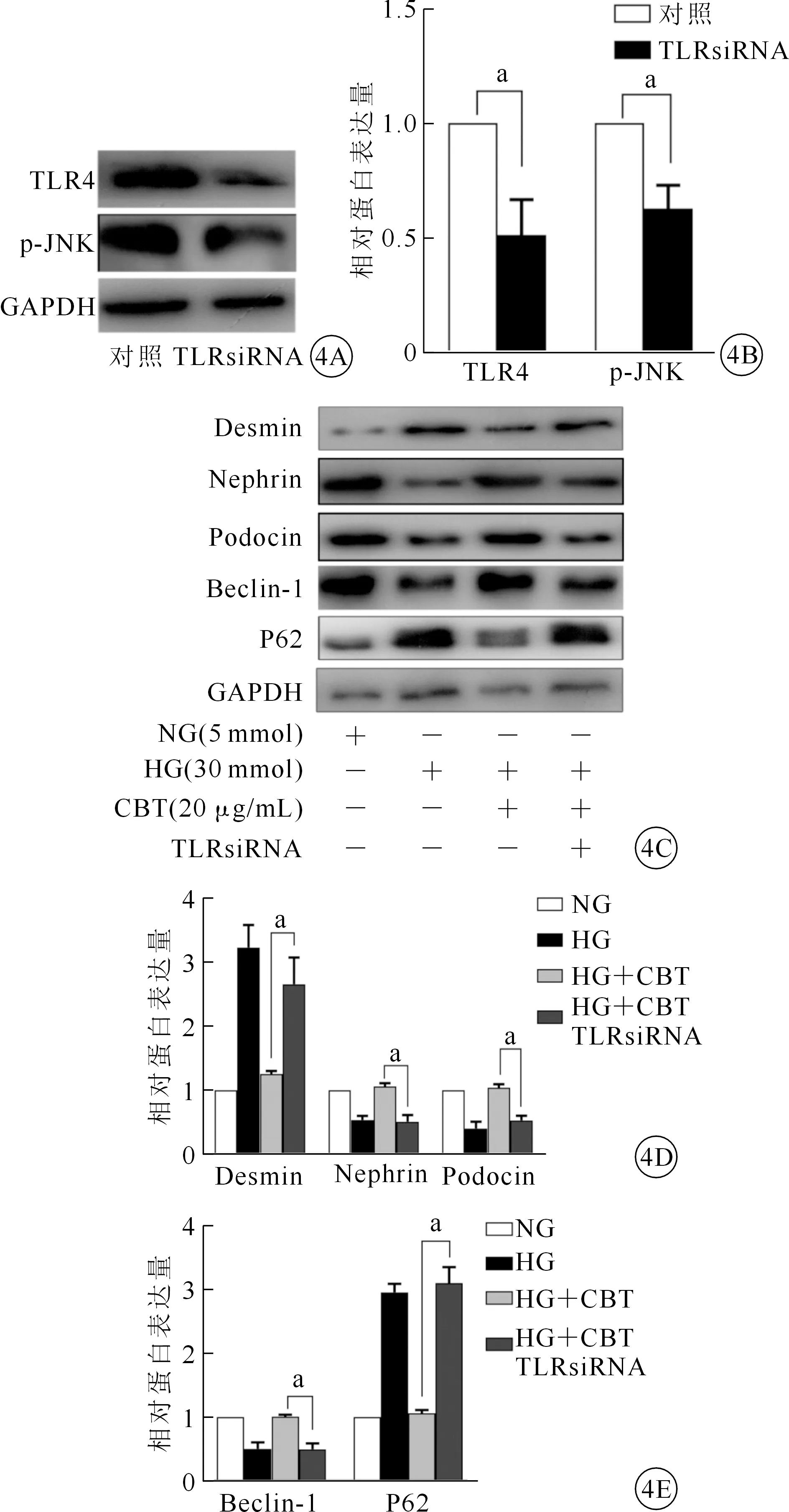
注:NG:正常浓度葡萄糖;HG:高糖;CBT:二氢欧山芹;aP<0.05。图4 NG、HG、HG+CBT和HG+CBT+TLRsiRNA各组足细胞相关蛋白、损伤标志物、自噬相关标记物及TLR4等蛋白的表达 4A.对照组及TLR4沉默组TLR4和p-JNK蛋白表达(蛋白质印迹法);4B.图4A定量分析;4C.足细胞Desmin、Nephrin、Podocin、Beclin-1和P62蛋白表达(蛋白质印迹法);4D、4E.图4C定量分析
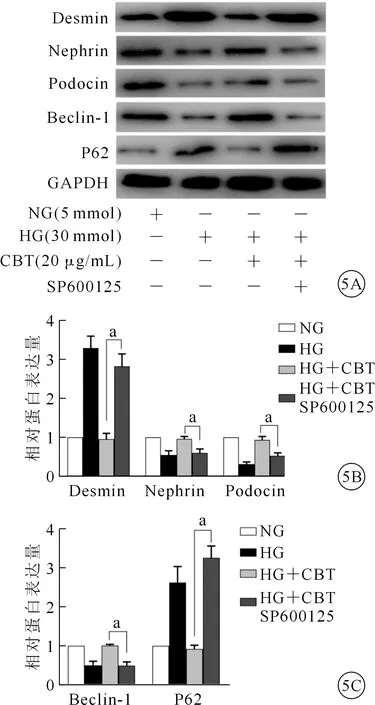
注:NG:正常浓度葡萄糖;HG:高糖;CBT:二氢欧山芹;aP<0.05。图5 NG、HG、HG+CBT和HG+CBT+SP600125各组足细胞相关蛋白、损伤标志物及自噬相关标记物蛋白的表达 5A.足细胞Desmin、Nephrin、Podocin、Beclin-1和P62蛋白表达(蛋白质印迹法);5B、5C.图5A定量分析
六、实验各组LC3-Ⅱ的表达情况
LC3-Ⅱ是自噬体标记物。我们进一步使用荧光显微镜观察GFP-LC3-Ⅱ转染后各组细胞染色荧光颗粒情况,结果显示高糖可以明显抑制足细胞自噬标志物LC3-Ⅱ的荧光强度,提示高糖抑制足细胞自噬。而CBT能够促进足细胞自噬发生,起到细胞保护作用。与CBT组相比,TLR4 siRNA及SP600125组中足细胞的LC3-Ⅱ荧光颗粒数目明显减少,强度减弱明显,表明CBT通过TLR4、p-JNK途径诱导足细胞自噬。(图6)

图6 各组足细胞内和LC3-Ⅱ蛋白的表达(免疫荧光 40×)
讨 论
DN是世界范围内最重要的健康问题之一,并且在未来几十年内持续恶化[19]。研究表明足细胞在蛋白尿的发病机制和DN的进展中起重要作用[20]。DN进展过程中的高血糖往往导致足细胞损伤、脱落、数目下降,进一步导致蛋白尿的形成,其中足细胞损伤是蛋白尿的主要标志[21]。足细胞由Nephrin和Podocin等裂孔隔膜蛋白连接,组成肾小球滤过蛋白质和其他大分子物质的主要屏障[22]。有研究证实当Nephrin基因表达发生变化时,肾滤过膜结构和屏障功能的完整性受到影响,最终导致蛋白尿的产生[23]。Desmin 蛋白在机体正常时并不表达,而当肾小球足细胞严重受损时可大量表达[24]。另外有研究证明蛋白尿与足细胞特异性蛋白Nephrin和Podocin的减少有关,Nephrin、Podocin及其mRNA表达随足细胞损伤而降低[25]。可见Nephrin、Podocin及Desmin等相关蛋白的表达与DN蛋白尿形成密切相关。我们研究发现,高糖组小鼠足细胞内Nephrin、Podocin表达显著下降,Desmin表达显著升高,提示高糖可引起足细胞损伤,这一结果与以上研究一致。
细胞自噬在细胞维持自身代谢需要和某些细胞器更新等过程中起着核心作用,对于维持细胞内环境稳态至关重要[8]。已有大量研究证实自噬异常与足细胞损伤密切相关。在阿霉素诱导的足细胞损伤模型中,自噬活化可以抑制足细胞的损伤,而在足细胞特异性敲除Atg7的小鼠足细胞损伤加重,该研究结果证实自噬在减轻足细胞损伤中发挥重要作用[26],亦有研究在DN中模型中观察到自噬活性能够减轻DN尤其足细胞损伤[27]。我们课题组前期在链脲佐菌素诱导的DN大鼠模型中发现足细胞裂孔隔膜蛋白Nephrin与自噬相关蛋白Beclin-1呈正相关,给予活性维生素D3干预后可上调自噬的表达,同时减轻了足细胞损伤[11]。研究证实,足细胞受损时自发引起的自噬活化与多种分子机制相关,其中Beclin-1是早期被确定的自噬相关蛋白,目前作为监测自噬的标记被广泛应用,Beclin-1的表达水平在一定程度上代表了自噬活性[28]。细胞内 LC3-Ⅱ 水平是检测自噬的另一标志物[29]。当细胞自噬发生时,P62可与定位在自噬体上的LC3-Ⅱ结合形成复合物,最终在自溶酶体中降解,自噬不足时,P62 降解被抑制,现已用作检测自噬降低的标志[30]。在本研究中,我们测定了Beclin-1,P62及 LC3-Ⅱ的表达,以确定高糖对足细胞自噬的影响。结果发现,高糖处理的足细胞中P62表达显著增多而Beclin-1表达明显减少,这一结果提示足细胞损伤可激活足细胞自噬,但高糖明显抑制了其自噬活性,这一结果与上述研究一致。
CBT是一种存在于多种中药中的天然香豆素类化合物,已被证明其具有抗炎、镇痛及抗肿瘤等多种药理作用[13,15]。本研究在高糖诱导的足细胞损伤的基础上,探讨了CBT对足细胞自噬和肾脏保护的影响及其潜在分子机制,结果发现CBT对高糖诱导的足细胞损伤具有显著抑制作用,同时CBT处理后足细胞中Nephrin、Podocin表达显著升高而Desmin表达下降,表明CBT明显可抑制足细胞损伤,而P62蛋白表达下降、Beclin-1表达升高,LC3-Ⅱ荧光标记蛋白增多等结果提示CBT可诱导足细胞自噬,保护肾脏受损。
Toll样受体4(Toll-like receptor-4,TLR4)属于受体家族,是参与信号转导、细胞周期调节的参与识别受体[31]。有研究表明,TLR4信号传导与自噬有关[32]。也有研究表明高糖可激活间质细胞中的TLR4,且TLR4在糖尿病患者高糖诱导炎症反应中起关键作用[33]。另外,在胰岛β细胞中,可通过调控脂毒性的TLR-4通路实现拮抗高糖高脂毒性[34]。本研究结果显示CBT可显著促进TLR4蛋白表达,同时TLRsiRNA和抑制剂SP600125具有相同的作用结果,即均可下调Beclin-1、Nephrin、等蛋白表达同时上调Desmin及P62蛋白表达,表明其可抑制CBT 作用活性,抑制足细胞自噬。JNK是丝裂原活化蛋白激酶的一个重要分支,其在细胞凋亡及脏器细胞受损等过程中起重要作用[35]。本研究结果显示TLRsiRNA可显著抑制 p-JNK蛋白表达,提示CBT可通过诱导足细胞自噬对DN的保护作用,而这一过程可能是通过磷酸化JNK信号通路实现的。
综上所述,CBT可诱导足细胞自噬,抑制足细胞损伤,进而减轻肾脏受损,这一过程可能是通过磷酸化JNK信号通路实现的。我们的研究结果初步为CBT成为治疗DN潜在药物提供了证据,后续还需要做更多的研究探索CBT更深层次的作用机制
利益冲突作者没有利益冲突需要声明
