基于HPLC-MS/MS的鸡肉中的硝基咪唑类药物残留检测方法的建立
2021-03-05李祥波王亚会
李祥波,王亚会
上海太太乐食品有限公司(上海 200000)
鸡肉作为禽肉中极为重要的部分,结缔组织柔软,脂肪分布均匀,富含人体不可缺少的维生素、微量元素和肌苷酸(IMP)等鲜味物质,具有高蛋白、低脂肪、低热量、低胆固醇的营养特点,被称为“营养之源”。鸡肉现已成为世界上仅次于猪肉的第二大肉品,与人们的日常生活密不可分。传统的分散式养殖已不能满足日益增长的需求,规模化养殖已成为趋势,但这也带来了新的问题,比如养殖过程中滥用抗生素等药物导致的残留。
甲硝唑(Metronidazole,MNZ)、地美硝唑(Dimetridazole,DMZ)、左旋咪唑(levamisole,LMS)、洛硝达唑(Ronidazole,RNZ)属于硝基咪唑类药物,其分子式见图1。1957年第一个硝基咪唑类药物甲硝唑开始研发,之后的几年该类药物在抑制厌氧菌感染和抗原虫感染等方面得到了迅速的发展[1]。硝基咪唑类药物具有抗厌氧菌种类广、杀菌作用强、成本低廉、见效快等特点,常被应用于禽类养殖中寄生虫的防治[2]。Gentili等[3]研究表明,硝基咪唑类药物由于含有硝基杂环类结构,代谢过程比较复杂,具有潜在的致癌、致病变、损伤DNA等作用,对动物源性食品安全构成了直接威胁,被许多国家列为违禁药物[4]。
目前测定硝基咪唑类药物的方法主要有气相色谱法、气相色谱串联质谱法、高效液相色谱法、高效液相色谱串联质谱法[5-8]等。其中气相色谱法及气相色谱串联质谱法适用范围相对较窄;液相色谱法检出限高、基质干扰较大;高效液相色谱串联质谱法具有检出限低、抗干扰能力强、使用范围广等优点,从而被广泛应用于硝基咪唑类药物的检测中。对于以上的4种硝基咪唑药物残留,在鸡肉中还没有成熟多残留的分析方法,为保障消费者的饮食安全和工业用鸡肉原料的供应,有必要建立一种具备操作简单、重现性好、背景噪音低、具有较高的灵敏度和选择性的检测方法。试验主要基于液液萃取技术、固相萃取技术以及液质联用技术建立了鸡肉中硝基咪唑类药物残留的检测方法。
1 试验部分
1.1 主要仪器与试剂
甲醇、乙腈、乙酸乙酯、甲酸、正己烷(均为色谱纯)、盐酸、氨水、磷酸氢二甲(均为分析纯)(以上试剂来自上海安谱实验科技股份有限公司);甲硝唑、地美硝唑、左旋咪唑、洛硝达唑(纯度≥98%,上海安谱实验科技股份有限公司);试验样品:鸡肉(来自公司供应商);试验用水为超纯水。
液相三重四极杆串联质谱联用仪(4500 AB SCIEX);电子天平(ML303梅特勒);涡旋混合器(VORTEX GENIUS3德国IKA公司);旋转蒸发仪(R-210/V-700/V850 BUCHI实验仪器公司);离心机(TG16-WS 长沙湘仪离心机仪器有限公司);0.22 μm滤膜、Zorbax SB C18柱(50 mm×2.1 mm×1.8μm)、SCX固相萃取柱:60 mg,3 mL、MCX固相萃取柱:500 mg,6 mL、PCX阳离子固相萃取柱:60 mg,3 mL(均来自上海安谱科学仪器公司)。
1.2 标准品配制
分别配制甲硝唑、地美硝唑、左旋咪唑、洛硝达唑标准储备溶液,均为1 mg/mL。准确称取一定量的甲硝唑、地美硝唑、左旋咪唑、洛硝达唑标准物质,用甲醇分别配成1.00 mg/mL的标准贮备溶液。于-18℃避光保存,保存期为1年。
混合标准储备溶液:10 μg/mL。吸取甲硝唑、地美硝唑、左旋咪唑、洛硝达唑标准储备溶液,用甲醇配成10 μg/mL。于-18 ℃避光保存,保存期为6个月,使用前回温到室温。
标准工作溶液:根据需要,临用前吸取一定量的混合标准储备溶液,用甲醇-水(1∶1)稀释配制成浓度梯度依次为0.25,0.5,1.0,2.5,5.0和10 μg/kg的混合标准工作液。
1.3 试验条件
1.3.1 色谱条件
色谱柱:Zorbax SB C18柱(50 mm×2.1 mm×1.8μm);流动相为乙腈+水(0.1%甲酸);柱温为35℃;进样量为2 μL。
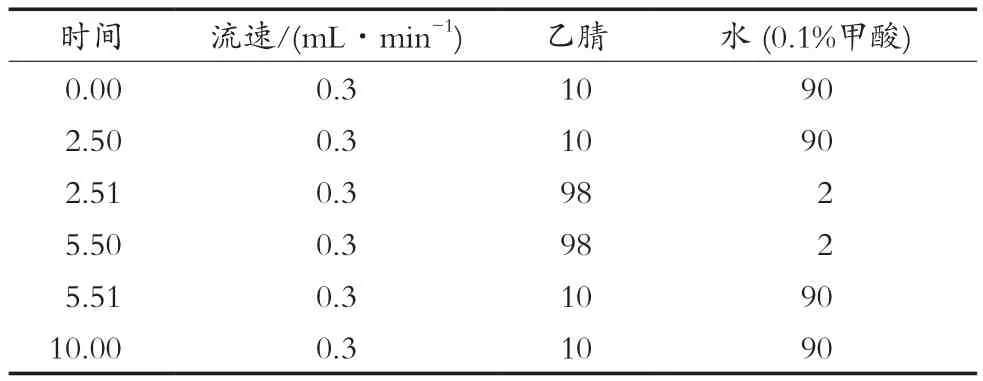
表1 液相色谱梯度洗脱条件
1.3.2 质谱条件
离子源,电喷雾离子源(ESI);扫描方式,正离子扫描;检测方式,多反应监测(MRM);雾化气(NEB)、气帘气(CUR)、辅助加热气(AUX)、碰撞气(CAD)均为高纯氮气;使用前应调节各气体流量以使质谱灵敏度达到检测要求;喷雾电压、去集簇电压、碰撞能等电压值应优化至最优灵敏度;Q1,Q3均为单位分辨率(UNIT);定性离子对、定量离子对、碰撞气电压、去簇电压,见表2。
1.4 样品前处理
1.4.1 样品提取
从全部的样品中取出约0.5 kg具有代表性样品,充分搅碎,混匀,平均分成2份,分别装入洁净的容器内。密封作为试样,标明标记。在抽样和制样的操作过程中,应防止样品受到污染或发生残留物含量的变化。将试样于-18 ℃冷冻保存。
准确称取2 g样品,精确至0.01 g,置于50 mL离心管中(干制品首先加入5 mL水充分溶解样品),加入15 mL乙酸乙酯,振荡提取2 min,然后以4 000 r/min离心5 min,将上清液转移到250 mL梨形瓶中,残渣用15 mL乙酸乙酯重复提取一次,合并2次提取液,40 ℃水浴温度下旋蒸至干。加3 mL 0.1 mol/L盐酸,涡旋振荡1 min溶解残渣,转移至15 mL离心管中,然后加入2 mL正己烷至梨形瓶中,涡旋振荡1 min溶解残渣,转移至15 mL离心管中,再向梨形瓶中加入3 mL 0.1 mol/L盐酸溶解残渣,合并3次溶解液,充分混匀,然后以2 000 r/min离心5 min,弃去正己烷层,待净化。
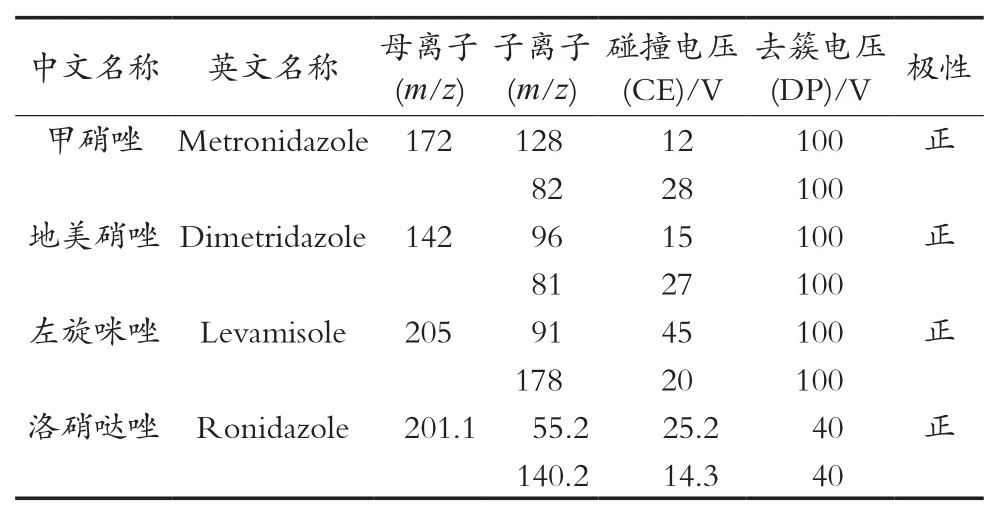
表2 硝基咪唑类质普条件分析
1.4.2 样品净化
依次用3 mL甲醇、3 mL 0.1 mol/L盐酸水溶液活化 MCX固相萃取小柱,然后将提取液过柱,用3 mL水、3 mL甲醇淋洗小柱,减压抽干,用5 mL氨水甲醇(5+95)洗脱。将洗脱液40 ℃氮气吹干后,用1 mL乙腈+水溶液(1+1)溶解,过0.22 μm膜后供液质仪器分析。
1.5 数据分析
所有数据以平均值±标准偏差(Mean values±S.D.)表示,用Sigma Plot 12.5软件绘制各物质含量变化图。
2 结果与讨论
2.1 质谱条件优化
试验将质量浓度为1 mg/mL的甲硝唑、地美硝唑、左旋咪唑、洛硝达唑标准储备液分别稀释至1 μg/mL,采用蠕动泵直接进样方式,分别在正离子(ESI+)、负离子(ESI-)模式下进行Q1母离子全扫描。试验结果表明:甲硝唑、地美硝唑、左旋咪唑、洛硝达唑均在ESI+模式下具有较高的响应值。分别考察了喷雾电压、雾化温度、气帘气、雾化气、辅助气对离子响应强度的影响,同时对各分子离子进行子离子扫描,选取合适的离子对,在MRM模式下优化簇电压(DP)和碰撞电压(CE),选取质谱强度最高时的DP与CE作为该化合物的最优参数,详见表2中质谱条件,质谱图见图2。

图2 甲硝唑(a)、地美硝唑(b)、左旋咪唑(c)、洛硝哒唑(d)质谱图(1 μg/mL)
2.2 萃取溶剂的选择
GB/T 21318—2007[9]、农业部2483号公告-7-2016[10]、于敏等[11]文献,曾提到常用乙腈、乙酸乙酯、酸性乙腈(含0.1%甲酸)来提取动物组织中的硝基咪唑类残留。试验研究了乙腈、乙酸乙酯、酸性乙腈(含0.1%甲酸)的提取效果。结果表明,当加标量为0.5 μg·kg-1时,乙腈、酸性乙腈(含0.1%甲酸)回收率结果较差,见图3。因此,后续试验选择乙酸乙酯为提取溶剂。
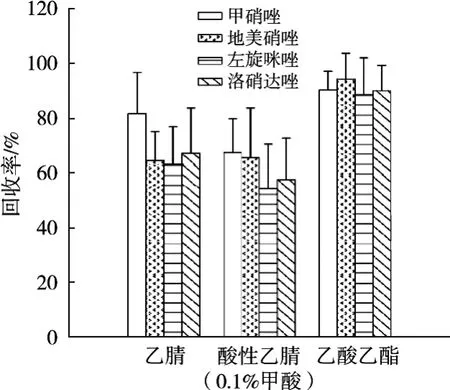
图3 不同萃取溶剂硝基咪唑类的回收率(n=6)
2.3 净化方法优化
农业部2483号公告-7-2016号文件,指出用混合阳离子固相萃取柱进行萃取,实验室选择了MCX、PCX、SCX固相萃取柱进行比较,结果见表3。由表3可知,SCX小柱对硝基咪唑类化合物的回收率相较于其他两种小柱普遍略低,这可能与SCX含有强酸性的磺酸功能基团有关。PCX回收率次之,PCX是以阳离子交换混合机理的水可浸润型聚合物为基质的萃取柱。PCX克服了传统硅胶基质混合型固相萃取吸附剂的局限性,采取了双重保留模式,即离子交换与反相保留,这种特性与MCX相似,但是两者相比较MCX对碱性化合物具有高的选择性和灵敏度,基质为聚苯乙烯-二乙烯基苯高聚物。

表3 不同萃取溶剂硝基咪唑类药物的回收率(n=6)
2.4 色谱条件优化
试验中首先采用了常用的乙腈-水溶液作为色谱的流动相,但结果表明硝基咪唑类化合物在C18色谱柱上峰形较差,拖尾严重,基线噪声较大;当在水相中加入了体积分数0.1%的甲酸后,甲硝唑、地美硝唑、左旋咪唑、洛硝达唑均在C18色谱柱上峰形较好,且基线噪声明显降低,甲酸的加入能够在一定程度上提高其在C18柱上的保留行为,因此试验选择0.1%甲酸水-乙腈为流动相。
2.5 方法的线性范围、相关系数、检出限、定量限
试验采用外标法定量,分别以各分析物的峰面积(y)和对应的浓度(x,μg/kg)进行线性回归计算,得到线性方程和相关系数。线性范围为0.25~10 μg/kg,甲硝唑、地美硝唑、左旋咪唑、洛硝达唑的相关系数R2均大于0.999,通过向阴性样品中添加标准品考察方法的检出限(S/N=3)、定量限(S/N=10);每个标准品的添加量为0.25,0.5和1.0 μg/kg 3个水平,测得甲硝唑、地美硝唑、左旋咪唑、洛硝达唑的检出限(LOD)分别为0.090,0.097,0.100和0.070 μ g/kg,定量限(LOQ)分别为0.147,0.188,0.062和0.285 μg/kg。检出限、定量限、线性相关系数、线性方程、回收率见表4。
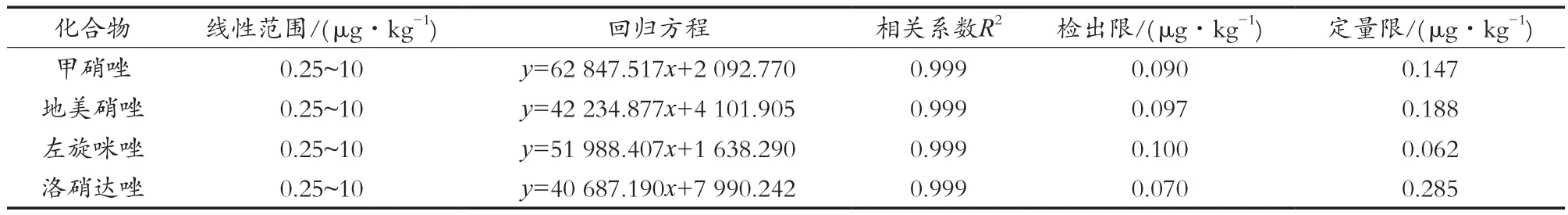
表4 硝基咪唑类的线性范围、回归方程、方法检出限和定量限
2.6 方法的回收率与精密度
取阴性样品,在0.25,0.5和1.0 μg/kg加标水平进行加标回收率和精密度试验,每个添加水平平行测定6次,结果见表5。在0.25,0.5和1.0 μg/kg加标水平下加标回收率分别为80.77%~109.73%,83.60%~102.70%,85.28%~112.2%和79.18%~120.02%,相对标准偏差分别为3.93%~10.99%,3.80%~6.89%,1.97%~9.81%和5.49%~15.46%,说明该方法的回收率与精密度较好。图4为阴性样品和在0.5 μg/kg加标水平下样品中甲硝唑、地美硝唑、左旋咪唑、洛硝达唑的MRM色谱图。

表5 甲硝唑、地美硝唑、左旋咪唑、洛硝达唑在阴性样品中的加标回收率和相对标准偏差(n=6)

图4 阴性样品和加标样品(加标量0.5 μg/kg)中甲硝唑(a、a+)、地美硝唑(b、b+)、左旋咪唑(c、c+)、洛硝达唑(d、d+)的MRM色谱图
3 结论
试验优化建立了鸡肉中硝基咪唑类残留量的高效液相色谱-串联质谱检测方法。该方法具有操作简单、重现性好、背景噪音低、具有较高的灵敏度和选择性等优点,可有效满足相关食品检测部门、食品企业等对鸡肉中硝基咪唑类残留的快速检测,为严格质量监控提供必要的技术支持。
