miR-491-5p参与调节人膀胱癌细胞系EJ对5-氟尿嘧啶的敏感性
2021-03-05仇国辉杨志玲
杨 锋,徐 佳,仇国辉,杨志玲
(湖南省人民医院 药学二部,湖南 长沙 410002)
膀胱癌(bladder cancer)一般采用根治术或局部切除术后辅以全身化疗的策略,但经此种方案治疗后,依然有大量膀胱癌患者在5年内复发[1]。造成这种现象的主要原因之一是膀胱癌化疗耐药性的产生而导致化疗药物不能彻底杀死残存的癌细胞[2]。目前,虽然对膀胱癌细胞的耐药表型相关的分子机制进行了大量研究,但化疗耐药的关键决定因素仍不完全清楚。5-氟尿嘧啶(5-fluorouracil,5-FU)是膀胱癌患者全身化疗的常用化疗药物之一[3]。因此,寻找潜在的能逆转5-FU耐药性的生物标志物和治疗方法能降低膀胱癌患者复发率。
一些miRNAs在肿瘤的生长、死亡、转移和化疗耐药中发挥重要的调控作用[4]。miR-491-5p在胃癌和结直肠癌等肿瘤中可作为抑癌因子[5-6],且有报道miR-491在胃癌和骨肉瘤中可抑制化疗多药耐药性[7-8]。但关于miR-491-5p在膀胱癌中对5-FU耐药的作用和机制尚未见报道。因此,本实验主要研究miR-491-5p在膀胱癌细胞中对5-FU的作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂: DMEM培养基和胎牛血清(fetal bovine serum,FBS)(Gibco公司);Trizol试剂和Lipofectamine 3000试剂(Thermo Fisher Scientific公司);CCK-8试剂盒、RIPA裂解液、Annexin V-FITC/PI试剂盒、β-actin抗体和HRP耦合的二抗(江苏碧云天研究所);5-FU粉剂(Sigma公司);miR-491-5p抑制剂、miR-491-5p模拟物和miR-NC质粒(上海吉凯基因公司合成);反转录试剂盒、SYBR Green荧光定量PCR试剂盒(大连宝生物工程有限公司);AKT、p-AKT、STAT3和p-STAT3抗体(Cell Signal Technology公司)。
1.1.2 细胞与组织: 人膀胱癌细胞系EJ(美国典型培养物保藏中心)。纳入30例行膀胱癌根治术前接受过以5-FU为基础的全身化疗方案的复发性膀胱癌患者,收集切除的膀胱癌组织,其中9例化疗敏感组织,21例化疗耐药组织。本研究经湖南省人民医院伦理委员会批准(伦理审批文号:hnkyll-lx-20180716),并取得所有涉及此项研究患者的知情同意。
1.2 方法
1.2.1 EJ/5-FU耐药细胞系的构建: 根据文献[9]方法稍作修改,以细胞系EJ为母本细胞,通过5-FU浓度递增反复刺激法,最终使细胞能在52 μmol/L 5-FU中稳定,获得5-FU耐药的EJ/5-FU细胞系。
1.2.2 细胞转染与分组: 按照说明书步骤,用Lipofectamine 3000试剂将miR-491-5p抑制剂或miR-NC转入细胞系EJ,将miR-491-5p模拟物或miR-NC转入EJ/5-FU细胞系。然后将细胞系EJ分为溶媒对照组、5-FU处理组、5-FU+miR-NC组和5-FU+miR-491-5p抑制剂组;将EJ/5-FU细胞系分为溶媒对照组、5-FU处理组、5-FU+miR-NC组和5-FU+miR-491-5p模拟物组。其中,5-FU的终浓度为52 μmol/L,溶媒对照为等体积的DMSO。
1.2.3 RT-qPCR检测miR-491-5p表达: 用Trizol试剂提取组织和细胞的总RNA,并用反转录试剂盒合成cDNA。以cDNA为模板并加入SYBR GreenⅠ和引物后,用ABI 7500型快速实时荧光定量PCR仪进行RT-qPCR反应。引物:U6上游引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′,U6下游引物:5′-CGCTTCACGAATTTGCGTGTCAT-3′;miR-491-5p上游引物:5′-ATCCAGTGCGTGTCGTG-3′,miR-491-5p下游引物:5′-TGCTAGTGGGGAACCCTTC-3′。U6为内参,用2-△△Ct法计算miR-491-5p的相对表达量。
1.2.4 CCK-8检测细胞生存率: 各组细胞分别接种于96孔培养板(1×104个/孔)中,继续培养24 h,按CCK-8试剂盒说明书检测各组细胞生存率。
1.2.5 Annexin/PI双染检测细胞凋亡: 各组细胞分别接种于6孔培养板(1×107个/孔)中,继续培养24 h,收集各组细胞,按annexin V-FITC/PI试剂盒说明书检测细胞凋亡情况。
1.2.6 Transwell小室法实验检测细胞迁移和侵袭: 分别取100 μL各组细胞的细胞悬液(1×106个/mL)接种Transwell上室(微孔滤膜用于检测细胞迁移;Matrigel包被的微孔滤膜用于检测细胞侵袭),取500 μL含20% FBS的DMEM培养基加入下室,继续培养24 h。用结晶紫染色穿透至上室下膜的细胞,并在显微镜下对细胞计数。
1.2.7 划痕实验检测细胞伤口愈合: 各组细胞分别接种于6孔板(1×107个/孔)中,当细胞增殖至汇合时,细胞行划痕处理后,继续培养24 h。显微镜下拍摄划痕后0和24 h划痕区的细胞图像,用Image J软件计算细胞愈合的面积。
1.2.8 Western blot检测蛋白表达: 用RIPA裂解液萃取细胞全蛋白后,用常规Western blot检测AKT、p-AKT、STAT3、p-STAT3蛋白的表达。上述蛋白的稀释比例为1∶1 000。以β-actin为内参,用Image J软件量化细胞的相对表达量。
1.3 统计学分析
2 结果
2.1 miR-491-5p在膀胱癌化疗耐药组织和EJ/5-FU细胞系中表达情况
与化疗敏感组织比较,miR-491-5p在膀胱癌耐药组织中表达水平显著下调(P<0.01)(图1A)。与细胞系EJ比较,miR-491-5p在EJ/5-FU细胞系中表达水平也显著下调(P<0.01)(图1B)。

A.expression levels of miR-491-5p in bladder cancer chemotherapy-sensitive (n=9) and resistant (n=21) tissues; *P<0.01 compared with sensitive tissues; B.expression levels of miR-491-5p in EJ and EJ/5-FU cell line; n=3; *P<0.01 compared with EJ cell line图1 miR-491-5p在膀胱癌化疗耐药组织和EJ/5-FU细胞系中表达情况Fig 1 Expression of miR-491-5p in bladder cancer chemo-therapy-resistant tissues and EJ/5-FU cell line
2.2 下调miR-491-5p表达降低细胞系EJ对5-FU的敏感性
miR-491-5p抑制剂转染细胞系EJ后,miR-491-5p表达显著降低(图2A)(P<0.01)。与溶媒对照组比较,5-FU处理组细胞系EJ活性(图2B)、细胞划痕愈合面积(图2E, F)、迁移细胞数(图2G, H)和迁移侵袭数(图2G, I)均显著降低(P<0.01),细胞凋亡率(图2C, D)显著增加(P<0.01);与5-FU处理组比较,5-FU+miR-491-5p抑制剂组细胞系EJ活性(图2B)、细胞划痕愈合面积(图2E, F)、迁移细胞数(图2G, H)和迁移侵袭数(图2G, I)均显著增加(P<0.05),细胞凋亡率(图2C, 2D)显著降低(P<0.05)。
2.3 上调miR-491-5p表达抑制EJ/5-FU细胞系对5-FU的耐药性
miR-491-5p模拟物转染EJ/5-FU细胞系后,miR-491-5p表达显著增加(图3A)(P<0.01)。与溶媒对照组比较,5-FU处理组细胞系EJ活性(图3B)、细胞凋亡率(图3C, D)、细胞划痕愈合面积(图3E,F)、迁移细胞数(图3G,H)和迁移侵袭数(图3G, I)无显著影响;与5-FU处理组比较,5-FU+miR-491-5p模拟物组细胞系EJ活性(图3B)、细胞划痕愈合面积(图3E, F)、迁移细胞数(图3G, H)和迁移侵袭数(图3G, I)均显著降低(P<0.01),细胞凋亡率(图3C, D)显著增加(P<0.01)。

A.after transfected miR-491-5p inhibitor into EJ cells, the expression levels of miR-491-5p was detected by RT-qPCR; B.cell viabilities of various groups were detected by CCK-8 assay; C,D.cell apoptosis of various groups were detected by annexin/PI staining; E,F.closed woud areas of various groups were detected by scratch assay; G-I.cell migration and invasion of various groups were detected by Transwell assay;scale bar=100 μm; *P<0.05, **P<0.01 compared with control group or vehicle group; #P<0.05 compared with 5-FU group
2.4 miR-491-5p对AKT及STAT3磷酸化水平的影响
与母本细胞系EJ比较,EJ/5-FU细胞系中p-AKT和p-STAT3表达水平均显著增加(P<0.01)(图4A~C)。在细胞系EJ中,与miR-NC处理组比较,miR-491-5p抑制剂组p-AKT和p-STAT3表达水平均显著增加(P<0.01)(图4D~F)。在EJ/5-FU细胞系中,与miR-NC处理组比较,miR-491-5p模拟物组p-AKT和p-STAT3表达水平均显著降低(P<0.01)(图4G~I)。
3 讨论
迄今已发现众多miRNAs参与调节肿瘤化疗敏感性[4]。其中,miR-491-5p的表达降低与肿瘤的化疗耐药性相关[7-8]。但在膀胱癌中,miR-491-5p对5-FU的影响和机制尚不清楚。本实验发现miR-491-5p在化疗耐药组织和EJ/5-FU细胞系中表达下调,提示miR-491-5p可能在膀胱癌细胞5-FU耐药过程中起着重要作用。为证明miR-491-5p参与调节膀胱癌5-FU敏感性的作用,本研究将miR-491-5p抑制剂转入细胞系EJ中,发现5-FU诱导的细胞凋亡减少和细胞活性增加;将miR-491-5p模拟物转入EJ/5-FU细胞系中,发现5-FU诱导的细胞凋亡增加和细胞活性降低,以上结果证明了miR-491-5p可调节膀胱癌细胞对5-FU的敏感性。
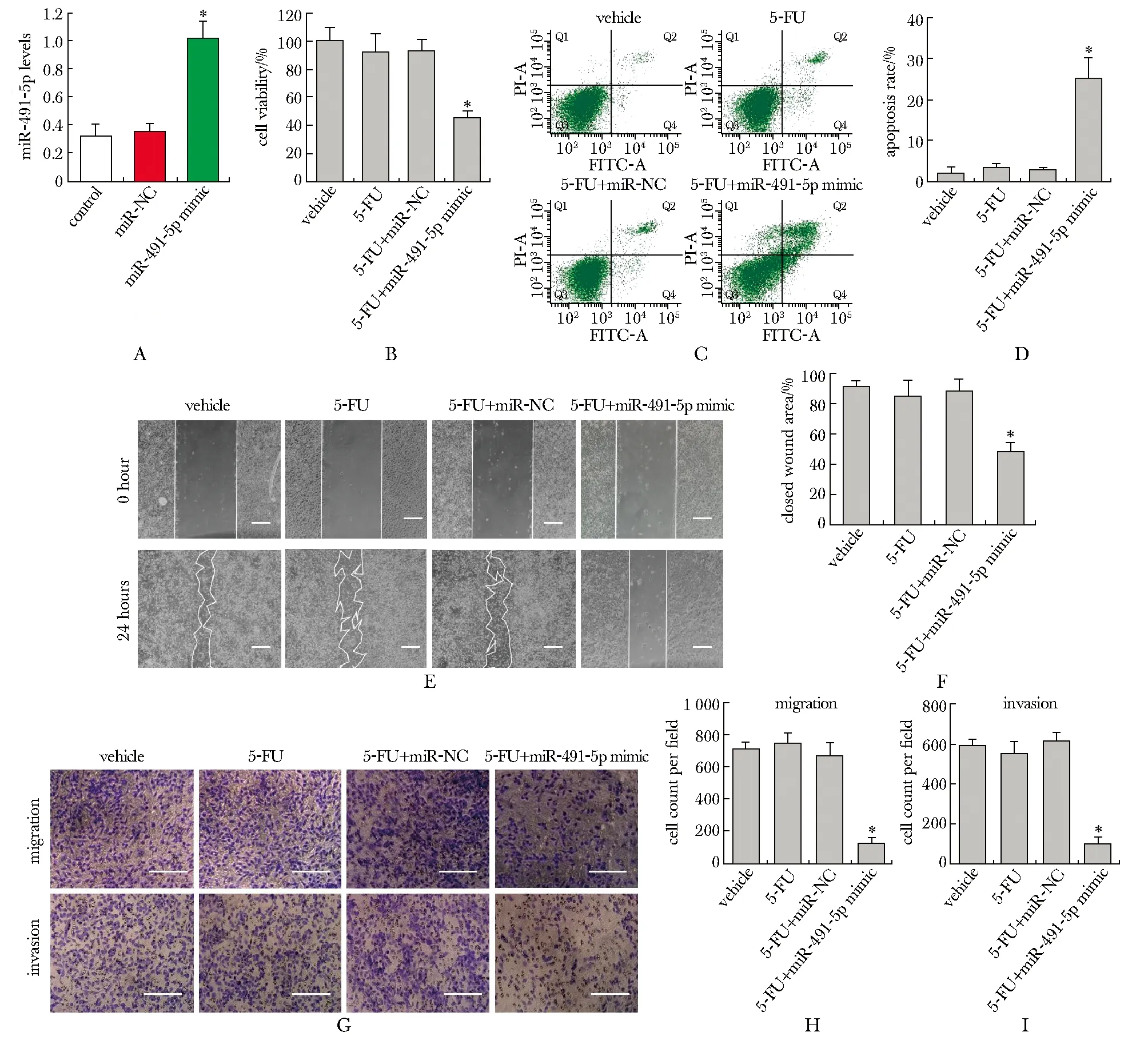
A.after transfected miR-491-5p mimic into EJ/5-FU cells, the expression level of miR-491-5p was detected by RT-qPCR; B.cell viabilities of various groups were detected by CCK-8 assay; C,D.cell apoptosis of various groups were detected by annexin/PI staining; E,F.closed woud areas of various groups were detected by scratch assay; G-I.cell migration and invasion of various groups were detected by Transwell assay;scale bar=100 μm; *P<0.01 compared with control group or vehicle group
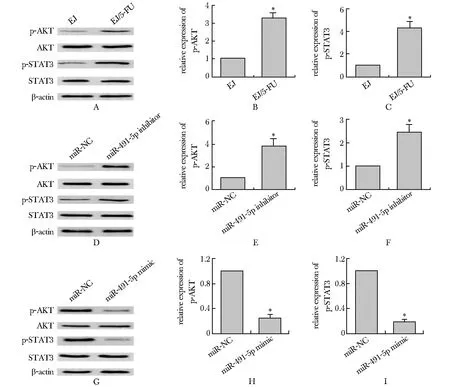
A-C.expression levels of p-AKT and p-STAT3 proteins in EJ and EJ/5-FU cell line were detected by Western blot; D-F.after transfection miR-491-5p inhibitor, the expression levels of p-AKT and p-STAT3 proteins in EJ cell line were detected by Western blot; G-I.after transfection miR-491-5p mimic, the expression levels of p-AKT and p-STAT3 proteins in EJ/5-FU cell line were detected by Western blot; *P<0.01 compared with miR-NC group
化疗后的肿瘤转移复发是肿瘤细胞获得性耐药引起化疗失败的主要体现之一[10]。化疗药物诱导获得的化疗耐药细胞的侵袭与迁移能力高于母本细胞[11-12],这表明肿瘤细胞化疗耐药性和肿瘤细胞迁移与侵袭能力具有密切的联系。因此,本研究进一步观察了miR-491-5p对5-FU诱导迁移与侵袭的影响,结果显示,在细胞系EJ中,敲减miR-491-5p导致5-FU对细胞系EJ迁移与侵袭的抑制能力减弱;在EJ/5-FU细胞系中,过表达miR-491-5p能增强5-FU抑制EJ/5-FU细胞系迁移与侵袭,这些结果体现miR-491-5p可调节5-FU诱导的膀胱癌细胞迁移与侵袭。
本研究进一步对miR-491-5p调节膀胱癌细胞耐5-FU机制进行了探索。在膀胱癌多药耐药细胞中AKT-STAT3信号活性增强,而AKT或STAT3抑制剂均能逆转膀胱癌多药耐药细胞的化疗耐药性[13-14]。本研究观察到在EJ/5-FU细胞系中p-AKT和p-STAT3表达高于母本细胞系EJ;而在miR-491-5p抑制剂转染的细胞系EJ中p-AKT和p-STAT3表达明显增加;miR-491-5p模拟物转染的EJ/5-FU细胞系中,p-AKT和p-STAT3表达明显降低。这些结果表明miR-491-5p可通过调节AKT-STAT3信号活性来达到调节膀胱癌细胞对5-FU的敏感性。
综上,本实验证明了miR-491-5p表达下调是膀胱癌细胞5-FU耐药的标志物,且miR-491-5p可通过抑制AKT-STAT3信号的激活来降低膀胱癌细胞对5-FU的敏感性。
