利用临床血常规标本富集血细胞在血液分析仪线性验证中的应用评价
2021-03-05王力阳振曦程焱崔巍
王力,阳振曦,程焱,崔巍
(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院检验科,北京100021)
随着ISO 15189医学实验室认可工作的不断推进以及实验室管理的逐步规范,验证血液分析仪的检测性能已基本成为临床实验室的常规工作之一。按照卫生行业标准WS/T 406—2012《临床血液学检验常规项目分析质量要求》的相关规定,需验证的项目应包括:本底计数、携带污染、精密度、正确度、线性、可比性等[1]。但是目前商品化的线性质控物较少且缺乏有效的购买渠道,大部分医院在短期内遇到涵盖所有项目的临床极端高值样品的可能性很小,所以如何及时有效地进行线性评价是目前血液分析仪性能验证工作中的一个难点[2]。为解决这一难题,现介绍一种可简单获得血液分析仪高浓度线性验证样品的方法供大家参考。
1 材料与方法
1.1主要仪器与试剂 XN-350血液分析仪及其配套试剂、校准品和质控品(日本Sysmex公司)。Heraeus Labofuge 400及Heraeus Multifuge 4 KR离心机(德国Thermo Scientific公司)。
1.2标本采集与处理 按照标准操作流程[3]采集新鲜全血标本,EDTA-K2抗凝,用于血常规检测,完成检测并留取备份后的剩余标本用于本实验研究。
1.3方法
1.3.1高浓度红细胞(RBC)、血红蛋白(Hb)和血细胞比容(HCT)样品的制备 选取当天同血型全血标本4份(RBC尽量>5.00×1012/L),混合成2份后用Heraeus Multifuge 4 KR离心机2 000 r/min离心3 min;用一次性塑料吸管去除大部分血浆后将剩余血细胞混合于1支试管中,获得约3 mL高浓度RBC、Hb和HCT样品。
1.3.2高浓度白细胞(WBC)和血小板(PLT)样品的制备 (1)选取当天全血标本(ABO血型可能不同,尽量选取WBC和PLT测定结果较高的标本,如WBC>15.00×109/L、PLT>250×109/L)40份,混合后倒入8支10 mL离心管中。(2)用Heraeus Labofuge 400离心机3 000 r/min离心10 min,用一次性塑料吸管尽量提取中间富含WBC和PLT的白膜层(提取时会混有一定量的血浆、红细胞)混合备用(约12 mL分装至4支EDTA-K2抗凝真空采血管内)。(3)摇匀后放入Heraeus Multifuge 4 KR离心机中,再次3 000 r/min离心5~10 min,用一次性塑料吸管再次尽量提取中间白膜层混合备用(约6 mL分装至2支EDTA-K2抗凝真空采血管内)。(4)重复步骤3,进一步富集WBC和PLT,提高其浓度,得到约3 mL高浓度WBC和PLT样品。
1.3.3线性验证样品的制备与检测 用XN-350血液分析仪配套稀释液[4]将上述高浓度血细胞样品分别按100%、80%、60%、40%、20%、10%、2%、0%的比例进行稀释,稀释好的样品放置滚轴混匀器上进行混匀备用。每个稀释度的样品重复测定3次。
1.4统计分析 依据行业标准WS/T 406—2012《临床血液学检验常规项目分析质量要求》,按照行业标准WS/T 408—2012《临床化学设备线性评价指南》的相关计算指标以及公式等采用R语言统计分析线性数据[5]。首先,采用格拉布斯(Grubbs)法进行离群值检验,剔除离群值。然后,对线性验证数据进行多项回归分析,确定最优拟合方程;如数据拟合结果为统计学标准的非线性,则需按照指南中的公式计算最优拟合曲线与直线的平均差异值(average deviation from linearity,ADL),并与临界值进行比较以判断是否为临床可接受的非线性。最后,按照指南中的公式计算数据的不精密度,与界值进行比较从而检验线性验证数据的精密度,以保证多项回归分析统计学的准确性。具体计算公式参照指南中相应内容以及相关文献资料[6]。
2 结果
2.1高浓度血细胞样品的制备 将富集的高浓度血细胞样品用Sysmex XN-350血液分析仪进行初步检测,RBC、Hb、HCT、WBC以及PLT的测定结果分别为8.34×1012/L、262 g/L、76.0%、293.00×109/L和2 387×109/L,达到预期要求。
2.2线性验证数据及多项回归分析结果 剔除离群值后对验证数据进行多项回归分析,各项目线性验证不同比例浓度样品的测定值与最优拟合值见表1。各项目线性验证数据的多项回归分析结果如图1所示,Hb与PLT为一阶线性,而RBC、HCT和WBC为二阶线性,R2均在0.95以上。

表1 各项目线性验证不同浓度样品的测定结果及最优拟合值
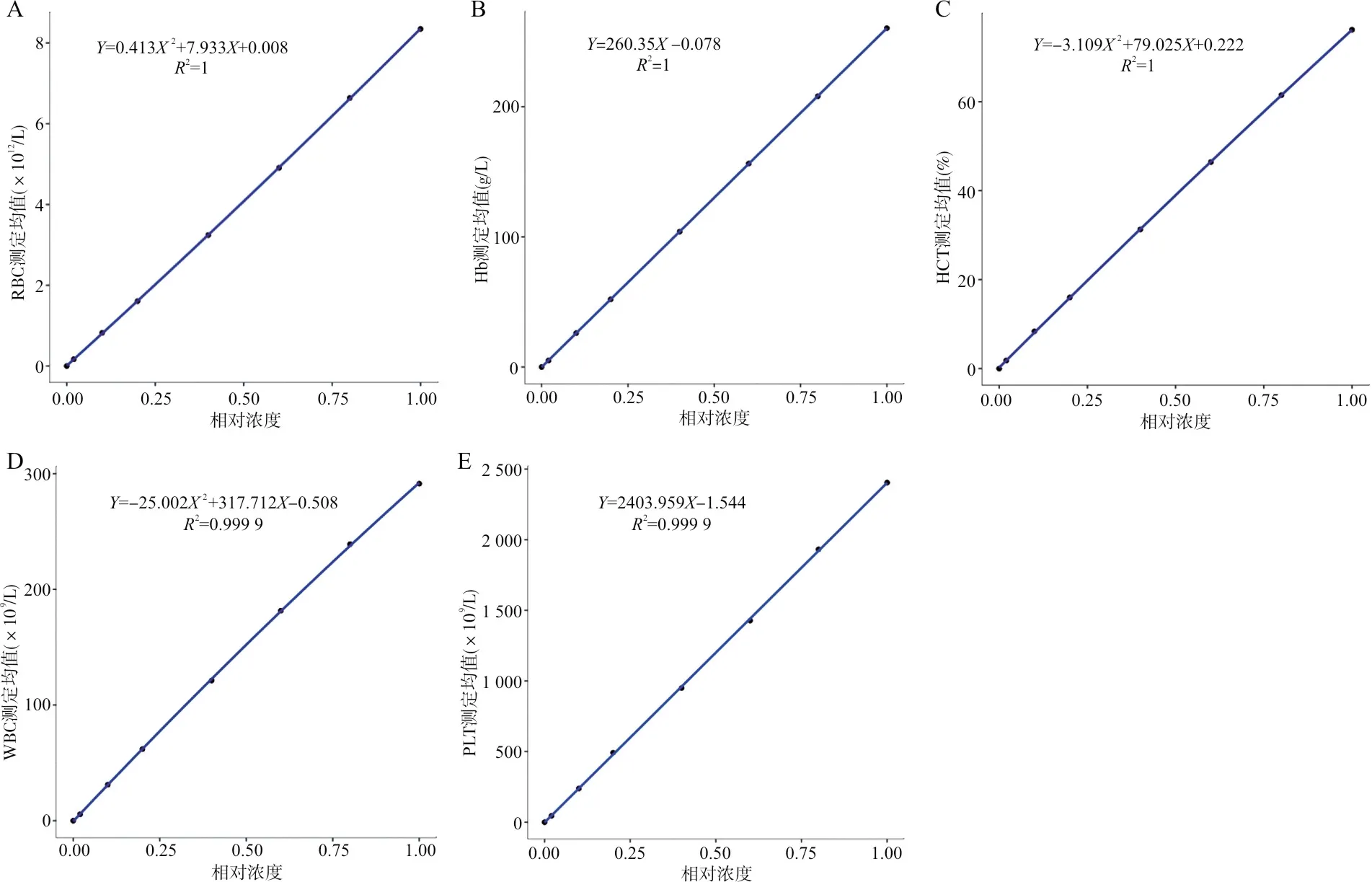
注:A~E分别为RBC、Hb、HCT、WBC和PLT线性多项回归分析结果。
2.3非线性程度判断及精密度评价 从图1中可看出RBC、HCT和WBC为统计学标准的非线性,需计算ADL值以判定是否为临床可接受的非线性。RBC、HCT和WBC的ADL计算值分别为1.19%、0.95%和1.99%,均小于临界值5.25%、5.28%和5.37%,为临床可接受的非线性。RBC、Hb、HCT、WBC以及PLT线性验证数据的不精密度评估值分别为0.73%、0.58%、0.84%、1.11%和1.39%,均小于判定界值9.76%,说明数据的精密度良好,满足线性验证数据多项回归分析的统计学要求。
2.4线性范围 各项目的实际验证线性范围与厂家声明的线性范围见表2。由于WBC和PLT样品制备浓度未达到厂家声明的线性上限,导致实际验证线性范围低于厂家声明的线性范围,但实际验证线性范围也基本可满足绝大部分临床标本的检测需求。
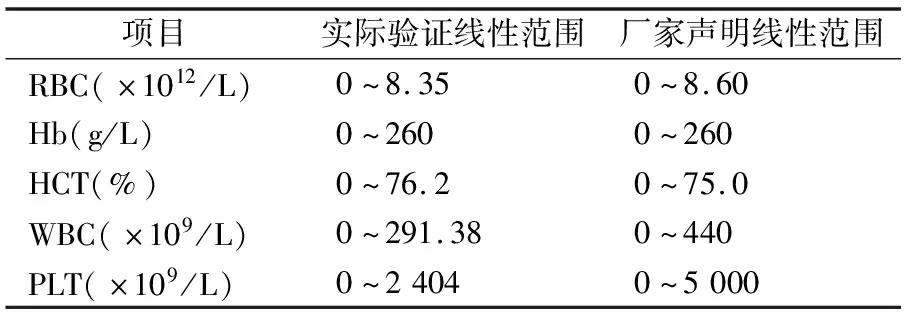
表2 各项目的实际验证线性范围与厂家声明线性范围
3 讨论
利用临床标本分离PLT和WBC在血液分析仪线性评价中的应用虽已有报道[7-9],但本研究的创新点在于:(1)富集方法简便、可操作性强,富集制备的样品项目齐全、浓度值较高,可满足大部分临床检测线性验证需求,并且一次富集可获得多个项目同时呈现高浓度值的样品,可在满足线性验证浓度要求的同时节约检测成本;(2)线性验证统计分析方法科学严谨,保证了线性验证结果的准确性。
高浓度RBC样品的制备相对简单,需要注意的是:因所需临床标本数量较少,推荐采用血型相同的临床标本;离心转速不需要过高、时间不宜过长,以免因离心力过大造成RBC的破损或因过度挤压不易混匀,从而影响RBC和HCT的检测结果。
制备高浓度WBC和PLT样品成功的关键点在于:(1)离心转速不易过低,以免离心后PLT处于血浆层而非中间白膜层,造成PLT的丢失;(2)提取中间白膜层时需操作熟练,减少WBC和PLT的丢失,从而提高富集的效率。虽然在选取临床标本时因所需标本量较多而未采用同型血相混且富集后的样品中仍含有一定量的RBC,但制备的样品并未看到RBC有明显的凝集或溶血现象。分析原因可能为:当多份不同血型血液混合时,血浆中存在的血型物质中和了部分血型抗体,从而抑制了血型抗体与红细胞之间的凝集反应[10]。
美国临床和实验室标准协会(CLSI)H26-A2及EP6-A文件推荐可采用自身无细胞血浆、磷酸缓冲盐溶液(PBS)或仪器厂商推荐的稀释液对高浓度样品进行稀释,来配制不同浓度水平的线性验证样品[11-12]。本研究采用厂商推荐的可用于仪器预稀释模式检测的配套稀释液对高浓度样品进行稀释,是否会造成高浓度样品与低浓度样品以及稀释后的线性验证样品与临床常规标本间基质的不同,产生基质效应从而对实验结果产生影响,还有待进一步的研究探讨。
本研究采用多项回归分析对线性验证数据进行统计分析,发现Hb与PLT为一阶线性,而RBC、HCT和WBC为临床可接受的非线性;线性评价数据的精密度均较好,可满足线性评价的要求。
