酶联适配体传感器比色检测牛奶中恩诺沙星残留
2021-03-05赵秋伶史雅静张振宇
赵秋伶, 史雅静, 张振宇
(1.辽宁科技学院生物医药与化学工程学院,辽宁本溪 117004;2.辽宁科技学院电气与信息工程学院,辽宁本溪 117004;3.辽宁工程技术大学矿业技术学院,辽宁葫芦岛 125105)
恩诺沙星(Enrofloxacin,ENRX)不仅可用于动物感染性疾病的治疗,而且可作为饲料添加剂促进动物生长[1,2]。ENRX的大量使用及滥用造成其在动物源性食品中残留,危害人体健康。ENRX的毒性反应主要体现在对胃、肠、肝、肾的损害,以及对神经系统的破坏,并有潜在的致癌作用,长期使用会产生耐药性[3,4]。欧盟2377/90号条例规定ENRX最大残留限量为30 μg/L,我国农业部颁布235号公告规定ENRX在肌肉和脂肪组织的最大残留限量为100 μg/L[5]。
免疫分析操作简单、快速、灵敏,适合批量样本快速筛查,在食品安全分析领域广泛应用[6]。但抗体易受外界条件影响,检测结果重现性差,制约了免疫分析的实际应用。核酸适配体是高亲和性和特异性结合靶标的寡核苷酸片段[7],具有容易标记和修饰、稳定性好、成本低等优点[8],能代替抗体发展免疫分析,为食品安全分析提供了新思路。已发展的适配体为依据的方法包括化学发光免疫分析[9,10]、荧光免疫分析[11,12]及酶联吸附免疫分析[13,14]等,检测机制可分为直接竞争型[9]、间接竞争型[13]、夹心型免疫分析[14]及新型检测机理的非竞争型免疫分析[10,12]。相比较而而言,非竞争型免疫分析更有优势,在灵敏度、精密度、动力学及工作曲线范围方面都优于竞争机制的免疫分析,操作步骤也更简单。
基于核酸适配体的免疫分析应用于小分子农兽药残留检测具有无可比拟的优势,但是核酸适配体在农兽药残留分析中的应用尚处于起步阶段,大部分农兽药分子尚无核酸适配体。在前期的研究中,本课题组成功筛选了ENRX的核酸适配体[15],本研究基于适配体结合域位于茎-环的特点,建立了基于外切核酸酶Ⅰ信号转导的酶联适配体免疫分析方法,检测牛奶中ENRX残留。该方法简单、快速、高效可靠,成本低廉,值得在食品安全的生产与监测中推广应用。
1 实验部分
1.1 仪器与试剂
Heal Force冷冻离心机(德国,Eppendorf公司);THZ-C台式恒温振荡器(江苏太仓华美生化仪器厂);YRE-201D旋转蒸发仪(上海玛尼仪器设备有限公司);UV-2550紫外-可见分光光度计(日本,岛津公司);Fluo View FV1000-IX81激光共聚焦显微镜(日本,Olympus公司);SpectraMax©Paradigm©多功能酶标仪(美国,Molecular Devices公司)。
恩诺沙星、环丙沙星、氧氟沙星、诺氟沙星、加替沙星、氯霉素、莱克多巴胺(分析纯,中国兽医药品监察所)。核酸外切酶Ⅰ(E.coliExonuclease I,Exo Ⅰ)购自大连宝生物工程有限公司;Anti-FITC-HRP购自美国Millipore公司;碳二亚胺盐酸盐(EDC·HCl)和N-羟基硫代琥珀酰亚胺(sulfo-NHS)购于美国Sigma公司;氨基活化的琼脂糖凝胶(EAH sepharose 4B)、链霉亲和素修饰的酶标板和四甲基联苯胺(TMB)底物显色液均购自美国Thermo Scientific公司;未经特殊说明,其它试剂均为分析纯。实验时所用的缓冲溶液:固定缓冲液PBS(0.1 mol/L,pH=7.4);洗涤缓冲液PBST(0.1 mol/L,pH=7.4,含2 mmol/L MgCl2和质量分数0.12% Tween 20);结合缓冲液(20 mmol/L Tris-HCl,100 mmol/L NaCl,2 mmol/L MgCl2,5 mmol/L的KCl,质量分数0.02%的Tween 20,1 mg/mL酵母tRNA,pH=7.6);偶联缓冲溶液(0.1 mol/L MES,pH=6.0)。实验中均使用超纯水(Milli-Q,18.2 MΩ·cm)制备样品。
实验所用到的寡核苷酸序列均由英潍捷基(上海)有限公司合成,其序列见表1。
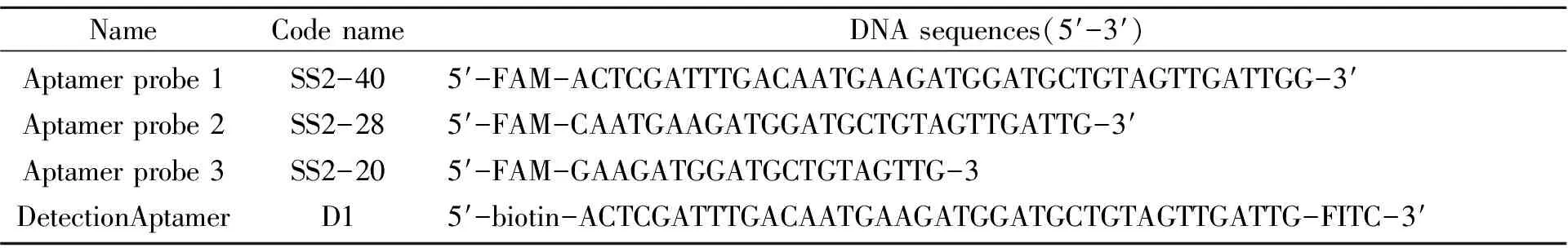
表1 实验中用到的寡核苷酸序列
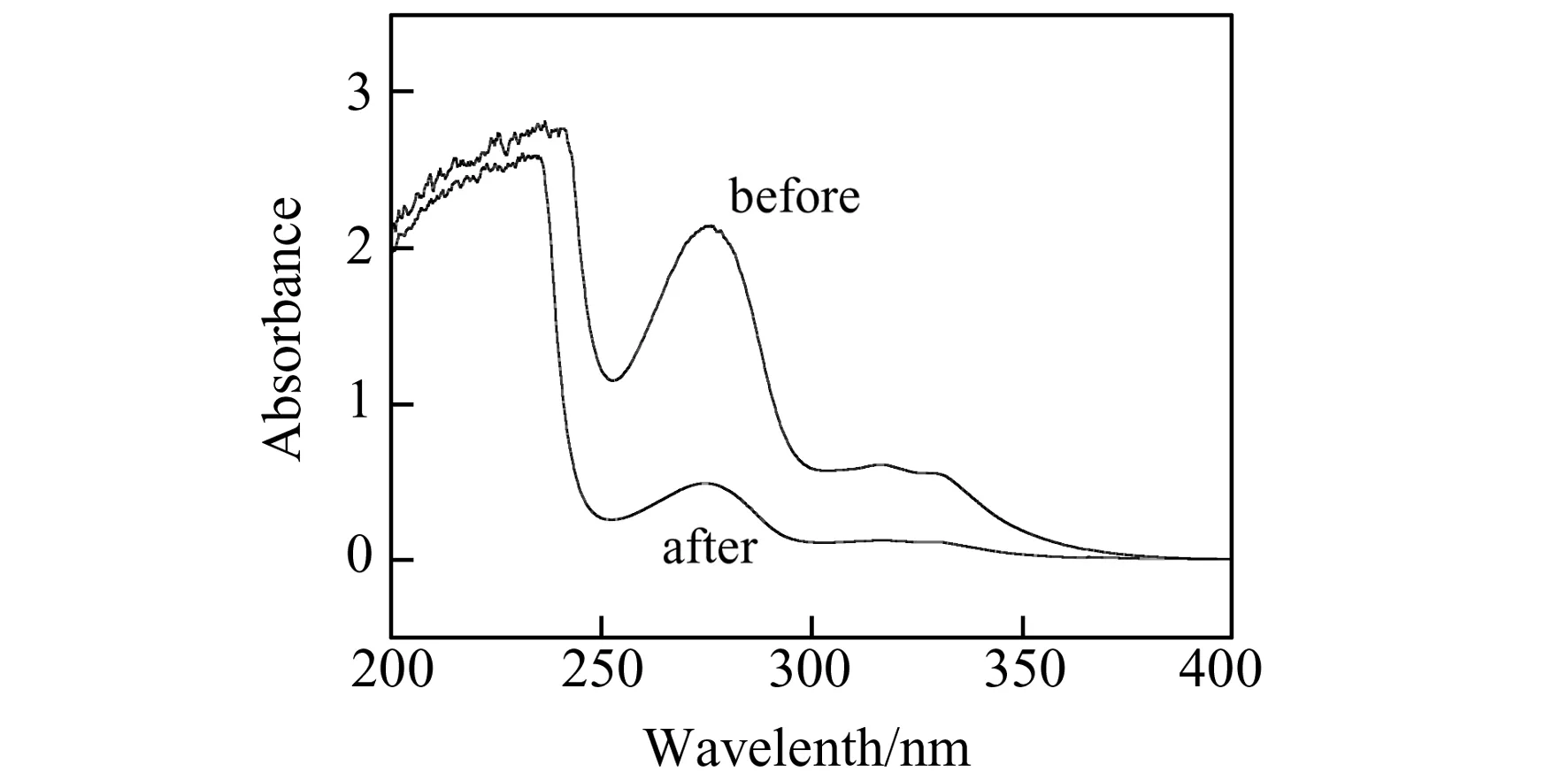
图1 恩诺沙星反应前后的紫外光谱Fig.1 The UV spectra before and after reaction of enrofloxacin
1.2 恩诺沙星与琼脂糖珠的偶联
10 mg ENRX溶于2 mL DMF,完全溶解后加入 2 mL 偶联缓冲液,混匀。分别加入30 mg sulfo-NHS和26 mg EDC·HCl,完全溶解后放置4 ℃摇床中反应15 min,得到羧基活化的ENRX溶液。2 mL氨基琼脂糖珠用偶联缓冲液洗涤3次后和上述活化溶液混合,置于摇床室温下反应2 h。反应完毕,琼脂糖珠用0.1 mol/L PBS(pH=7.4)洗涤5次,最后重悬于5 mL PBS中保存,待用。将反应前后的ENRX溶液稀释相同倍数,测量紫外吸收(图1),反应前后271 nm波长处吸收值明显下降,证明偶联成功。
1.3 激光共聚焦荧光成像
5′-FAM标记的适配体探针1、2、3用结合缓冲液配制成500 nmol/L,分别取200 μL加入到10 μL的ENRX修饰的琼脂糖珠中,室温下摇床反应50 min。反应完毕离心,弃去上清液,保留琼脂糖珠并洗涤3次(洗掉吸附的及弱结合的适配体探针)。将琼脂糖珠悬浮液滴于载玻片,做共聚焦荧光成像,检测仪器为Fluoview 500/IX71倒置共聚焦系统,用5 mW、543 nm的He-Ne激光作为激发FAM荧光染料的光源。拍照所用的是10×镜(PLAP060×03PH),数值孔径为1.4。
1.4 检测适配体D1的固定
实验在固定缓冲溶液PBS中进行,首先向PBS中加入D1,使得D1的浓度为200 nmol/L。链霉亲和素标记的酶标板用200 μL洗涤缓冲溶液洗涤3次,每次5 min。取100 μL 200 nmol/L的D1加入到酶标板各孔中,置于37 ℃ 摇床反应2 h。反应完毕,用200 μL洗涤缓冲液洗涤酶标板3次,每次5 min,以去除未反应的D1。D1的5′端有生物素标签,通过生物素和链霉亲和素的特异相互作用D1偶联到链霉亲和素标记的酶标板上。D1修饰的酶标板立即用于下步反应。
1.5 荧光对照实验
在上述D1修饰的酶标板孔中加入100 μL的ENRX溶液(对照组0、实验组5 μmol/L),室温下摇床反应30 min,接着在反应液中加入1.2 μL Exo Ⅰ(5 U/μL)和11 μL 10×Exo Ⅰ缓冲液,37 ℃摇床孵育30 min,反应完毕移出反应液至黑色酶标板孔中,测量荧光强度(激发波长488 nm)。
1.6 酶联适配体传感器检测ENRX步骤
取100 μL不同浓度的ENRX溶液加入到上述D1修饰的酶标板各孔中,室温摇床放置30 min,核酸适配体和ENRX充分反应。接着在反应液中加入1.2 μL Exo Ⅰ(5 U/μL)和11 μL 10×Exo Ⅰ缓冲液,于37 ℃孵育30 min,反应完毕弃去反应液,用200 μL洗涤缓冲液洗涤3次,每次5 min。未和ENRX结合的核酸适配体被Exo Ⅰ剪切变成单核苷酸,在洗涤时被除掉。接着在酶标板每孔中加100 μL按1∶5 000 稀释的带辣根过氧化物酶标签的FITC抗体(anti-FITC-HRP),37 ℃反应30 min,移去反应液,洗涤3次,未反应的anti-FITC-HRP在洗涤时被完全去除。最后每孔加入100 μL TMB-H2O2底物显色液,室温反应20 min,再加25 μL 2 mol/L H2SO4终止反应,反应液由蓝变黄,用酶标仪测量450 nm处吸光度,同时用相机拍照。
1.7 牛奶样品中恩诺沙星的检测
样品处理:吸取1 mL牛奶样品,置于30 mL离心管中,加入6 mL乙腈,用超纯水定容到10 mL。振荡20 min,以10 000 r/min离心10 min,取上层清液5 mL于烧瓶中,用旋转蒸发仪旋蒸至干,加入1 mL结合缓冲液复溶,待测。标准加入回收率测定:吸取牛奶样品3份,每份1 mL。置于3个30 mL离心管中,每管牛奶样品中分别添加25、50和100 ng的ENRX样品,充分振荡均匀,静置10 min。按照上述样品处理方法制备待测样品并检测,计算标准加入回收率和变异系数。
2 结果与讨论
2.1 核酸适配体结合域的鉴定

图2 核酸适配体SS2-40的二级结构及裁剪示意图(球表示氢键,碱基通过形成氢键互补配对)Fig.2 The secondary structure of aptamer SS2-40 and sketch map of tailoring(The balls represent hydrogen bonds by which bases pairing)
前期研究中,本课题组成功筛选出多条ENRX的核酸适配体,其中SS2-40亲和力较强(Kd=0.94 μmol/L),达到微摩尔级别[15]。后面实验欲用SS2-40作为分子探针实现ENRX的检测,首先需确定SS2-40的结合域,以便设计出最合理的检测策略。用核酸二级结构预测软件(Mfold软件)分析了SS2-40的二级结构,见图2。3′端形成茎-环:茎部4对碱基互补配对,环上20个碱基。适配体识别靶标时,很多采用茎-环的基元结构和靶标相互作用[16,17],受此启发对SS2-40适配体序列进行了裁剪处理,得到只含茎-环部位的SS2-28适配体序列。激光共聚焦荧光成像结果显示(图3):SS2-40裁成SS2-28后,琼脂糖珠的荧光亮度没有明显变化,说明裁掉的序列对结合影响不大。接着进一步裁剪,将SS2-28的茎裁掉变成SS2-20,结果显示琼脂糖珠的荧光强度变暗明显,说明只剩环序列时适配体结合能力很弱。综上结论:适配体的结合域主要分布在28碱基的茎-环部位。

图3 SS2-40及裁短序列和恩诺沙星修饰的琼脂糖珠作用后的共聚焦成像(图片放大尺寸比例相同)Fig.3 Confocal imaging of SS2-40 and its cut sequences after binding with enrofloxacin-functionalized agarose beads(The pictures have the same size enlargement ratio)
2.2 检测原理
实验用39碱基的适配体D1(SS2-40去掉3′端一个碱基,此末端碱基对结合无影响)作为识别探针,建立了外切核酸酶Ⅰ酶切信号转导的适配体比色分析传感器,检测原理如图4。D1上3′端异硫氰酸荧光素(FITC)标记,5′端生物素(biotin)标记。通过生物素和链霉亲和素的特异相互作用,D1固定到链霉亲和素标记的酶标板。加入ENRX,D1在ENRX的诱导下构象发生变化,两者特异性结合形成稳定的复合物。再加入外切核酸酶Ⅰ时D1不被剪切,即靶分子的加入保护适配体免遭酶切。D1上3′端的异硫氰酸荧光素能进一步捕获带辣根过氧化物酶标签的异硫氰酸荧光素抗体(anti-FITC-HRP),最终辣根过氧化物酶催化四甲基联苯胺(TMB)底物显蓝色,加酸终止反应,底物由蓝色变黄色;无ENRX时,外切核酸酶Ⅰ从3′端开始顺次水解D1上的各个碱基生成单核苷酸。异硫氰酸荧光素连在3′-端第一个碱基上,最先掉下来,链接辣根过氧化物酶的标签被切掉,传感器无现象。FITC为荧光素,但本检测中做链接标签,目的是链接辣根过氧化物酶,建立比色分析法,如有商业化的辣根过氧化物酶标记的DNA,链接标签可省去,操作步骤更简单、成本更低。外切核酸酶Ⅰ是单链特异性3′→5′核酸外切酶,对单链DNA的特异性非常高,但是不分解双链DNA[18]。D1结合ENRX后不被外切核酸酶Ⅰ水解,说明结合后的D1上3′端碱基配对存在,即以茎-环的二级结构和靶标结合。
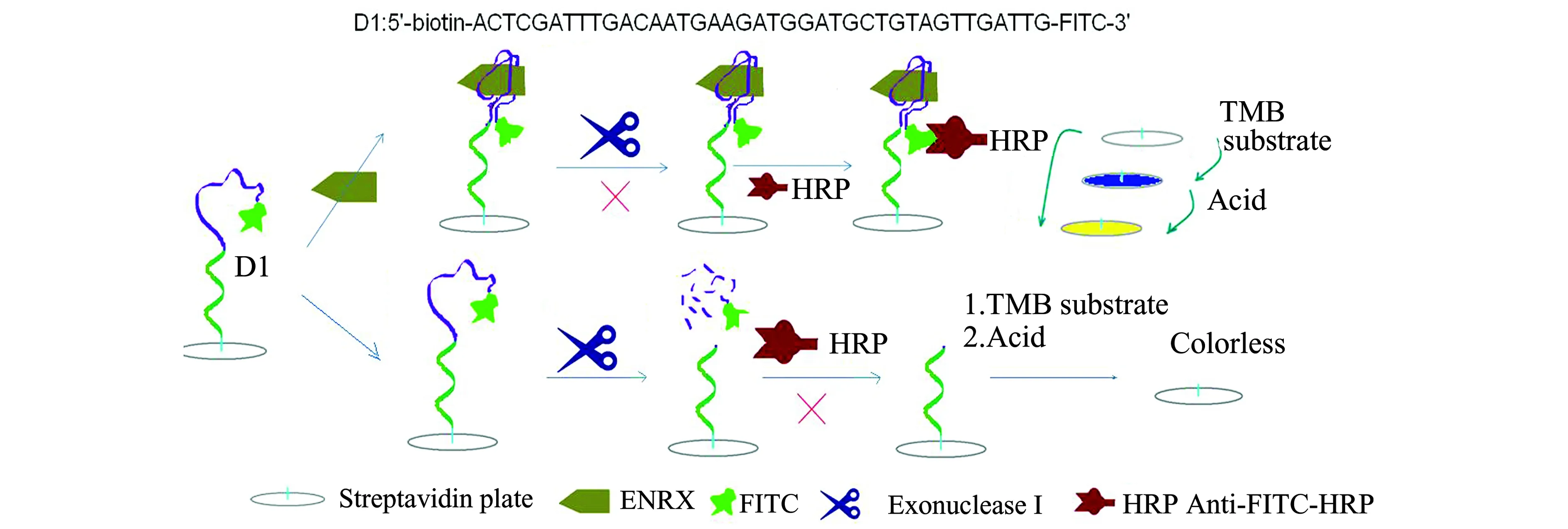
图4 核酸外切酶Ⅰ信号放大的核酸适体比色分析检测原理示意图Fig.4 Detection principle diagram of aptamer-based colorimetry with Exonuclease Ⅰ digestion signal amplification
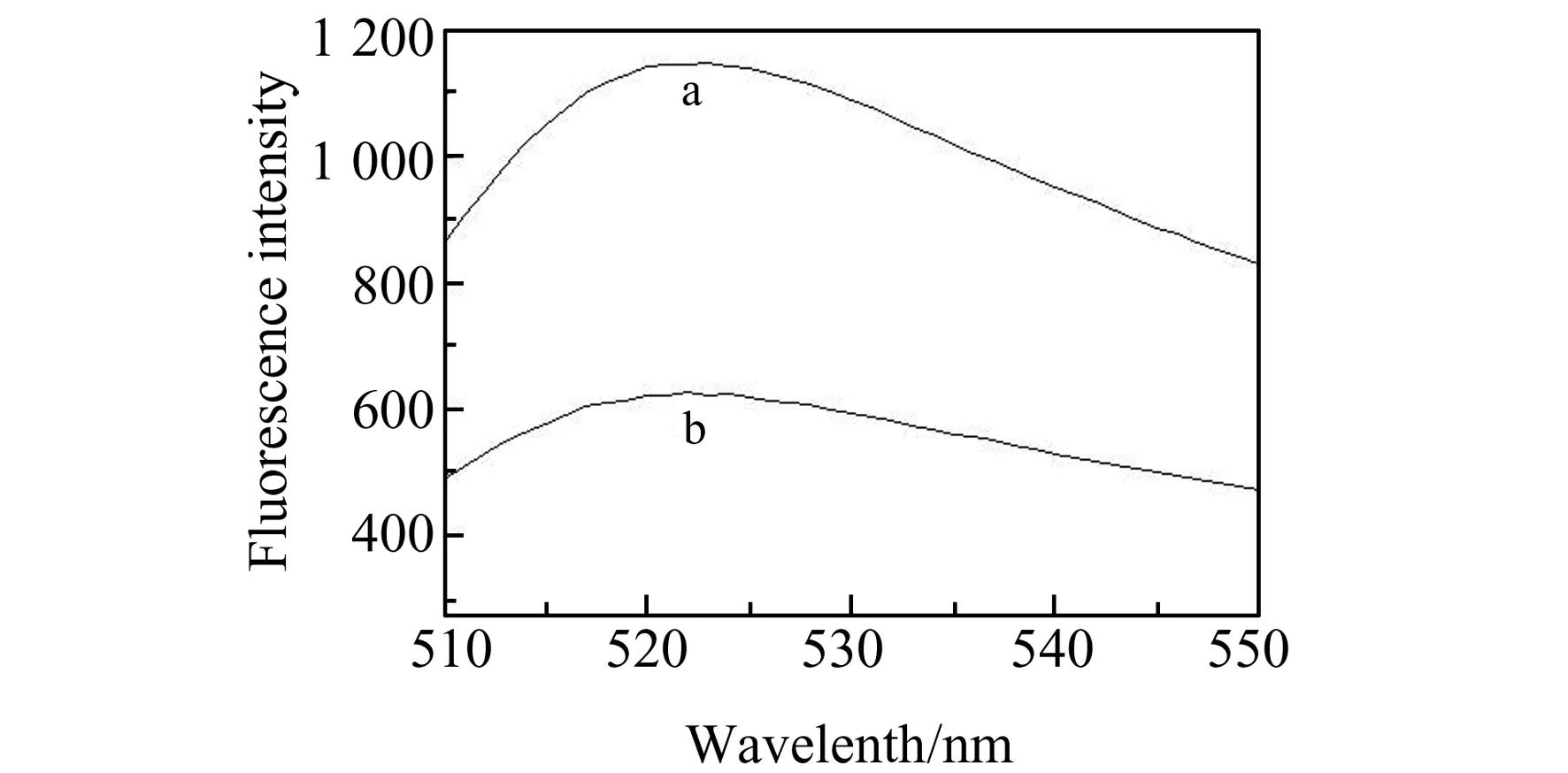
Fig.5 荧光对照实验结果Fig.5 The results of fluorescence control experiment(a) no ENRX;(b) 5 μmol/L ENRX.
荧光对照实验验证了方法的可行性,没和ENRX反应的核酸适配体被外切核酸酶Ⅰ水解,异硫氰酸荧光素进入液相,导致液相的荧光强度较高(图5曲线a),而和ENRX反应的核酸适配体不再被外切核酸酶Ⅰ水解,进入液相的异硫氰酸荧光素很少,液相荧光信号较弱(图5曲线b)。
2.3 检测结果和标准曲线
用建立的酶联适配体比色分析传感器检测不同浓度ENRX的结果见图6。由图6a可以看出,随着ENRX浓度的增加,溶液的颜色逐渐加深。从图6b可以看出,随着ENRX浓度的增加,450 mm处吸光度(A450)不断增大,开始时增加很快,后来趋于缓慢。在100~700 nmol/L(相当于36~254 μg/L)范围内,A450-A450(blank)与ENRX浓度呈良好的线性关系(图6c)。以信噪比大于3为可测信号标准,经实验得到的ENRX的检测限为52 nmol/L(相当于15 μg/L)。欧盟规定动物源性食品中ENRX最大残留限量为30 μg/kg,我国规定在动物源性食品中ENRX最高残留限量为100 μg/kg[5],所以设计方法的灵敏度能够满足我国的检测要求,也能满足欧盟的高标准检测要求。

图6 (a)检测不同浓度ENRX的照片;(b)450 nm的吸光度对ENRX浓度的关系曲线;(c)为(b)曲线中的线性部分Fig.6 (a) The photographs of detecting different concentrations of ENRX;(b) The relationship between the absorption of 450 nm and the concentration of ENRX;(c) The linear part of(b) curve
2.4 牛奶试样的测定
从超市采集了15个牛奶样本,用建立的适配体比色分析法检测牛奶样品中ENRX残留量,结果显示:15个牛奶样本里有6个检出有ENRX残留,残留量分别为129、43、78、96、104、152 μg/L。为了验证该方法的准确性,选择三个本底测定值为0的牛奶样本进行标准加入回收实验,每个样本选择3个添加浓度,取同一批次的D1包被板进行检测,计算批内变异;再取不同批次的D1包被板进行检测,计算批间变异。测得的回收率在93.5%~99.6%之间,批内变异系数为6.03%~8.12%,批间变异系数为7.31%~13.42%,见表2。方法准确度和精密度良好,能用于实际牛奶样品中ENRX残留的检测。

表2 牛奶样品添加回收实验(n=5)
2.5 特异性分析
考察了该方法对ENRX的特异性,一些结构相似或不相似的物质(环丙沙星、氧氟沙星、诺氟沙星、加替沙星、氯霉素、莱克多巴胺)被选作参照物。固定ENRX的浓度为1 μmol/L,参照物的浓度为10 μmol/L,用建立的方法检测。参照物测得的A450为P,ENRX测得的A450为N,比较P/N值。结果见表3。P/N值都小于3%,表明该方法对ENRX的检测具有较高的特异性。

表3 对照物的交叉反应实验(n=3)
3 结论
利用本课题组前期筛选的核酸适配体作为识别探针,建立了酶切信号转导的酶联适配体传感器,检测牛奶中恩诺沙星残留。该方法简便快捷、灵敏度高,适用于动物源性食品中恩诺沙星残留的快速筛查及现场实时检测。
