靶向重组Aif-T18融合蛋白对TEM1阳性肿瘤细胞的杀伤作用的研究
2021-03-05陈廷涛彭颖征
邓 侃,陈廷涛,彭颖征
靶向重组Aif-T18融合蛋白对TEM1阳性肿瘤细胞的杀伤作用的研究
邓 侃1,陈廷涛2,*彭颖征3
(1.吉安职业技术学院,江西,吉安 343000;2.南昌大学转化医学研究院,江西,南昌 330031;3.厦门大学附属第一医院病理科,福建,厦门 361003)
验证Aif-T18融合蛋白对肿瘤内皮细胞标志分子1(TEM1)阳性肿瘤细胞的杀伤作用。采用基因工程技术方法构建重组质粒pIRES-TEM1-EGFP,转染TEM1阴性表达细胞MS1,经G418筛选得到TEM1阳性细胞株(MS1-TEM1);通过构建重组质粒pET302-Aif和pET302-Aif-T18,转化至表达宿主菌中,经异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导菌体得到所需的目的蛋白,采用流式细胞仪和MTT技术检测融合蛋白对MS1和MS1-TEM1细胞的亲和力和特异性杀伤的效果。本研究中,主要利用单链抗体scFvT18选择性携带凋亡诱导因子AIF,靶向抑杀TEM1阳性细胞,从而为Aif-T18融合蛋白在肿瘤治疗中的开发应用提供实验依据。
TEM1;单链抗体;Aif
近年来,恶性肿瘤的发病率逐渐增高,严重威胁着人们的生命安全和健康[1]。由于肿瘤细胞的异质性和遗传不稳定性等特点[2],对于肿瘤的治疗难以达到预期的效果[3-4]。此外,肿瘤微环境包括肿瘤新生血管、血管周细胞、基质和间质细胞等为肿瘤细胞提供了生存和生长所需的营养及浸润途径,它能使肿瘤细胞逃避机体免疫系统的识别和抗原提呈,从而增加了机体杀伤肿瘤的难度。然而,与肿瘤细胞相比,这些构成肿瘤微环境的细胞具有遗传性质稳定和较低的突变率,又不同于其他正常组织细胞,它们是理想的肿瘤靶向目标。
最新的研究表明,TEM1可以在几乎所有实体瘤相关细胞中大量表达[5-6],但在正常细胞中不表达或者表达水平极低[7-8],它是一种理想的肿瘤靶向基因[9-10]。因此,本研究拟使用在前期研究中经酵母抗体库筛选分离获得可以同时结合人类与鼠类TEM1的高亲和力、特异性单链抗体(scFvT18),并携带全人源化生物毒素(如人源化毒素AIF),最终通过靶向杀伤TEM1阳性细胞达到抑杀肿瘤细胞的效果[11]。
1 材料和方法
1.1 实验材料
pMCV6-XL4载体、pGEM-3ZF(-)载体、pIRES-EGFP载体、pET302载体、MS1细胞株等由本实验室保存;重组质粒pET302-Aif-T18与pET302-Aif在南昌大学转化医学研究院实验室完成构建和实验。
1.2 试剂
T4 DNA连接酶、10 kb plus DNA ladder购自日本TaKaRa公司;限制性内切酶和购自美国NEB公司。Gel Extraction Kit、Plasmid Mini Kit I购自美国OMEGA公司;胎牛血清(FBS)购自美国Gibco公司;G418购自美国Invitrogen公司;一抗(兔His-Tag抗体)、二抗(鼠抗兔抗体)、台盼蓝、氨苄霉素(Amp)购自美国Sigma公司。
1.3 实验仪器
CO2培养箱(美国Thermo公司);倒置荧光显微镜(日本OLYMPUS公司);Biofuge Stratos台式高速冷冻离心机(美国Thermo公司);LEGEND Micro21R微量台式离心机(美国Thermo公司);PCR仪(美国Bio-Rad公司);SW-CJ-2FD型超净化工作台(苏州净化设备有限公司);流式细胞仪(德国MerckMillipore公司);DYY-2C琼脂糖凝胶电泳系统(北京六一仪器厂);WD-9403C型紫外分析仪(北京市六一仪器厂)。
1.2 实验方法
1.2.1 TEM1阳性肿瘤细胞系构建
pCMV6-XL4和pGEM® -3Zf(-)分别用1 μL与1 μL双酶切,50 μL总体系。酶切产物回收后电泳,将目的DNA进行回,酶连得到重组质粒pGEM® -3Zf(-)-TEM1,将其转化至top10后质粒提取,用、酶切pGEM® -3Zf(-)-TEM1与pIRES-EGFP,成功地构建了pIRES-TEM1-EGFP重组质粒。
从液氮迅速取出MS1细胞,置于37℃水浴,快速摇动,电转pIRES-TEM1-EGFP至MS1细胞,电压设置为1.8 KV,细胞在G418(100 mg/mL)的培养基中培养,用荧光显微镜观察其荧光表达,将这些细胞消化,以每孔100 μL加至96孔板生长,每3~4 d更换含G418培养基,密切关注细胞生长情况。当视野下70%~80%占据荧光细胞时,将其更换至24孔板进一步培养。用10% DMSO胎牛血清的将细胞低温保存于液氮罐。
1.2.2 Aif-T18融合蛋白的表达及纯化
IPTG诱导pET302-Aif-T18和pET302-Aif单克隆菌体获得包涵体,洗涤后,加至8M尿素溶解,终浓度30~50 mg/mL,室温下旋转4 h,13000 rpm 离心30 min,缓慢加入2M尿素,混匀,置于4℃条件下复性36~48 h后,离心,转速8000 rpm,与His beads按1:4混合,置于4℃旋转仪,4 h后,加入500 mM的咪唑洗脱蛋白,洗脱蛋白经PBS透析,Western Blot鉴定,一抗用封闭液按1:1000的比例稀释后在4℃摇床中缓慢摇动过夜进行回收。加TBS-T洗涤液,重复3次,时间15 min。二抗与封闭液按1:2500浓度稀释加入TBS-T洗涤液,重复3次,时间15 min。置于凝胶成像仪,显色。
1.2.3 重组Aif-T18融合蛋白对TEM1阳性肿瘤细胞的结合
吸出细胞上清,细胞用DHanks溶液冲洗,重复两遍,吸尽DHanks,加5 mL细胞培养液,置于细胞培养箱,吸出培养液,PBS洗涤2次,加10 mL versene溶液,放置约10~30 min,直至细胞变圆,用吸管吹打从而分离细胞,添加9 mL培养基(10%FBS)和等分试样的细胞成14管(1 mL/管)标记MS1 14管和MS1-TEM1 14管,离心,1200 rpm,4 ℃,5 min,将上清缓慢小心地吸出,加入100 uL培养基(10%FBS),冰上孵育30 min,洗涤3次,100 μL培养基重悬,添加抗His-Ab -APC,在冰上孵育30 min,如前面方法洗涤3次,300 μL FACS缓冲液悬浮细胞用,转移细胞进入FACS管用于FACS分析。
1.2.4 重组Aif-T18融合蛋白对TEM1阳性肿瘤细胞的杀伤效果
在显微镜下观察细胞生长状态,若细胞处于对数期,则进行细胞消化,以5×104/mL浓度接种于4块96孔板,(MS1细胞和MS1-TEM1细胞各两块),每孔200 μL。于5% CO2、37℃培养,每天间隔3~6 h光镜下观察加药(1μM)后MS1细胞和MS1-TEM1细胞细胞的凋亡情况,待发现有明显细胞皱缩甚至细胞小碎片出现后,终止培养,利用MTT法评价其细胞活性。
1.2.5 数据处理
数据均采用平均数±标准差( mean±SD) 表示,用 SPSS 13.0 软件分析,采用 Student-t 检验分析不同实验组间差异,<0.05 表示有统计学差异,<0.01 表示统计学显著差异。
2 结果与分析
2.1 TEM1阳性肿瘤细胞系构建
2.1.1 pCMV6-XL4与pGEM® -3Zf(-)酶切鉴定
从商品化的、包含TEM1全长序列的pCMV6-XL4(购自ORIGENE公司)利用和双酶切得到大约2600 bp的TEM1序列(条带1),并将其装入到同样经和双酶切的pGEM® -3Zf(-)质粒。
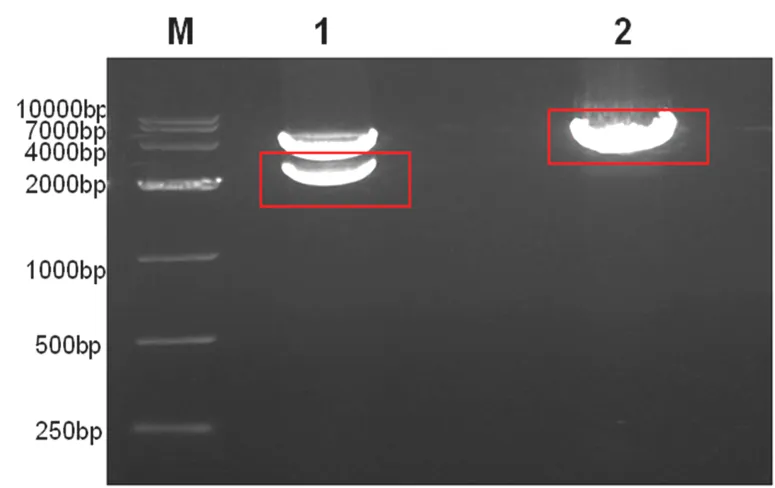
M:DL10000,1:酶切后的pCMV6-XL4,2:酶切后的pGEM® -3Zf(-)
2.1.2 pGEM-3ZF-TEM1与PIRES-EGFP酶切结果
重组质粒pGEM® -3Zf(-)-TEM1与质粒pIRES-EGFP分别经与酶切,电泳后分别获得5200 bp(泳道1)和2600 bp(泳道2)左右的目的条带(图2),测得浓度分别是38.9、42.1 ng/μL。

M:DL10000,1:酶切pGEM® -3Zf(-)-TEM1,2:酶切pIRES-EGFP
2.1.3 MS1-TEM1稳定细胞系的构建
重组质粒pIRES-TEM1-EGFP电转入MS1细胞。培养24 h,荧光显微镜下100倍与200倍视野观察具有荧光表达,细胞在白光下生长良好,表明转染成功,利用G418筛选获得MS1-TEM1稳定细胞系。

图3 荧光显微镜TEM1阳性细胞转染及验证
2.1.4 重组质粒转染MS1与MS1-TEM1细胞验证
将重组质粒pIRES-TEMI-EGFP分别转染MS1与MS1-TEM1,Western Blot验证TEM1阳性细胞具有目的蛋白TEM1表达,表明成功构建了MS1-TEM1细胞系(图4)。

1:MS1阴性对照 2:MS1-TEM1
2.2 Aif-T18融合蛋白以及Aif蛋白表达与纯化
将重组质粒pET302-Aif-T18以及pET302-Aif转化感受态细胞,过夜活化,次日加入200 mL LB培养液,37℃,加IPTG诱导4 h,超声破碎获得包涵体,经变性、复性得到可溶性活性蛋白。如图6A和6B所示,pET302-Aif约为70 kDa,pET302-Aif-T18约为100 kDa。而后纯化蛋白。获得纯度95%的Aif-T18(条带3)与Aif(条带1)如图5A所示,Western-Blot结果证实为目的蛋白如图5B所示。
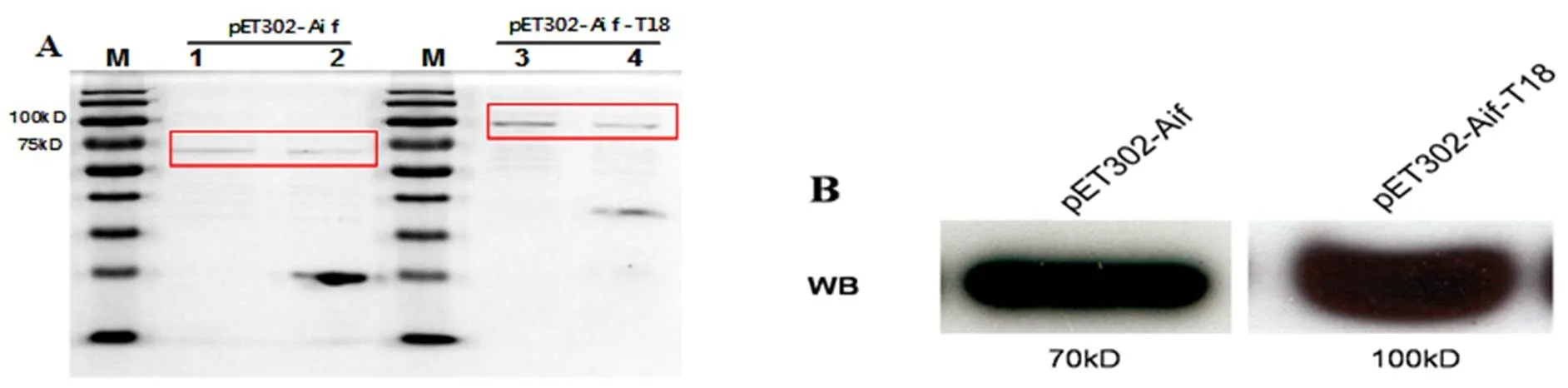
图A :M:Marker,1:纯化Aif, 2:未纯化Aif,3:纯化Aif-T18,4:未纯化Aif-T18。图B:Western Blot。一抗:His抗体二抗:羊抗鼠-HRP
2.3 Aif-T18融合蛋白以及Aif蛋白对细胞的结合
将Aif-T18与MS1、MS1-TEM1细胞共同培养,通过流式细胞仪检测目的蛋白与MS1-TEM1的结合能力。图6A表明Aif-T18与Aif对TEM1对MS1细胞没有结合能力;图6B标明Aif对MS1-TEM1细胞没有结合能力,但融合蛋白Aif-T18能较强的与MS1-TEM1结合,说明融合蛋白Aif-T18与MS1-TEM1细胞具有良好的特异性以及较强的结合能力。

图A:Aif-T18,Aif对MS1的结合能力,图B:Aif-T18,Aif对MS1-TEM1的结合能力
2.4 重组Aif-T18融合蛋白对TEM1阳性肿瘤细胞的杀伤效果
为进一步验证Aif-T18以及Aif对MS1与MS1-TEM1的杀伤能力。图7 A和图7 B显示,培养24 h,1 μM的Aif-T18和Aif对MS1与MS1- TEM1基本没有杀伤作用;此后,每天间隔3~6 h在光镜观察细胞形态出现显著皱缩甚至小碎片,终止培养,MTT评价细胞活性。如图7 C和7 D,72 h,Aif-T18与Aif都可明显杀伤MS1(<0.01)与MS1-TEM1。在MS1组,Aif-T18和Aif杀伤效果没有明显差别,而在MS1-TEM1组,Aif-T18对细胞杀伤作用明显高于Aif,表示AIF在体外杀伤效果明显,但融合蛋白的靶向作用效果显著高于AIF的细胞凋亡诱导率。
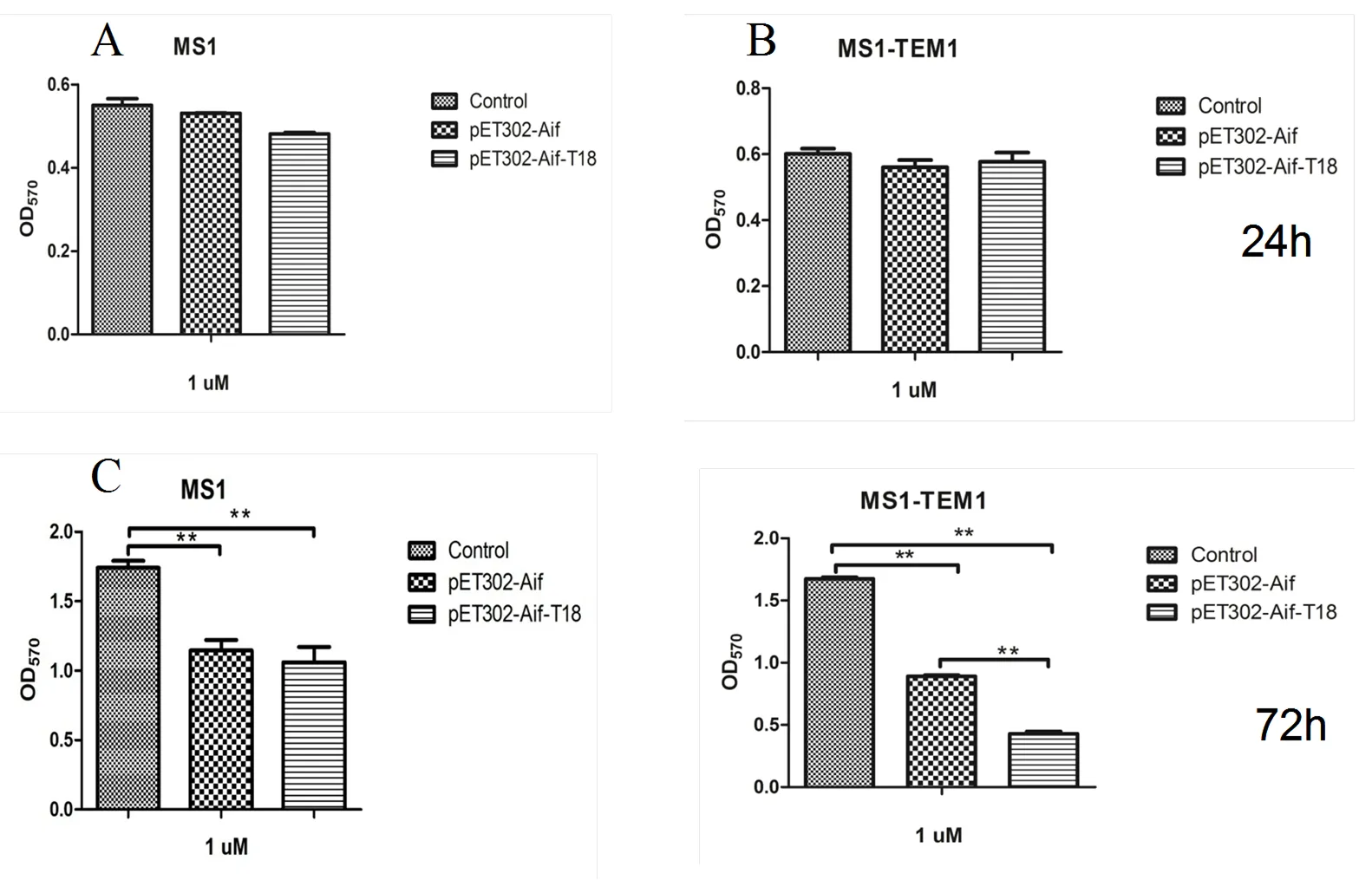
图A和B:24 h后Aif,Aif-T18对MS1与MS1-TEM1细胞的杀伤作用,图C和D:72 h后Aif,Aif-T18对MS1与MS1-TEM1细胞的杀伤作用(**:P < 0.01)
3 讨论
TEM1是一种细胞膜蛋白,主要在肿瘤内皮细胞以及部分肿瘤细胞中表达[12],因此可用于肿瘤靶向治疗。利用酵母菌展示技术,从人外周血细胞分离到单链抗体T18,且证明其能与TEM1蛋白高度结合[13-14]。因而利用T18携带的治疗性物人源化毒素AIF,可特异性地靶向遗传性状稳定的肿瘤细胞微环境。
TEM1用于肿瘤治疗的靶点具有重要意义。(1)TEM1主要与细胞外基质中的纤维连接蛋白、Ⅰ型胶原、Ⅳ型胶原相互作用,加速外周细胞的增殖,使其分泌能够降解血管外基质蛋白酶,有助于内皮细胞的迁移[15]。(2)在正常组织中血管生成基本不出现,因而靶向血管生成只针对肿瘤组织细胞,不会对正常组织细胞产生严重副作用[16]。(3)临床已经证明肿瘤的抗血管生成治疗具有良好的疗效和广谱的抗肿瘤作用[17]。
本研究中将人源化毒素(AIF)与单链抗体T18融合表达,结果表明重组蛋白AIF-T18能与TEM1阳性细胞系(MS1-TEM1)特异性地结合并对该细具有显著杀伤作用。此外,由于TEM1在实体瘤细胞中有特异性表达[18-19],因此,T18和毒素AIF的构建可以发挥更为特异的抗肿瘤作用,为肿瘤的治疗提供新的方向和思路。下一步将验证融合蛋白在人体内的作用效果。
[1] 杨潮,何小杨,莫淑芳,等.人WDR79基因启动子表达载体的构建及鉴定[J]. 井冈山大学学报:自然科学版,2019,40(3):31-34+55.
[2] 刘志强,王博龙.基于TCMSP抗肿瘤中药小分子EGFR-TKI的研究[J].井冈山大学学报:自然科学版, 2018,39(2):87-92.
[3] Yang H, Fang L, Zhan R, et al. Polo-like kinase 2 regulates angiogenic sprouting and blood vessel development [J]. Dev Biol, 2015, 404(2): 49-60.
[4] Ferrara N, Kerbel R S. Angiogenesis as a therapeutic target [J]. Nature, 2005, 438(7070): 967-74.
[5] Pietrzyk L. Biomarkers discovery for colorectal cancer: a review on tumor endothelialmarkers as perspective candidates[J]. Disease markers, 2016, 2016.
[6] Rak J, Al-Nedawi K, Meehan B, et al. Tumor cell-derived microvesicles: U.S.Patent 9,186,405[P]. 2015-11-17.
[7] Opavsky R, Haviernik P, Jurkovicova D, et al. Molecular Characterization of theMouseTem1/endosialin Gene Regulated by Cell Density in Vitro and Expressed in NormalTissues in Vivo[J]. Journal of Biological Chemistry, 2001, 276(42): 38795-38807.
[8] Teicher B A. CD248: A therapeutic target in cancer and fibrotic diseases[J]. Oncotarget, 2019,10(9): 993.
[9] O'leary A P, Fox J M, Pullar C E. Beta-Adrenoceptor Activation Reduces Both Dermal Microvascular Endothelial Cell Migration via a cAMP-Dependent Mechanism and Wound Angiogenesis [J]. J Cell Physiol, 2015, 230(2): 356-65.
[10] Fagiani E, Loentz P, Bill R, et al. VEGF receptor-2- specific signaling mediated by VEGF-E induces hemangioma-like lesions in normal and in malignant tissue [J]. Angiogenesis, 2016(35):1-20.
[11] 邓侃. Aif-T18融合蛋白对TEM1阳性细胞的体外杀伤效果评价[D].南昌:南昌大学,2016.
[12] Santoro S. T cells bearing a chimeric antigen receptor against the tumor vasculature destroy the tumor endothelium and result in tumor regression [J]. J cell physiol,2014,
[13] Yuan X, Chen X, Yang M, et al. Efficient construct of a large and functional scFv yeast display library derived from the ascites B cells of ovarian cancer patients by three-fragment transformation-associated recombina- tion[J]. Applied microbiology and biotechnology, 2016, 100(9): 4051-4061.
[14] Yuan X, Yang M, Chen X, et al. Characterization of the first fully human anti-TEM1 scFv in models of solid tumor imaging and immunotoxin-based therapy[J]. Cancer immunology, immunotherapy, 2017, 66(3): 367-378.
[15] Hong Y K, Lee Y C, Cheng T L, et al. Tumor Endothelial Marker 1 (TEM) Enhances Wound Healing by Interacting with Platelet-Derived Growth Factor Receptors[J]. Journal of Investigative Dermatology,2019, 139(10): 2204-2214.
[16] Shen J, Xiao Z, Zhao Q, et al. Anti‐cancer therapy with TNF α and IFN γ: Acomprehensive review[J]. Cell proliferation, 2018, 51(4): e12441.
[17] Abdalla A M E, Xiao L, Ullah M W, et al. Current challenges of cancer anti-angiogenic therapy and the promise of nanotherapeutics[J]. Theranostics, 2018, 8(2): 533.
[18] Yuan X, Yang M, Chen X, et al. Correction to: Characterization of the first fully human anti-TEM1scFv in models of solid tumor imaging and immunotoxin- based therapy[J]. Cancer Immunology, Immunotherapy, 2018, 67(2): 329-339.
[19] Wang Z, Tang Y, Tan Y, et al. Cancer-associated fibroblasts in radiotherapy: challenges and new opportunities[J]. Cell Communication and Signaling, 2019, 17(1): 47.
EVALUATION OF KILLING EFFECT OF AIF-T18 FUSION PROTEIN ON TEM1 POSITIVE CANCER CELLS
DENG Kan1, CHEN Ting-tao2,*PENG Ying-zheng3
(1. Vocational College of Ji’an, Ji’an, Jiangxi 343000, China; 2. Institute of Translational Medicine, Nanchang University, Nanchang, Jiangxi 330031, China; 3. Department of Pathology, The First Affiliated Hospital of Xiamen University, Xiamen, Fujian 361003, China)
To verify the killing effect of Aif-T18 fusion protein on tumor endothelial cell marker molecule 1 (TEM1) positive tumor cells, genetic engineering technology was used to construct the recombinant plasmid pIRES-TEM1-EGFP, transfected with TEM1-negative expression cell MS1, and screened by G418 to obtain TEM1-positive cell lines (MS1-TEM1). The recombinant plasmids pET302-Aif and pET302-Aif-T18, transformed into the expression host strain BL21, and the target protein was induced by bacterial cells induced by isopropyl-β-D-thiogalactopyranoside (IPTG). The affinity and specific killing effect of the fusion protein on MS1 and MS1-TEM1 cells were detected by flow cytometry and MTT. In this study, the single-chain antibody scFvT18 was used to carry the apoptosis-inducing factor AIF selectively and target and suppress TEM1-positive cells, thereby providing an experimental basis for the development and application of Aif-T18 fusion protein in tumor therapy.
TEM1; single chain antibody; Aif
R73-3
A
10.3969/j.issn.1674-8085.2021.01.008
1674-8085(2021)01-0043-06
2020-10-22;
2020-12-02
国家自然科学基金项目( 31360377);江西省教育厅青年科学基金项目(GJJ14197,GJJ14218)
邓 侃(1990-),男,江西吉安人,助教,硕士,主要从事单克隆抗体研究(E-mail: dengkan199006@ 126.com);
陈廷涛(1984-),男,江西南昌人,副教授,博士,主要从事微生物研究(E-mail:695237096@qq.com);
*彭颖征(1989-),男,江西樟树人,技师,主要从事分子病理研究(E-mail:1067716910@qq.com).
