结肠直肠癌腹膜转移防治临床研究
2021-03-05关天培雷子颖崔书中
关天培,雷子颖,崔书中
(广州医科大学附属肿瘤医院胃肠外科二区,广东 广州 510095)
结肠直肠癌(colorectal cancer,CRC)是世界范围常见的消化系统恶性肿瘤,其发病率居恶性肿瘤第4位,死亡率居第2位[1]。2015年,国内CRC发病 37.6 万例,死亡 19.1 万例[2]。CRC 腹膜转移发生率仅次于肝转移和肺转移,但预后最差,是导致病人死亡的主要原因之一[3]。约7%CRC病人在初次手术时出现同时性腹膜种植转移。CRC初诊时腹膜播散率达10%~15%,而20%~25%的病人在根治术后随访出现异时性腹膜转移[4-6]。研究显示,Ⅱ~Ⅲ期CRC病人根治术后3年腹膜转移率约13.2%,其中pT4期病人腹膜转移发生率高达36.7%[4]。既往认为,腹膜转移是癌症晚期或终末期表现,常伴有肠梗阻、恶性腹水等严重并发症,往往采取非手术治疗。即使外科干预,也仅行姑息性减症手术,是临床肿瘤治疗的难点。近年,随着癌症研究的深入及治疗技术的进步,国际肿瘤学界对腹膜转移的认识已发生转变[7],认为是可治疗的局部区域性播散,而非广泛性转移,部分病人积极治疗后可明显改善预后。该认识的转变与腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)技术的发展密不可分。
HIPEC技术通过热疗、化疗、热化疗协同作用和机械冲刷的综合作用,有效清除游离癌细胞和微小癌结节,为腹膜转移防治提供有效的治疗手段。在腹膜假性黏液瘤[8]、卵巢癌[9-10]、胃癌[11]、CRC[6]等腹部肿瘤中,HIPEC临床应用广泛,尤其在卵巢癌领域,已被NCCN指南推荐[12]。
HIPEC治疗CRC腹膜转移的价值
在CRC腹膜转移防治方面,多项研究证实肿瘤细胞减灭术(cytoreductive surgery,CRS)+HIPEC显著延长伴腹膜转移CRC病人生存期(见表1)。然而,2018年美国临床肿瘤学会 (American Society of Clinical Oncology,ASCO)年会公布的PRODIGE 7研究[17]和2020年Lancet Oncol发表的前瞻性多中心随机对照临床研究PRODIGE 15[18]结果均为阴性。Nagourney等[19]通过类器官(体外培养人体肿瘤组织,形成含肿瘤细胞、免疫细胞、间质细胞等三维结构,更好地模拟肿瘤环境)分析PRODIGE 7研究中87例结肠癌病人肿瘤细胞50%致死浓度的变化(其中33例接受FOLFOX或CAPOX新辅助化疗)。结果发现接受新辅助化疗病人肿瘤细胞OXA 50%致死浓度显著高于未接受新辅助化疗者(P=0.002),且氟尿嘧啶 50%致死浓度也不同程度升高,这可能掩盖HIPEC的实际疗效。提示对于已接受新辅助化疗的病人,应注意HIPEC药物的选择,尤其是早期开始HIPEC治疗,从而避免由化疗药物导致耐药。
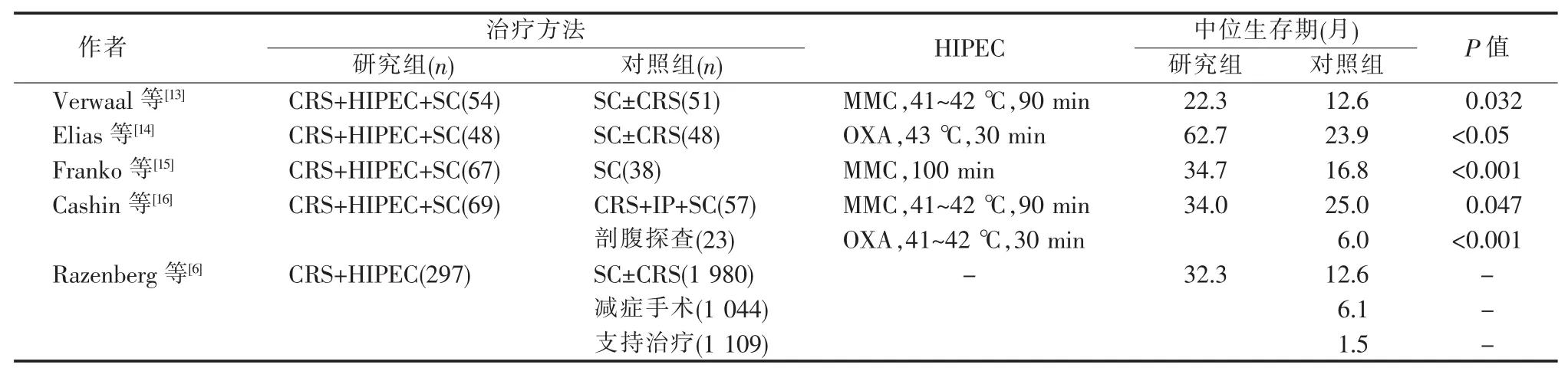
表1 CRC腹膜转移病人生存期
PRODIGE 15研究[18]中,所有病人完成6个月辅助化疗(主要为FOLFOX4或XELOX方案),无复发征象(基于CT检查或肿瘤标志物)的150例CRC病人随机分为观察组和HIPEC组,各75例。HIPEC组接受二次手术探查和HIPEC治疗,观察组不做任何干预。结果显示,观察组3年和5年无病生存(disease-free survival,DFS)率分别为53%和49%,HIPEC组分别为44%和42%,差异均无统计学意义。值得注意的是,该研究HIPEC组有4例拒绝二次探查,1例存在麻醉禁忌证,4例在二次探查时已有大面积腹膜受累而无法完全切除,实际接受HIPEC 治疗的仅 67例(38例 OXA 460 mg/m2,21例OXA 300~360 mg/m2+伊立替康 200 mg/m2,8 例MMC 35 mg/m2)。笔者认为,PRODIGE 15 得出阴性结果的主要原因如下:①HIPEC组接受治疗的67例中,59例用OXA作为HIPEC药物,选择OXA可能会与PRODIGE 7一样存在耐药问题,严重影响HIPEC实际疗效。②HIPEC组18例肺转移,而对照组仅7例,HIPEC组肺转移率显著高于对照组。研究显示RAS、EGFR、MET等基因突变与肺转移显著相关[20-21],但并未显示相关信息。③HIPEC方案为1次30 min,而在中国、美国以及欧洲既往的研究,除用 OXA外,治疗时间多为 60~90 min。④HIPEC组需接受二次手术探查和额外的HIPEC治疗,可能增加腹膜转移假阳性率。
预防性HIPEC,国内往往要求在根治术后1周内完成HIPEC治疗,术后6个月无明显复发征象行二次腹腔探查。在伦理学、病人依从性等方面面临很大困难,临床操作性较低,对国内临床实践指导意义值得商榷。
HIPEC预防CRC腹膜转移的价值
目前HIPEC在CRC根治术后预防腹膜转移研究有限。2014年,意大利罗马大学发表的一项回顾性结合前瞻性配对研究显示,伴有腹膜转移高危因素(T3/4、黏液腺癌/印戒细胞癌)的局部进展期CRC病人,接受根治性手术联合辅助性HIPEC治疗后4年内发生腹膜转移的风险是4%,而未行HIPEC者高达28%,提示HIPEC显著降低CRC病人根治术后腹膜转移风险[22]。然而,2019年,荷兰COLOPEC研究显示,CRC根治术后预防性HIPEC治疗不能显著降低高危腹膜转移病人18个月腹膜转移率[23]。笔者针对该研究详细解读,认为其存在诸多缺陷。主要包括如下:研究组约50%病人在HIPEC治疗前就已发现腹膜转移,实际上并未接受HIPEC治疗,统计分析时低估HIPEC疗效;根治术后5~8周二次手术才行HIPEC治疗,未考虑残留癌细胞增殖动力学特征[24]。同时,未考虑术后化疗开始时间对疗效的潜在影响等[25]。
国内、外HIPEC技术差异与中国HIPEC标准化
目前尽管国内、外HIPEC都称为HIPEC技术,实际上存在较大技术差异。因此,国外的CRC+HIPEC研究结果可能并不完全适合我国的CRC病人,对我国开展CRC腹膜转移防治的指导意义甚微。首先,我国HIPEC治疗充分考虑肿瘤细胞增殖动力学特征,术后即刻开始。一般在术后1周内完成,而国外术后5~8周或术后6个月完成辅助化疗再行二次手术HIPEC治疗。国内、外医疗环境和文化有较大差异。国内病人手术二次探查进行HIPEC难以开展。其次,以欧美国家为代表的腹膜表面肿瘤国际协作组推荐的是大剂量单药单次(主要是OXA 360~460 mg/m2或 MMC 30~50 mg/m2)、 开放式(30~40 min)或闭合式(60~90 min)和治疗温度差别大(41℃~43℃)的HIPEC技术标准[26]。国内精准HIPEC治疗标准[28]除考虑治疗药物(参考静脉化疗)、治疗温度(43 ℃±0.1 ℃)、治疗时间(60~90 min)、灌注容量(4~6 L)、灌注速率(400~600 mL/min)、灌注次数(预防性1~2次、治疗性3~5次)外,同时关注残留癌细胞增殖动力学特征和术后腹腔粘连形成,要求术后尽早完成HIPEC治疗,达到早期、全面杀伤肿瘤细胞的目的。基于此,国内学者早在2016年已就我国HIPEC技术标准达成共识,发布《腹腔热灌注化疗技术临床应用专家共识(2016版)》[27],首次提出“HIPEC+”的治疗模式。最新版2019年 《中国腹腔热灌注化疗技术临床应用专家共识》中,在精准HIPEC的基础上进一步细化,提出中国HIPEC治疗(China HIPEC,C-HIPEC)的概念和4个治疗模式(预防、治疗、转化和综合模式),明确针对不同疾病、不同分期和不同阶段应采取不同的HIPEC策略[28]。因此,需严格设计的大样本随机对照试验来证实C-HIPEC治疗模式防治CRC腹膜转移的真实价值。
总结与展望
HIPEC在防治CRC腹膜转移中的作用尚有争议。国外研究设计存在一定缺陷,特别是HIPEC方案与国内差异很大,可能无法揭示HIPEC治疗的实际价值。为解决上述临床研究结果无法证实的问题,国内正在开展多个随机对照试验,如笔者联合国内35所三甲医院正在开展的HIPEC-06研究(NCT04370925)、复旦大学附属肿瘤医院蔡国响开展的APEC研究(NCT02965248)等。期待这些研究在不久的将来为明确HIPEC在CRC腹膜转移防治中的确切疗效提供高质量的临床证据。期望国内同道积极探索中国精准HIPEC技术的临床应用,不断开拓HIPEC研究的深度与广度,争取早日得出系统化的研究成果。
