白蜡多年卧孔菌多糖提取工艺优化及其抗氧化活性
2021-03-04谢文凯余传东陈怀中尚浩乐杨柳杰谢朝晖
鲁 铁,李 登,谢文凯,余传东,陈怀中,3,尚浩乐,杨柳杰,刘 宇,谢朝晖*
(1.河南城建学院生命科学与工程学院,河南 平顶山 467036;2.鲁东大学农学院,山东 烟台 264025;3.暨南大学生命科学技术学院,广东 广州 510632)
白蜡多年卧孔菌(Perenniporia fraxinea)隶属于担子菌门(Basidiomycets),蘑菇纲(Agaricomycetes),多孔菌目(Polyporales),多孔菌科(Polyporaceae),多年卧孔菌属(Perenniporia)[1-3]。其菌丝体是由丝状真菌菌丝连结在一起组成的营养体类型;子实体是其产孢构造,由已组织化的菌丝体组成。目前主要分布于我国安徽、北京、福建、广东、江苏、江西、四川、云南、浙江等地。白蜡多年卧孔菌作为一种常见的白色真菌,是重要的生物资源,其多糖提取物可通过激活机体的免疫系统达到抑制肿瘤、抗氧化活性的目的[4-5]。
真菌多糖提取的常用方法有复合酶解法[6]、酸碱提取法[7]、超声提取法[8-9]。目前对于多糖的提取方法研究较为成熟,但是不同的原料对提取方法有所要求,原料的结构与来源均会导致多糖的水溶性和极性不同。传统的热水浸提法用时长,复合酶解法必须严格控制提取条件,操作难度大,酸碱提取法容易破坏多糖结构。而超声波辅助水提醇沉法可在保证多糖结构不被破坏的同时加快提取的速度,且操作简单,提取率高。目前白蜡多年卧孔菌活性物质在国内外研究较少,研究表明,白蜡多年卧孔菌的其粗多糖提取物有一定的体外抗氧化活性。子实体的乙醇提取物具有较强的抑制宫颈癌Hela细胞株的能力[10]。目前,未对白蜡多年卧孔菌多糖的提取物进行系统化工艺优化以及抗氧化评估。
本研究以多糖提取率为评价指标,采用超声辅助水提醇沉法提取白蜡多年卧孔菌子实体及菌丝体多糖,在单因素试验基础上,通过Box-Behnken响应面法优化白蜡多年卧孔菌子实体、菌丝体的粗多糖提取工艺,并测定其对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2'联氮-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基的清除能力,以及对油脂的抗氧化能力。以期为白蜡多年卧孔菌多糖的开发利用提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
白蜡多年卧孔菌(Perenniporia fraxinea)990715经野外采集,组织分离保存于平顶山健康食品协同创新中心菌种库。
1.1.2 试剂
葡萄糖标准品(纯度≥98%):天津市优谱化学试剂有限公司;DPPH:北京索莱宝科技有限公司;ABTS(纯度≥98%)、水杨酸(纯度≥98%):宜兴市申光医药化工有限公司;金龙鱼菜籽油:益海嘉里公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SW-CJ-2F型水浴锅:苏州安泰空气技术有限公司;KQ-50B型超声仪:昆山市超声波仪器有限公司;PE Eenspire型酶标仪:美国PE公司;KDC-1044型低速离心机:科大创新股份有限公司;GFL-125型电热鼓风干燥箱:天津莱玻特瑞仪器有限公司;MJ-78A型高压蒸汽灭菌锅:上海施都凯仪器设备有限公司;JP-100A-2型紫外分光光度计:北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 白蜡多年卧孔菌子实体和菌丝体的粗多糖提取工艺
流程及操作要点

操作要点:
白蜡多年卧孔菌原料预处理:子实体按照文献[3]的方法栽培获得,菌丝体按照文献[11]的方法培养获得,菌丝体和子实体经过65 ℃鼓风干燥箱干燥处理,粉碎机粉碎过40目筛,-20 ℃冰箱保存备用。
加水搅拌:称取0.1 g白蜡多年卧孔菌子实体(菌丝体),按照一定的液料比(1∶20、1∶30、1∶40、1∶50、1∶60、1∶70(g∶mL))加水。
超声提取:在超声功率100 W、提取温度70 ℃条件下,超声提取(5 min、10 min、15 min、20 min、25 min)。
水浸提、离心:水浸提温度为80 ℃,提取(40 min、60 min、80 min、100 min、120 min)后,于4 500 r/min离心10 min,取其上清液。
浓缩:在101 kPa,50 ℃条件下旋转蒸发浓缩,浓缩至原体积的四分之一左右。
除蛋白:采用Sevage法除蛋白,加入等体积Sevage溶液,振荡10 min,4 000 r/min离心10 min,得上清液[12]。
醇沉:粗子实体和菌丝体上清液按照1∶3的比例加入体积分数为95%的乙醇于4 ℃醇沉过夜,上清液在4 000 r/min室温(25 ℃)下离心5 min,将沉淀用无水乙醇洗涤3次,将沉淀溶于1 mL蒸馏水中,得到白蜡多年卧孔菌子实体和菌丝体粗多糖溶液。
1.3.2 白蜡多年卧孔菌子实体(菌丝体)粗多糖提取工艺优化
单因素试验:分别考察不同的料液比(1∶20、1∶30、1∶40、1∶50、1∶60、1∶70(g∶mL))、超声时间(5 min、10 min、15 min、20 min、25 min)和提取时间(40 min、60 min、80 min、100 min、120 min)对白蜡多年卧孔菌多糖提取率的影响。
响应面试验:根据单因素试验的结果,利用Box-Benhnken试验设计[13-14],选取料液比(A)、提取时间(B)和超声时间(C)3个因素为自变量,分别以白蜡多年卧孔菌子实体多糖提取率(Y1)、菌丝体多糖提取率(Y2)为响应值,每个因素设置3个水平,分别以-1、0、1进行编码,采用Box-Benhnken试验设计3因素3水平的响应面试验,试验因素与水平见表1。

表1 子实体和菌丝体多糖提取工艺优化Box-Benhnken试验设计因素及水平Table 1 Factors and levels of Box-Benhnken experiments design for extraction process optimization of fruiting bodies and mycelium polysaccharides
1.3.3 分析检测
(1)白蜡多年卧孔菌子实体和菌丝体多糖体外抗氧化活性的测定
以同质量浓度维生素C(vitamin C,VC)溶液为阳性对照,采用二倍稀释法配制成质量浓度分别为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL的白蜡多年卧孔菌子实体和菌丝体多糖溶液。DPPH·清除率的测定参考文献[15-17];ABTS+·清除率的测定参考文献[18]。
(2)白蜡多年卧孔菌多糖抗植物油脂氧化能力的测定
采用Schaal烘箱法[19],分别称取50 mg的白蜡多年卧孔菌子实体和菌丝体多糖,添加至100 mL菜籽油中,搅拌均匀后,将其放置于60 ℃烘箱中,每隔12 h对油脂样品利用玻璃棒搅拌1次,分别在第0、2、4、6和8天测定过氧化值(peroxide value,POV),同时以未添加白蜡多年卧孔菌子实体和菌丝体多糖的植物油为对照组。参考国家标准GB 5009.227—2016《食品中过氧化值的测定》,测定其过氧化值(POV),以评价白蜡多年卧孔菌子实体和菌丝体多糖抗油脂氧化效果。
(3)多糖含量的测定
多糖含量的测定采用苯酚-硫酸法[20-22],在波长490 nm处测定吸光度值[23]。以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制葡萄糖标准曲线,得葡萄糖标准曲线回归方程y=0.059 7x+0.024 7,相关系数R2=0.999 1。按照葡萄糖标准曲线回归方程计算样品中多糖含量。
多糖提取率的计算:将样品溶液稀释10倍后得到待测液。取100 μL待测液于5 mL的试管中。多糖提取率(Y)计算公式如下:

式中:C为粗多糖的含量,g/mL;V为白蜡多年卧孔菌溶液的体积,mL;N为稀释的倍数;M为样品的质量,g。
1.3.4 数据处理
采用软件Design Expert11.0进行响应面分析,使用软件Origin 9.0制图。
2 结果与分析
2.1 白蜡多年卧孔菌子实体和菌丝体多糖提取工艺优化单因素试验
2.1.1 料液比的确定
料液比对白蜡多年卧孔菌子实体、菌丝体多糖提取率的影响见图1。

图1 料液比对子实体及菌丝体多糖提取率的影响Fig. 1 Effect of solid and liquid ratio on extraction rates of fruiting bodies and mycelium polysaccharides
由图1可知,当料液比为1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL)时,子实体多糖提取率随着液体比例的增加而逐渐提高;当料液比为1∶60(g∶mL)时,子实体多糖提取率最高,为3.38%;当料液比在1∶70(g∶mL)时,子实体多糖提取率下降。当料液比为1∶20、1∶30(g∶mL)时,菌丝体多糖的提取率逐渐增加;当料液比为1∶30(g∶mL)时,菌丝体多糖提取率最高,为5.25%,随着液体占比继续增加,菌丝体多糖提取率逐渐下降。原因可能是,溶剂越多,多糖更易溶出,从而多糖提取率提高,当多糖溶解达到平衡时,再增加溶剂的量时,使得水溶性物质析出量增加,从而导致多糖提取率相对减少[13,24]。因此,最佳提取子实体多糖和菌丝体多糖的料液比分别为1∶60(g∶mL)和1∶30(g∶mL)。
2.1.2 提取时间的确定
提取时间对白蜡多年卧孔菌子实体和菌丝体多糖提取率的影响见图2。

图2 提取时间对子实体及菌丝体多糖提取率的影响Fig. 2 Effect of extraction time on extraction rates of fruiting bodies and mycelium polysaccharides
由图2可知,当提取时间为40~80 min时,子实体多糖逐渐增加;提取时间为80 min时,子实体多糖提取率达到最大值3.42%;提取时间从80 min增加至120 min时,多糖提取率逐渐下降。随着提取时间在40~100 min范围内的增加,菌丝体多糖提取率逐渐增加,提取时间为100 min时;菌丝体多糖提取率值最大,为5.65%;提取时间>100 min之后,菌丝体多糖提取率下降。其原因可能是,在提取物与提取料液未达到扩散平衡前,提取时间越长意味提取物与提取液相互作用时间越长,因此提取率越高[25]。但提取时间太长会导致多糖的提取率下降,可能是由于多糖在水中浸提时间过长,结构破坏,导致多糖含量减少[26]。因此,最佳的子实体、菌丝体多糖提取时间分别为80 min、100 min。
2.1.3 超声时间的确定
超声时间对白蜡多年卧孔菌子实体和菌丝体多糖提取率的影响见图3。
由图3可知,随着超声时间在5~15 min范围内的增加,子实体多糖和菌丝体多糖的提取率均逐渐增加;超声时间为15 min时,多糖提取率均达到最大值,子实体多糖提取率为2.56%,菌丝体多糖提取率为5.06%;当提取时间>15 min之后,子实体多糖和菌丝体多糖的提取率均逐渐下降。其原因可能为较短的超声时间不能使多糖完全溶出。当超过最佳超声时间时,杂质溶出会抑制多糖溶出,同时由于机械波和热效应作用会破坏多糖结构,使多糖提取率降低[27-28]。因此,最佳子实体多糖与菌丝体多糖超声时间均为15 min。
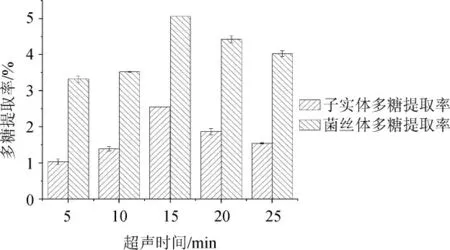
图3 超声时间对子实体及菌丝体多糖提取率的影响Fig. 3 Effect of ultrasonic time on extraction rates of fruiting bodies and mycelium polysaccharides
2.2 白蜡多年卧孔菌子实体和菌丝体多糖提取工艺优化响应面试验
根据单因素试验结果,以料液比(A)、提取时间(B)和超声时间(C)为主要影响因素,以白蜡多年卧孔菌子实体(Y1)和菌丝体多糖提取率(Y2)为响应值进行3因素3水平的响应面试验。子实体和菌丝体多糖提取工艺优化Box-Benhnken响应面试验设计[29-30]结果见表2,方差分析结果见表3。

表2 子实体和菌丝体多糖提取工艺优化Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken experiments design for extraction process optimization of fruiting bodies and mycelium polysaccharides
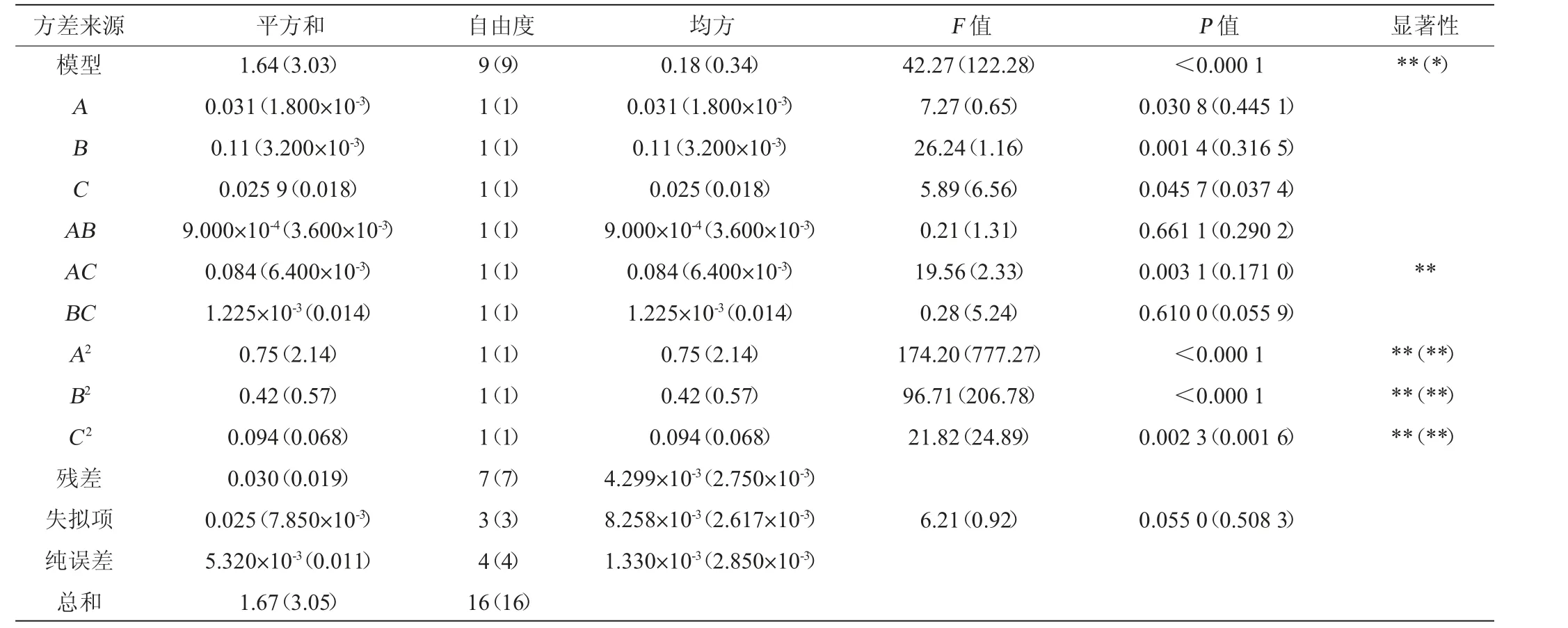
表3 回归模型的方差分析Table 3 Variance analysis of regression model
利用统计软件Design-Expert V8.0.6对试验结果进行统计分析并进行多元拟合,得到白蜡多年卧孔菌子实体(Y1)、菌丝体多糖提取率(Y2)的二次多项回归方程:

由表3可知,子实体多糖提取工艺优化模型回归极显著(P<0.01),失拟项不显著(P=0.055 0>0.05),说明构建的模型合理。模型决定系数R2为0.981 9、调整决定系数R2adj为0.958 7,在该模型中,一次项A、B、C对结果影响显著(P<0.05),二次项A2、B2、C2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。由F值可知,根据影响子实体多糖提取率的程度,对因素排序为:提取时间(B)>料液比(A)>超声时间(C)。
菌丝体多糖提取工艺优化模型回归极显著(P<0.01),失拟项不显著(P=0.503 8>0.05),说明构建的模型合理。模型决定系数R2为0.993 7、调整决定系数R2adj为0.985 6,在该模型中,二次项A2、B2、C2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。根据F值可知,根据影响菌丝体多糖提取率的程度,对因素排序为:超声时间(C)>提取时间(B)>料液比(A)。各因素交互作用对子实体和菌丝体多糖提取率影响的响应面及等高线图见图4。
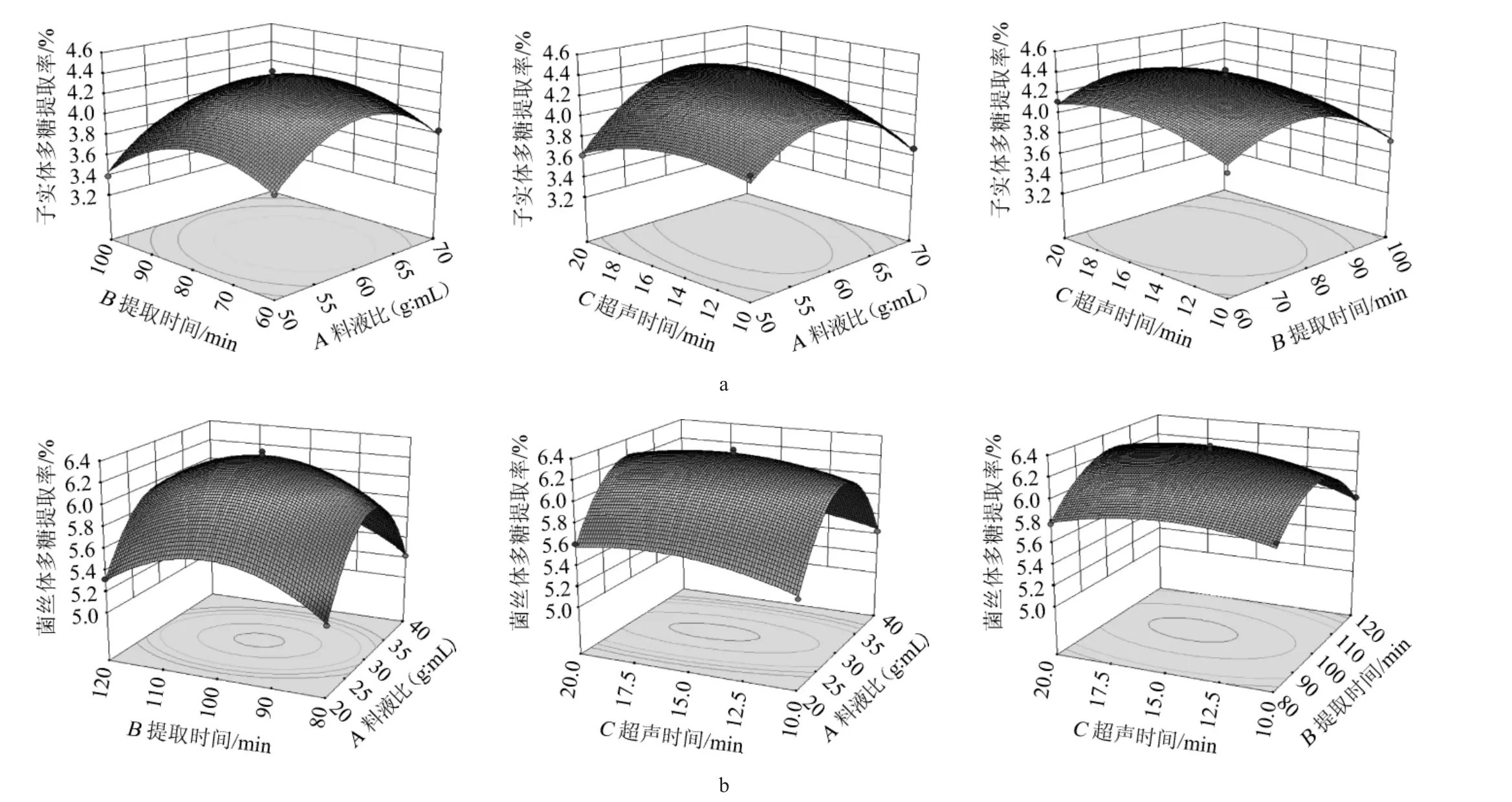
图4 各因素交互作用对子实体(a)和菌丝体(b)多糖提取率影响的响应面及等高线Fig. 4 Response surface plots and contour lines of effects of interaction between each factor on extraction rates of fruiting bodies (a) and mycelium (b) polysaccharides
由图4(a)可知,各因素交互作用对子实体多糖提取率影响的响应面曲线呈现出抛物线状,说明所拟合的回归模型有极大值点。料液比与超声时间的交互作用对子实体多糖提取率影响极显著(P<0.01),而其余两两因素的交互作用影响较小,与方差分析的结果一致。子实体粗多糖的最佳提取工艺条件为料液比1∶61.146(g∶mL)、提取时间76.151 min和超声时间16.277 min。在此条件下,白蜡多年卧孔菌子实体粗多糖提取率的预测值为4.388%。考虑到实际操作情况,将最佳提取工艺条件设为料液比1∶60(g∶mL)、提取时间76 min和超声时间16 min。为验证回归模型的有效性,采用优化后的提取工艺条件进行3次验证试验,子实体多糖提取率平均实际值为4.38%,和预测值接近,表明该模型能较准确反应各因素对子实体多糖提取率的影响。
由图4(b)可知,各因素交互作用对菌丝体多糖提取率影响的响应面曲线呈抛物线状,说明所拟合的回归模型有极大值。提取时间与超声时间的交互作用对菌丝体多糖提取率的影响较大,而其余两两因素的交互作用影响较小,这与方差分析的结果一致。菌丝体粗多糖的最佳提取工艺条件为料液比1∶29.832(g∶mL)、提取时间100.888 min和超声时间15.997 min。在此优化条件下,白蜡多年卧孔菌菌丝体多糖提取率的预测值为6.325%。考虑到实际操作情况,将最佳提取工艺条件设为料液比1∶30(g∶mL)、提取时间101 min和超声时间16 min。在此条件下进行3次平行验证试验,所得菌丝体多糖提取率平均实际值为6.33%,与预测值接近,表明该模型能较准确反应各因素对菌丝体多糖提取率的影响。
2.3 白蜡多年卧孔菌多糖体外抗氧化能力
子实体和菌丝体多糖对DPPH·(a)、ABTS+·(b)清除率的影响见图5。
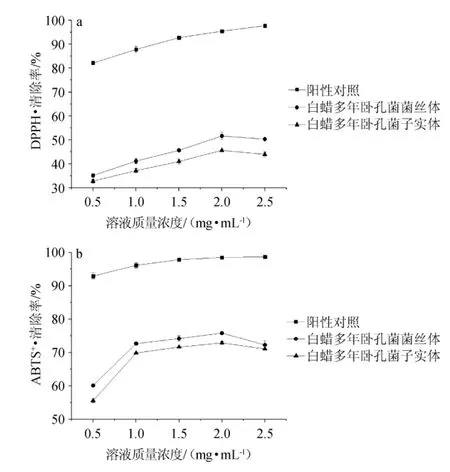
图5 子实体和菌丝体多糖对DPPH·(a)、ABTS+·(b)的清除率Fig. 5 Scavenging rates of fruiting bodies and mycelium polysaccharides on DPPH·(a) and ABTS+·(b)
由图5(a)可知,随着多糖质量浓度在0.5~2.0 mg/mL范围内的上升,子实体与菌丝体多糖对DPPH·的清除率逐渐增加,当多糖质量浓度达到2.0 mg/mL时,子实体和菌丝体多糖对DPPH·的清除率达到最大值,分别为45.67%和51.67%,当多糖质量浓度继续增加,对DPPH·的清除率逐渐降低。子实体和菌丝体多糖对DPPH·有较高的抗氧化活性,前期的研究多糖的制备没有经过除蛋白处理,糖蛋白的形式相对于多糖表现出较好的清除DPPH·的能力[31]。
由图5(b)可知,随着多糖质量浓度在0.5~2.0 mg/mL范围内增加,子实体与菌丝体多糖对ABTS+·清除作用逐渐增强,当多糖质量浓度达到2.0 mg/mL时,子实体和菌丝体多糖的清除率达到最大值,分别为72.89%和75.83%,当多糖质量浓度继续增加,对ABTS+·的清除率逐渐降低。
2.4 白蜡多年卧孔菌多糖的油脂抗氧化能力
将白蜡多年卧孔菌多糖添加至植物菜籽油中,通过加速氧化方法研究随着时间的延长白蜡多年卧孔菌多糖对于植物油抗氧化的效果,结果见图6。由图6可知,随着时间的延长,阳性对照组的油脂POV几乎随着时间变化而成线性增加,而白蜡多年卧孔菌子实体和菌丝体多糖组POV仅仅随着时间的延长缓慢增加。加热至第8天,白蜡多年卧孔菌菌丝体多糖组POV仅为对照组的49%,与初始值相比较,POV增加了142%,而对照组POV增加量为211%。菌丝体的抗油脂氧化能力略大于子实体的抗油脂氧化能力,可能是因为菌丝体的多糖纯度较高。说明了提取的白蜡多年卧孔菌多糖具有明显的抗油脂氧化效果,可尝试用于开发天然的植物油脂抗氧化剂,但是白蜡多年卧孔菌多糖的得率较低,且在植物油中的溶解度比较小,尚不能大规模应用于工业生产当中。

图6 子实体和菌丝体多糖抗油脂氧化能力Fig. 6 Anti-lipid oxidation ability of fruiting bodies and mycelium polysaccharides
3 结论与讨论
白蜡多年卧孔菌子实体多糖最佳提取工艺条件为料液比1∶60(g∶mL)、提取时间76 min和超声时间16 min。在此优化条件下,子实体多糖提取率为4.39%。菌丝体多糖最佳提取工艺条件为料液比1∶30(g∶mL)、提取时间101 min和超声时间16min,在此优化条件下,菌丝体多糖提取率为6.33%。抗氧化试验结果表明,当多糖溶液的质量浓度为2.0 mg/mL时,子实体多糖对DPPH·、ABTS+·的清除率分别为45.67%、72.89%;菌丝体多糖对DPPH·、ABTS+的清除率分别为51.67%、75.83%。子实体、菌丝体多糖均对ABTS+·有较好的清除能力,对DPPH·的清除能力次之。在白蜡多年卧孔菌多糖抗油脂氧化能力的实验中,白蜡多年卧孔菌菌丝体、子实体多糖能显著降低植物油的POV,表明白蜡多年卧孔菌多糖具有一定的抗油脂氧化效果。本研究可为白蜡多年卧孔菌多糖作为天然的抗氧化剂的相关研究提供基础数据。后续可从多糖及其蛋白的结合机制上解析抗氧化活性的方向进行研究。
