酿酒葡萄表皮产酶非酿酒酵母的筛选及其产酶特性研究
2021-03-04马延琴徐晓裕李春燕史学伟
马延琴,徐晓裕,李 甜,李春燕,蒋 霞,王 斌,史学伟*
(石河子大学食品学院,新疆 石河子 832000)
葡萄表皮具有非常丰富的微生物资源,包括酵母、霉菌和细菌[1]。葡萄表皮的酵母包括参与酒精发酵的酿酒酵母(Saccharomyces cerevisiae)和对葡萄酒风味具有重要贡献的非酿酒酵母(non-Saccharomyces cerevisiae),受葡萄园气候、环境和葡萄品种影响较大,表现出明显的地域特色[2]。非酿酒酵母在葡萄酒发酵过程中分泌各种胞外酶(如β-葡萄糖苷酶、蛋白酶和脂肪酶),将葡萄汁中的糖分、含氮化合物和含硫化物转化为风味物质,赋予葡萄丰富的水果香和花香类香气[3-5]。
在酿造过程中,葡萄酒酒体香气因葡萄酒挥发性成分、含量及平衡关系变化而发生改变[6]。葡萄中的挥发性物质大多以结合态的形式存在,非酿酒酵母在发酵过程中产生的各种酶类可以降解大分子化合物,将结合态的挥发性风味物质释放出来,提高葡萄酒香气的复杂性[7]。β-葡萄糖苷酶通过酶促水解移除相应的糖配基进而断裂糖苷键后释放挥发性香气成分[8]。蛋白酶将蛋白质降解为氨基酸,为葡萄酒酸类和醇类等香气物质的形成提供重要的前体[9]。脂肪酶能够逐渐将甘油三酯水解成甘油和脂肪酸,进而产生的挥发性物质[10]。
非酿酒酵母在葡萄酒发酵过程中对葡萄酒风味形成具有重要作用,然而能用于改善葡萄酒风味的非酿酒酵母制剂很少。本研究以新疆酿酒葡萄为原料,分离和鉴定产酶非酿酒酵母,并对非酿酒酵母的酶学特性进行分析,为产酶非酿酒酵母在葡萄酒发酵中的应用提供理论依据,为后续葡萄酒增香及开发利用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
赤霞珠葡萄:采摘于新疆玛纳斯葡萄园区,利用五点取样法在不同种植区域中采取不同品种的葡萄样品。采集过程中,将采集样品放入无菌自封袋中贴上标签。葡萄样品保存在4 ℃条件下,并于24 h内运回实验室。
1.1.2 培养基
坎迪达尼克森选择性琼脂(bismuth sulfite glucose glycine yeast agar,BIGGY):青岛高科技工业园海博生物技术有限公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基[11]:葡萄糖20 g/L,酵母提取物10 g/L,蛋白胨20 g/L,pH 7.0,121 ℃灭菌20 min。
酵母膏胨葡萄糖(yeast peptone dextrose,YPD)琼脂培养基[12]:葡萄糖20 g/L,酵母提取物10 g/L,蛋白胨20 g/L,琼脂20 g/L,pH 7.0,121 ℃灭菌20 min。
β-葡萄糖苷酶培养基[13]:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,NH4NO33 g/L,KH2PO44 g/L,自然pH值,121 ℃灭菌20 min,温度为60~70 ℃时加入对硝基苯-β-D-吡喃半乳糖苷(p-nitrobenzene-β-D-galactopyranoside,p-NPG)1 g/L。
蛋白酶筛选培养基[14]:葡萄糖20 g/L,酵母提取物10 g/L,蛋白胨20 g/L,琼脂20 g/L,脱脂乳粉20 g/L,pH 7.0,121 ℃灭菌20 min。
脂肪酶筛选培养基[15]:葡萄糖20 g/L,酵母提取物10 g/L,蛋白胨20 g/L,琼脂20 g/L,甘油三丁酸酯10 mL/L,pH 7.0,121 ℃灭菌20 min。
1.1.3 试剂
真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京博迈生物科技有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、Ladder Marker、DNA扩增引物:上海生工生物技术有限公司。所有试剂为分析纯或生化试剂。
1.2 仪器与设备
SYQ-DSX-280B手提式不锈钢电热蒸汽灭菌器:上海申安医疗器械厂制造;CX21FS1光学显微镜:日本Olympus公司;DYY-8CLHP电泳仪:北京六一生物科技有限公司;GelDOCXR凝胶成像系统:美国BioRad公司;B250恒温水浴锅:上海予卓仪器有限公司;X7酶标仪:美国伯腾仪器有限公司。
1.3 试验方法
1.3.1 酿酒葡萄表皮微生物的分离和纯化
将去梗后并保持完整的葡萄样品放入无菌三角瓶中,加入100 mL无菌水振荡混匀(30 ℃、180 r/min振荡2 h),取1 mL悬浮液按10-1、10-2、10-3、10-4和10-5共5个梯度进行稀释,各取200 μL涂布于YPD培养基上,30 ℃倒置恒温培养48 h,划线分离,直至出现单菌落。酵母以40%甘油保存在-20 ℃冰箱。
1.3.2 酵母菌株的形态观察
菌株在YPD固体平板中30 ℃培养3 d,观察菌株的形态大小进行初步判定是否为酵母菌,并在光学显微镜下根据单细胞的个体大小及酵母菌典型细胞结构进一步判断菌株的类型,并命名。
1.3.3 酵母菌株分子生物学鉴定
根据真菌基因组DNA提取试剂盒说明书提取DNA,以提取真菌的总DNA为模板,采用ITS通用引物(ITS1:5'-TCCGTAGGTGAACCTGCGG-3';ITS4:5'-TCCTCCGCTTATTGATATGC-3')通过PCR扩增序列,反应程序为95 ℃预变性5 min;95 ℃变性45 s,52 ℃退火2 min,72 ℃延伸1 min,35个循环;72 ℃再延伸10 min。将扩增后的酵母菌PCR产物置于1%琼脂糖凝胶电泳上跑样,确认扩增结果和片段的大小,使用Marker判断扩增条带大小。将条带清楚的PCR产物纯化后寄往上海生工生物科技有限公司进行测序。将测序结果通过基本局部比对搜索工具(basiclocal alignmentsearchtool,BLAST)与美国国家生物技术信息中心(national center of biotechnology information,NCBI)的核酸数据进行比对分析,用软件Mega 6.0构建系统发育树。
1.3.4 产β-葡萄糖苷酶、蛋白酶、脂肪酶菌株的筛选及酶活性测定
产β-葡萄糖苷酶酵母菌的定性:由于产β-葡萄糖苷酶菌株在以p-NPG为唯一碳源的筛选培养基上能水解p-NPG生成对硝基苯酚(p-nitrophenol,p-NP),在Na2CO3作用下可形成黄色光圈。光圈颜色深浅能初步反映酶活性高低。因此,将菌株经YEPD培养基活化后接种在筛选培养基上,28 ℃培养72 h,喷1 mol/L Na2CO3进行显色,黄色光圈明显的菌株即为目标菌株[16],接种于斜面4 ℃保存,作为产β-葡萄糖苷酶菌株进行复筛。
产β-葡萄糖苷酶酵母菌的定量:将初筛得到的菌株活化后,接种到液体培养基中,28 ℃、200 r/min 摇床培养72 h。取发酵液于4 ℃、8 000 r/min 离心10 min,收集上清液,即为β-葡萄糖苷酶粗酶液,用于酶活性测定,从中筛选酶活力较高的菌株(以加热失活的酶液按照同样处理作为空白)。酶活的测定:离心管中加入0.8 mL上清液和0.2 mL底物溶液(5 mmol/L p-NPG溶解在2 mL pH为5.0的100 mmol/L柠檬酸缓冲溶液,750 μL柠檬酸-磷酸缓冲液(pH 5.0)和250 μL 1 mmoL/L p-NPG混合)在50 ℃条件下无菌培养25 min后,加入2 mL 1 mol/L碳酸钠终止反应,在波长400 nm处比色测定酶活,同时用未加酶的0.3 mL的底物溶液作空白对照。酶活定义:在一定温度和pH条件下,1 min水解产生1 μmol对硝基苯酚所需的酶量为1个酶活单位(U/mL)[17]。
采用加入2%脱脂乳粉于YPD培养基中筛选产蛋白酶活性的菌株。操作方法如下:将分离得到的菌株接种到相应的YEPD培养基,将大小相同的灭菌圆纸片放入液体培养基中于相应的温度下培养24 h,然后用镊子取出圆形滤纸片贴到含有2%脱脂乳粉的蛋白酶筛选固体培养基平板上,置于相应的生化恒温培养箱中培养24 h,以菌落周围是否产生白色水解圈为筛选依据[18]。
蛋白酶活力测定方法:采用GB/T 23527—2009《蛋白酶制剂》测定[19]。将具有明显水解圈的初筛菌株接种于液体培养基后,摇床培养24 h以6 000 r/min离心取上清液,将酪蛋白为底物反应后于波长680 nm处测定吸光度值。酶活定义:1 mL酶液在一定pH值和温度条件下,每分钟内酪蛋白水解所产生1 μg酪氨酸的酶量为1个酶活力单位(U/mL)。
产脂肪酶菌株的筛选采用脂肪酶筛选培养基,将含有菌液的滤纸片接种到含有甘油三丁酸酯的培养基中于相应的温度下培养24 h,待有菌落长出来后将平板放在灯下观察有无水解圈的产生。有透明水解圈的菌株则为产酶菌株[20]。将具水解圈的菌株接种到液体培养基后离心取上清,用电位及指示剂结合的滴定法测定酶活[21]。酶活定义:在一定温度和pH 条件下,1 min水解底物产生1 μmol可滴定的脂肪酸,即可定义为1个酶活单位(U/mL)。
1.3.5 菌株耐受性研究
乙醇耐受性实验[22]:将纯化过的酵母菌株以1×106CFU/mL分别接种于含0、4%、8%、12%、16%、20%乙醇的YPD液体培养基,在28 ℃条件下培养,每隔24 h测定OD600nm值,持续3 d。
糖耐受性实验[23]:将纯化过的酵母菌株以1×106CFU/mL分别接种于含0、50 g/L、100 g/L、150 g/L、200 g/L、250 g/L、300 g/L、320 g/L葡萄糖的YPD液体培养基,在28 ℃条件下培养,每隔24 h测定OD600nm值,持续3 d。
二氧化硫耐受性实验[24]:将纯化过的酵母菌株以1×106CFU/mL分别接种于含0、50 mg/L、100 mg/L、150 mg/L、200 mg/L、250 mg/L、300 mg/L、320 mg/L二氧化硫的YPD液体培养基,在28 ℃条件下培养,每隔24 h测定OD600nm值,持续3 d。
H2S产生实验[25]:将纯化过的酵母菌株在坎迪达尼克森选择性琼脂(BIGGY)培养基涂布培养,在28 ℃条件下培养3 d,每隔24 h 观察菌株颜色的变化。颜色分为四类:乳白色(+)、浅棕褐色(++)、棕褐色(+++)、褐色(++++)。
1.3.6 数据处理
实验过程中每个样本设置3个平行,结果以“平均值±标准差”表示。用Edraw(V7.2.0.2467)画图软件整合并绘制微生物菌株产酶示意图。SPSS 19.0进行差异显著性分析,Origin 9.0软件进行实验图的绘制,R软件(4.0.3)绘制热图。
2 结果与分析
2.1 酵母的分离与鉴定
2.1.1 酵母的分离
本研究从新疆昌吉地区酿酒葡萄表皮筛选得到了62株酵母菌,编号为CZ1~CZ10,AG1~AG9,KL1~KL6,KS1~KS12,PM1~PM16,Y1~Y9。具有代表性的酵母菌落形态分别见图1和表1。
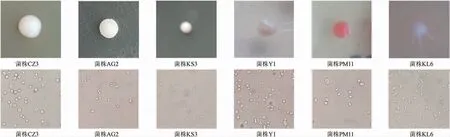
图1 筛选酵母菌细胞形态及镜检结果Fig. 1 Cell morphology and microscopic examination results of screened yeasts

表1 筛选酵母菌菌落形态Table 1 Colony morphology of screened yeasts
从图1、表1可知,通过筛选代表性菌株的单个菌落图发现大多数菌落是圆形。酵母菌株颜色主要为白色、淡粉色。大多数微生物菌株的表面光滑或有光泽,菌株边缘整齐且不透明,菌落形状基本都为高凸起。由镜检结果可发现,酵母的形态有圆形、椭圆形和棱状,能明显观察到部分酵母的细胞核、液泡及细胞壁。
2.1.2 酵母的鉴定
根据酵母菌株的形态筛选出12株具有代表特征的酵母菌并命名。按照真菌提取试剂盒说明书提取DNA并进行PCR扩增,扩增产物进行琼脂糖凝胶电泳检测,观察其条带是否明显,是否符合测序标准,琼脂糖凝胶电泳结果如图2所示。

图2 酵母菌PCR扩增产物琼脂糖凝胶电泳结果Fig. 2 Agarose gel electrophoresis results of PCR amplification products of yeasts
由图2可知,所有酵母菌的分子大小都在750 bp左右,且条带非常清晰明亮,没有明显拖尾或是特别显著的现象,PCR扩增产物符合测序标准并送往上海生工进行测序。得到的测序结果再根据Mega软件进行序列的1 000次置信分析即可得到酵母菌的进化树,结果见图3。
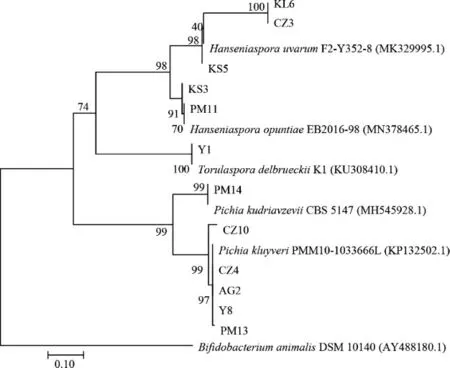
图3 基于26S rDNA序列分析酵母菌株的系统发育树Fig. 3 Phylogenetic tree of yeast strains based on 26S rDNA sequence analysis
由图3可知,菌株KL6、CZ3和KS5为葡萄有孢汉逊酵母(Hanseniaspora uvarum);菌株KS3和PM11为仙人掌有孢汉逊酵母(Hanseniaspora opuntiae);菌株Y1为德尔布有孢圆酵母(Torulaspora delbrueckii);菌株CZ10、AG2、Y8、CZ4和PM13为毕赤克鲁维酵母(Pichia kluyveri);菌株PM14为库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)。
2.2 高产β-葡萄糖苷酶、蛋白酶、脂肪酶菌株的筛选及酶活测定
以筛选得到的葡萄表皮样品中的62株酵母菌为研究对象,筛选得到12株产β-葡萄糖苷酶、蛋白酶、脂肪酶较高的菌株结果见表2。

表2 高产β-葡萄糖苷酶、蛋白酶、脂肪酶酵母菌株的酶活测定Table 2 Enzyme activity determination of yeast strain with high production of β-glucosidase, protease and lipase U/mL
由表2可知,产β-葡萄糖苷酶、蛋白酶和脂肪酶活性最高的分别是菌株CZ4(214.57 U/mL)、KS5(178.56 U/mL)和KS3(184.68 U/mL);而最低的分别是菌株Y1(126.24 U/mL)、KL6(60.19 U/mL)和KL6(55.04 U/mL)。可以看出,菌株产β-葡萄糖苷酶的活性明显高于蛋白酶和脂肪酶活性。
2.3 酵母酶学特性分析
2.3.1 菌株耐受性分析
根据以上产酶菌株筛选得到的3株优良产酶酵母菌株(KS3、CZ4、KS5),对其进行耐受性分析,结果见表3。

表3 酵母菌株耐受性Table 3 Tolerance of yeast strains
由表3可知,随着SO2浓度逐渐增加时,菌株KS5的SO2耐受性呈先增加后减少的趋势,SO2含量为350 mg/L时,生长受到抑制,但仍能缓慢生长;当糖含量逐渐增加时,菌株整体耐受性先增加后减少,在糖含量为200 g/L的环境中能够生长,而在250 g/L环境生长受到抑制;随着酒精含量的增加,酒精耐受性逐渐减弱,在酒精含量为16%时,虽然生长受到抑制但仍能生长,在酒精含量为20%时,生长受到强烈抑制。菌株KS3随着SO2含量的增加,生长量呈先增加后减少的趋势,SO2耐受量达到300 mg/L,但当SO2含量为350 mg/L时,生长受到抑制;随着糖含量的增加,其糖耐受性呈现先增加后减少的趋势;随着酒精含量的上升,菌株KS3的生长量呈先升高后降低的趋势,酒精含量为20%时,其生长受到了抑制。随着SO2浓度的增加,菌株CZ4的生长量先增加后降低,在100 mg/L的环境中生长且生长量提升,但在350 mg/L时,生长受到抑制;随着糖含量的增加,生长量呈先增加后减少的趋势,在糖含量为200 g/L的环境中能够生长,而在250 g/L环境生长受到抑制;随着酒精含量的上升,生长量同样呈先增加后减少的趋势,当酒精含量为20%时,生长受到了抑制。
2.3.2 H2S的产生
选择产β-葡萄糖苷酶、蛋白酶和脂肪酶活性最高的菌株CZ4、KS5和KS3在Biggy琼脂培养基上培养,观察酵母菌株菌落的显色情况判断H2S产生情况,结果见表4。

表4 酵母菌H2S产生试验结果Table 4 H2S production test results of strain
酵母菌株H2S产生量根据菌株在BIGGY培养基中颜色深浅判断。由表4可知,菌株CZ4、KS3、KS5的H2S产生量均较低,适用于酿造葡萄酒。
3 结论
通过对所选酿酒葡萄表皮酵母菌的分离鉴定,从葡萄表皮筛选到62株酵母菌。通过对所筛酵母菌株的产酶特性分析,其中3株酵母菌产β-葡萄糖苷酶、蛋白酶和脂肪酶活最高,分别是Pichia kluyveriCZ4(214.57 U/mL)、Hanseniaspora uvarumKS5(178.56 U/mL)和Hanseniaspora opuntiaeKS3(184.68 U/mL)。为了确保酵母菌株能够在葡萄酒酿造环境中正常生长并提高葡萄酒品质,对选取的产3种酶活性较高的酵母菌株进行了耐受性和H2S产生量分析,结果表明,三株菌的SO2耐受性、糖耐受性和酒精耐受性整体呈现先增加后减少的趋势,H2S产生量较低,能够耐受葡萄酒酿造的环境。葡萄酒香气大多数以结合态的形式存在,而通过酵母菌株自身代谢的酶类可以将结合态香气转化为游离态香气,促进葡萄酒香气的呈现,提高葡萄酒品质。通过对产生β-葡萄糖苷酶、蛋白酶和脂肪酶酵母菌株的筛选,确定产酶效果较好的酵母菌株,为后续葡萄酒酿造增香效应研究提供理论基础。
