木质素降解真菌的筛选及其对森林地表可燃物的降解效果
2021-03-04
(东北林业大学 a.林学院;b.森林生态系统可持续经营教育部重点实验室,黑龙江 哈尔滨 150040)
森林可燃物是森林火灾发生的物质基础,也是发生森林火灾的必要条件[1]。我国是森林火灾严重的国家之一[2],在全球气候变化背景下,我国森林火灾形势异常严峻:早春火和夏季森林火灾多发;林火发生地理分布区扩大;森林可燃物干燥,极易燃烧,森林火灾燃烧性加大,林火发生频率高等[3-4]。在森林燃烧三要素(森林可燃物、火源与火环境)中,森林可燃物更易于人为控制,并且便于对森林防火有效性进行合理定量评价[5]。森林可燃物是林火传播的主要载体[6],同时也是林火管理的基本依据。而森林火灾,特别是高强度的森林火灾,其危害程度主要取决于森林可燃物载量[7]。因此,如何有效地降低森林可燃物载量,从而减少和控制森林火灾,是现代林火管理中的重要工作。
我国林火管理者通常通过机械清除、计划烧除、生物防火等手段减少森林可燃物载量,从而达到控制林火行为的目的。机械清除对于减少可燃物载量具有直接作用,并且可以降低林火造成的经济损失,但该方法需要考虑处理后对植被、土壤、野生动物长期的潜在影响,对林内物质分解过程的影响以及引发阴燃的可能性[8]。计划烧除可以减少火灾隐患,采用低强度的火能有效减少森林可燃物的积累[9],但由于进行计划烧除存在跑火风险,可能造成意想不到的火灾损失,为达到计划烧除预期效果,需谨慎选择点烧时间段[10]。生物防火利用植物、动物以及微生物的理化性质以及生物学和生态学特性上的差异,并结合林业生产措施,能够增强林分抗火性和阻火能力。综上所述,生物防火手段不存在处理后的负面影响及风险,并且可在环境不受污染的情况下减少可燃物载量,从而达到降低森林火灾危害程度的目的。
木质素是森林可燃物的主要组成成分,同时也是最顽固的天然化合物之一[11],其自然降解通常是一个缓慢的过程,因此,加快木质素的降解是减少森林可燃物载量的关键。自然界中木质素的降解过程依赖于真菌通过自身分泌的胞外氧化还原酶(如漆酶和过氧化物酶)组成的复合木质素降解酶系的催化[12]。目前国内外许多学者进行了关于木质素生物降解的研究,主要集中在造纸工业、生物堆肥、环境保护以及饲料、食品工业等领域,庞志强等[13]用白腐菌Trametesspp.Lg-9粗酶液预处理杨木,大幅改善了SCMP 的打浆性能,而且降低能耗,提高SCMP 的白度,并可改善强度;陈芙蓉等[14]将混合菌剂接种于堆肥发酵,发现木质素、纤维素、半纤维素降解率分别达到22.13%,48.97%和55.93%;王红[15]认为白腐真菌对相对分子质量较低的化合物的降解主要是依靠胞内酶氧化分解,而相对分子质量高的化合物则先由胞外酶将其降解为小分子物质后再被胞内酶进一步降解;王娜等[16]利用木质素降解菌粗酶处理烟草,烟草中的木质素含量减8%以上,可降低烟叶呛咳和刺激性,提高抽吸品质。在森林防火领域,彭徐剑[17]利用筛选出的H05、L02 和Z04 三株木质纤维素高效降解菌处理兴安落叶松、白桦及樟子松等可燃物基质,试验结果表明3 株菌对木质素、纤维素及半纤维素都具有很好的降解优势,并可作为森林地被可燃物高效降解菌。
帽儿山地区由于地处中温带,地表可燃物的分解受到很大程度的制约,其堆积使可燃物载量增加,气候干燥时造成森林火灾隐患。筛选该地区高效木质素降解真菌,进行可燃物样品降解试验,对降解效果进行分析与评价,在理论研究上,能够揭示生物防火的重要性与科学性,补充生物防火的研究内容,为制定科学合理的森林可燃物管理策略提供参考依据;在实践应用上,可以为清理地表可燃物提供新的途径,为应用生物降解方法降低帽儿山林区森林可燃物载量提供理论依据和基础数据。
1 材料与方法
1.1 研究区概况
试验地位于黑龙江省尚志市境内的东北林业大学帽儿山林场尖砬沟森林培育试验站(127°30′~127°34′E,45°21′~45°25′N)。地貌为低山丘陵,温带大陆性季风气候,1月平均气温-23℃,7月平均气温20.9℃,全年平均气温2.8℃。全年平均降水量724 mm,蒸发量1 094 mm。无霜期120~140 d。地带性土壤为暗棕壤,平均土层厚度为40 cm 左右,剖面酸碱性(pH 值4.3~6.0)。原始地带性植被为红松阔叶混交林,现存植被类型主要为以白桦Betula platyphylla、红皮云杉Picea koraiensis、水曲柳Fraxinus mandshurica、长白落叶松Larix olgensis及胡桃楸Juglans mandshurica等为主要树种的次生林。
本试验所用可燃物样品均为于2017年8月采自长白落叶松、胡桃楸、水曲柳纯林与胡桃楸-长白落叶松、水曲柳-长白落叶松混交林中的凋落叶。
1.2 培养基及溶液
PDA 培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,KH2PO43 g,MgSO4·7H2O 1.5 g,VB10.01 g,蒸馏水1 000 mL。
MEA 培养基:麦芽浸粉20 g,蛋白胨5 g,琼脂20 g,链霉素硫酸盐0.55 g,邻苯基苯酚0.06 g,蒸馏水1 000 mL。
PDA-愈创木酚培养基:于PDA 培养基中加入0.02%(0.2 mL/L)的愈创木酚。
PDA-苯胺蓝培养基:于PDA 培养基中加入0.1 g/L 的苯胺蓝。
无机盐溶液[18]:葡萄糖20 g,NH4NO30.5 g,KH2PO41.0 g,Na2HPO4·12H2O 0.4 g,MgSO4·7H2O 0.5 g,VB10.l mg,CaC120.1 mg,FeSO4·7H2O 0.l mg,用H2SO4调pH 值为5.0。
PDA 液体培养基:马铃薯200 g,葡萄糖20 g,KH2PO43 g,MgSO4·7H2O 1.5 g,VB10.01 g,蒸馏水1 000 mL。
1.3 菌株分离纯化
将采集的叶片样品投入蒸馏水中振荡漂洗2~3 次,用无菌的滤纸擦干。将叶片接种到PDA 平板培养基中,每个平板接种适量叶片,于28℃的恒温培养箱中培养4~5 d 后,用接种针挑取菌丝接种到MEA 培养基上,反复接种进行分离纯化直至获得纯菌株。将纯菌株转接到PDA 斜面培养基上,于28℃恒温培养箱中培养4 d 后,无杂菌试管于冰箱中4℃保存备用。
1.4 菌株初筛
将已经分离纯化并保存于冰箱中的菌株从斜面上挑出,转接到PDA 平板培养基上活化,28℃下恒温培养7 d 后,用直径10 mm 的无菌打孔器在菌落边缘制取菌饼,以每个平板1 块菌饼的接种量接于PDA-愈创木酚平板中央,并作3 个平行,于28℃恒温培养5 d,每天观察菌丝生长情况并记录平板上有无红棕色显色圈产生,有红棕色显色圈者记为+,反之记为-,依据显色圈直径的增大情况,分别用++、+++、++++依次表示。在第5天用游标卡尺分别测量有明显显色圈产生的菌株的菌落圈及显色圈直径。通过计算菌落圈与显色圈直径比值,可确定菌株是否能优先降解木质素:比值<1,能优先降解木质素;比值>1,不能优先降解木质素,即纤维素先被降解[19]。
1.5 菌株复筛
愈创木酚可以定性测定是否为能降解木质素的具有漆酶(Laccase,Lac)活性的菌株[20],但不能反映过氧化物酶类的产生。将上述产生显色圈的菌种接种到PDA-苯胺蓝平板上,28℃避光培养10 d,每天观察脱色圈的有无及大小,定性检测木质素过氧化物酶(Lignin peroxidases,LiP)及锰过氧化物酶(Manganese peroxidases,MnP)的产生与否[21]。
1.6 菌株鉴定
形态学鉴定:观察菌株培养特征、菌落形态,在光学显微镜下观察菌丝及孢子形态特征,并参照《真菌鉴定手册》[22]进行形态学鉴定。
分子生物学鉴定:采用生工生物工程(上海)股份有限公司的Ezup 柱式真菌基因组DNA 抽提试剂盒(产品编号:SK8259)提取DNA,采用引物ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGCTTATTGATATGC)进行PCR 扩增,经1%琼脂糖凝胶电泳后将未纯化产物委托上海生工生物工程有限公司进行测序。根据ITS 的测序结果,在NCBI 上应用Blast 进行序列比对,结合GenBank 中已有的相关ITS 序列,利用MEGA 5.1软件构建系统发育树。
1.7 地表可燃物样品降解试验
将采集于落叶松、胡桃楸、水曲柳纯林的凋落叶样品于80℃烘干至恒质量后(称量误差为±0.000 4 g)粉碎至40 目。粉碎后的样品用石油醚在冷浸提装置中进行脱脂,准确称取1 g(记为m)放入100 mL 三角瓶中,加入无机盐溶液5 mL,作为分解基质,120℃灭菌20 min 后备用。将筛选出的木质素降解菌株转接到PDA 培养基平板上,28℃下培养7 d 后用直径10 mm 的无菌打孔器制取菌饼3 块,接入装有50 mL PDA 液体培养基的150 mL 三角瓶中,于30℃、150 r/min 摇床培养7 d。将摇匀的发酵液于4 000 r/min 下离心10 min 后用无菌注射器吸取10 mL 上清液,混合菌液为不同菌种发酵液各吸取5 mL,经滤膜过滤,分别接入装有3 种可燃物样品的三角瓶中,25℃恒温静置培养7 d,每个菌株设3 个重复。
1.8 木质素含量的测定
采用纤维测定仪根据Van Soest[23]的方法测定木质素含量。经培养后的可燃物样品于65℃烘干至恒质量,放入装有灰化后的硅藻土的坩埚(40~100 μm)中。用中性洗涤剂(3%十二烷基硫酸钠溶液)在消煮管中加热消煮60 min。经消煮后,残渣由半纤维素、纤维素、木质素和硅酸盐组成。样品再用酸性洗涤剂(2%十六烷基三甲基溴化铵溶液)消煮60 min,剩余物为纤维素、木质素和硅酸盐。样品在室温下用12 mol/L 硫酸消解,剩余物干燥后称质量记为A,为木质素和硅酸盐。随后于550℃马弗炉中灰化2 h。冷却至室温后,剩余物称质量记为B,即硅酸盐的质量。木质素含量按(1)式计算:

1.9 数据处理
采用Microsoft Excel 2016 软件对数据进行处理,利用Origin 2018 软件进行作图和分析。
2 结果与分析
2.1 菌株分离纯化
MEA 培养基中含有链霉素硫酸盐,对细菌具有抗菌作用;而在培养基中加入邻苯基苯酚可以有效抑制霉菌的生长。根据不同菌落形态从样品中共分离纯化出9 个真菌菌种,分别编号为B1、B2、B3、B4、B5、B6、B7、B8 和Y3。
2.2 菌株初筛
在初筛实验中,共有5 株菌发生了显色反应,分别为B2、B3、B6、B7 与Y3。表1列出了5 株菌在PDA-愈创木酚平板上的显色情况,均为培养1 d 后开始显色,根据显色时间,菌株B2、Y3、B6 分泌木质素降解酶能力较强。如图1所示,发生显色反应的菌株都是在菌落圈呈较深的红色,菌落外圈颜色变浅,呈橙色。显色圈的面积实际上反映了木质素降解酶对木质素的降解能力,如果显色圈在菌落圈的外圈形成,则该菌株能降解木质素,因此以菌落圈与显色圈直径的比值(R/r)为判断依据可以评价单位菌株分泌木质素降解酶的能力,比值越小,说明单位菌株可能产生的酶作用能力越强[24]。通过比较菌落圈与显色圈比值(表1),本实验中菌株B6 和Y3 的R/r<1,初步判断该两株菌能优先降解木质素,且菌株B6 的R/r较小,说明该菌株所产木质素降解酶活力可能高于Y3,即降解木质素的能力强于Y3。

表1 PDA-愈创木酚平板显色反应结果及菌落圈与显色圈生长情况†Table 1 PDA-GU plate color reaction and the growth of colony and colored ring
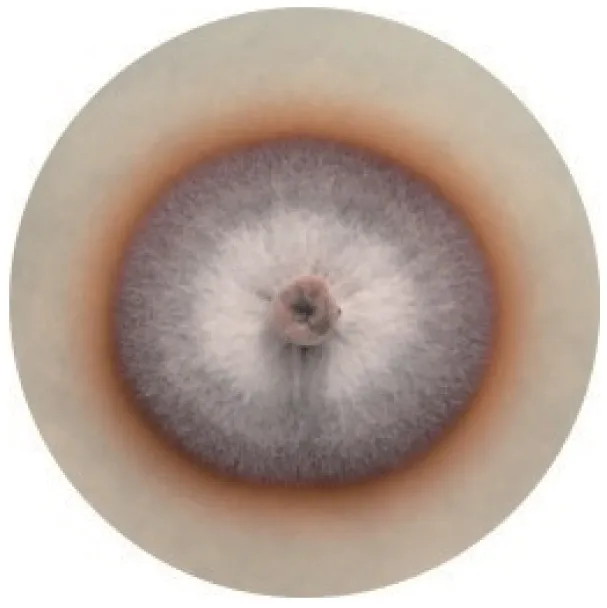
图1 PDA-愈创木酚平板显色反应Fig.1 PDA-GU color producing reaction
2.3 菌株复筛
对菌株B6、Y3 过氧化物酶系采用苯胺蓝平板脱色法进行定性检测。结果显示,2 株菌均能使培养基蓝色褪去:菌株B6 在培养基上生长旺盛,培养5 d 后,培养基蓝色全部褪去;菌株Y3 在培养2 d 后产生脱色圈,随后脱色圈不断扩大,最后整个平板蓝色全部褪去。脱色结果说明,在无木质素诱导物存在的情况下,菌株B6、Y3 对苯胺蓝均有较强的脱色能力,可确定此2 种菌均具有Lip和Mnp 酶活性。但根据平板脱色反应仅能初步判断菌株的产酶情况,要具体确定菌株木质素降解能力需进行木质素降解试验。
2.4 菌株鉴定
形态学鉴定:在PDA 培养基上于28℃恒温培养7 d 后,B6 菌落表面白色丝绒状,菌丝密集较短,放射延伸,菌落背面白色;Y3 菌落表面白色绒毛状,边缘整齐圆滑,菌丝致密,呈辐射状生长,菌落背面白色。Y3 经白桦枝条诱导产生担子果,担子果无嗅无味,子实层体褶状,放射状排列,菌褶边缘薄,全缘或稍撕裂状,菌褶灰白色。

图2 菌株B6 和Y3 的培养性状Fig.2 Culture characters of strains B6 and Y3
经过测序,得到B6 和Y3 的ITS 序列长度分别为650 和615 bp,将2 株菌的ITS 序列与Genbank 中的模式菌株及亲缘关系较近的菌株进行序列比对,用非加权组平均法(UPGMA 法)构建系统发育树(图3)。菌株B6 的rDNAITS 序列与Irpex lacteusvoucher KUC20121109-08(KJ668509.1)序列相似性为99%,并且位于系统发育树的同一分枝,结合形态学特征将其鉴定为白囊耙齿菌Irpex lacteus;菌株Y3 的rDNA-ITS序列与Lenzites betulinusisolate UTHSCSA DI16-473(KY313640.1)序列相似性为99%,并且位于系统发育树的同一分枝,结合形态学特征将其鉴定为桦褶孔菌Lenzites betulinus。
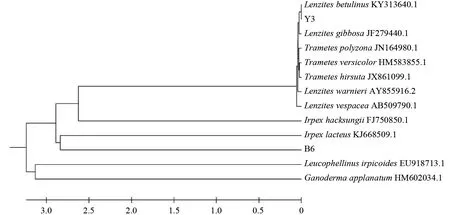
图3 菌株B6 和Y3 的rDNA-ITS 序列系统发育树Fig.3 rDNA-ITS phylogenetic tree of strains B6 and Y3
2.5 地表可燃物样品降解试验
由图4可知,7 d 降解试验后,3 种可燃物基质中木质素含量均有所下降。胡桃楸基质初始木质素含量为56.82%,经单一菌液B6、Y3 及混合菌液降解后下降到48.38%~55.08%,与对照相比分别下降了2.27%、11.02%与14.16%,混合菌液表现出更强的降解能力,相比对照,降解后的木质素含量显著降低(P<0.05)。水曲柳基质初始木质素含量为54.66%,在B6 菌液处理下为50.15%(与对照相比下降了8.05%),降解能力最弱,其次是Y3菌液,处理后的木质素含量为46.05%(与对照相比下降15.57%,P<0.05),经混合菌液培养后的木质素含量最低,下降到41.74%(与对照相比下降23.47%,P<0.05)。落叶松基质木质素含量在不同菌液处理后表现出与以上两种基质木质素含量相协同的高低分布,即加入混合菌液降解效果最好,相比对照,下降了8.69%(P<0.05),加入Y3 菌液降解效果次之(与对照相比下降5.42%),降解效果最差的为B6 菌液(与对照相比分别下降3.52%)。
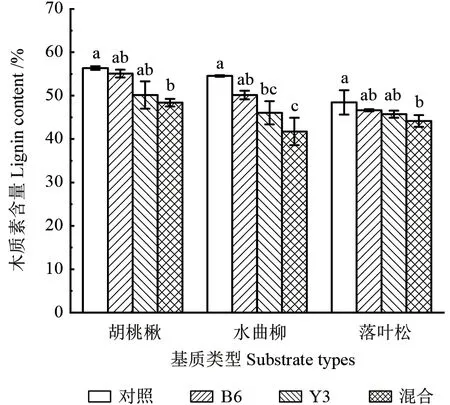
图4 经不同菌液培养后3 种基质的木质素含量Fig.4 The lignin content of three kinds of substrates after culture in different fungal suspensions
3 结论与讨论
Nishida 等[25]的研究表明,能在含有愈创木酚的PDA 培养基上产生显色圈的微生物具有降解木质素的能力。本研究采用该方法,在菌株初筛过程选用愈创木酚为检测木质素降解酶的定性指示剂的选择培养基,分离筛选出木质素降解菌。并且本研究以Ander 和Eriksson 的实验结果为依据,即菌落圈与显色圈直径的比值小于1 则该菌能优先降解木质素,比值大于1 则该菌优先降解纤维素[18],筛选出能优先降解木质素的菌种。在菌株复筛过程,本研究选用PDA-苯胺蓝培养基作为选择性培养基,进一步完成定性筛选。部分学者在筛选木质素降解菌时仅进行一次定性筛选[17],由于真菌对木质素的降解是通过木质素降解酶系中多种酶的相互协同作用的结果,主要有Lac、LiP和MnP,因此仅进行一次筛选并不能完全检测出以上3 种酶。本研究在初筛时筛选出具有Lac 活性的菌株,在复筛时筛选出具有LiP 和MnP 活性的菌株,以获得降解木质素综合能力强的真菌。
经菌株初筛与复筛获得的菌株B6 和Y3,在可燃物样品降解试验中有效降解了基质中的木质素,这表明木质素降解菌的降解能力与产酶能力密切相关。经单一菌液与两者混合菌液培养后,样品中木质素含量均有下降,且混合菌液处理后的3 种可燃物基质与单一菌液处理后的基质中木质素含量相比下降更多,表现出更好的降解效果。推测本研究中筛选出的菌株B6 和Y3 之间无拮抗作用并且能相互激发,促进了木质素降解酶活力,从而提高了木质素降解率。两种单一菌液相比,菌种Y3 对木质素的降解效果较菌种B6 好,说明菌种Y3 降解能力强于B6。此外,可燃物样品中木质素降解效果根据基质的不同而存在差异:水曲柳基质中木质素降解率最高,其次是胡桃楸基质,落叶松基质降解率最低,这与前人的研究结果一致,即阔叶可燃物比针叶可燃物易分解[26]。推测不同树种叶片中木质素含量本身存在差异,同时受其他养分含量的影响。对于木质素的降解,白腐真菌是最有效的降解者,同时也是已知的唯一能在纯系培养中有效地将木质素降解为CO2和H2O 的一类微生物[27]。以上说明,本研究中经筛选获得的两种木质素降解真菌B6 与Y3 均属于白腐真菌,能有效降解可燃物中的木质素,富集培养后施加菌液能够在一定程度上减少森林地表可燃物载量。
森林地表可燃物是一种潜在的火险源[28],加快森林可燃物分解能够在一定程度上降低森林火灾危害程度。虽然本研究中地表可燃物降解试验得到了较好的效果,但由于室内试验条件可控,野外环境影响因素较多,因此室内试验所得结果有一定局限性,经室内试验筛选出的菌株是否在野外仍具有较强的降解能力还需进一步验证。因此,进行野外降解试验,在自然条件下检验木质素降解菌对地表可燃物中木质素的降解能力;使木质素降解菌在野外条件下自然定植,从而形成优势菌群,达到高效降解地表可燃物中木质素的目的是后续研究的方向。利用微生物减少森林可燃物载量降低森林火险等级和火灾损失,是森林防火一个重要途径,同时为地表可燃物管理方法研究提供了新的方向。
