肿瘤-睾丸抗原联蛋白α2在肝细胞癌中的表达及临床意义的多组学研究
2021-03-03陈茂培董良庆林友培潘教孟宋国贺阿晔岭任正刚
张 娟, 陈茂培, 董良庆, 林友培, 潘教孟, 宋国贺, 阿晔岭, 张 舒, 高 强, 任正刚
复旦大学附属中山医院肝癌研究所,复旦大学癌变与侵袭原理教育部重点实验室,上海 200030
近年来,美国癌症研究所临床蛋白质组肿瘤分析计划(Clinical Proteomic Tumor Analysis Consortium, CPTAC)、癌症基因组图谱(The Cancer Genome Atlas,TCGA)、国际癌症基因组联盟(International Cancer Genome Consortium,ICGC)等大规模肿瘤研究计划的开展,及基因组、转录组、蛋白质组、免疫蛋白组学和生物信息学等组学技术的发展,快速地推动了肿瘤免疫的相关研究。肿瘤-睾丸抗原(cancer-testis antigen,CTA)是一类限制性表达在生殖细胞,而在其他正常人体组织中不表达或低表达,在多种肿瘤中异常表达的肿瘤相关抗原。生殖细胞不表达主要组织相容性复合体Ⅰ(major histocompatibility complex,MHC-Ⅰ),且天然存在的血睾屏障共同导致CTA基因产物不能与正常人的免疫系统接触,较少引起自身免疫反应,故CTA可作为肿瘤免疫治疗的理想靶点。1991年,研究人员[1]利用T细胞表位克隆技术在黑素瘤中发现第一个CTA:黑素瘤抗原A1(melanoma antigen-A1,MAGE-A1)。目前,已有276个CTA基因被发现,但几乎所有关于CTA的研究都仅限于mRNA表达水平。本研究首次从多组学鉴定肝细胞癌(hepatocellular carcinoma,HCC)中免疫治疗的新靶点联蛋白α2(catenin alpha 2,CTNNA2), 并探讨其作为HCC免疫治疗靶标的可行性。
1 资料与方法
1.1 一般资料 收集2013年至2015年复旦大学附属中山医院收治159例手术切除的HCC患者的新鲜标本,所有病例均经病理诊断证实。其中,男性128例,女性31例,年龄20~81岁,平均年龄为54岁。每例患者的手术标本在肝癌术后分别取癌组织和癌旁组织,并立即经液氮速冻后置液氮中保存,以备转录组测序技术(RNA sequencing,RNA-Seq)、串联质谱标签(tandem mass tag,TMT)定量蛋白组学、磷酸化组学富集及免疫蛋白组学和反转录-聚合酶链反应(RT-PCR)检测。
1.2 细胞培养 肝癌细胞株MHCC97H、MHCC97L、HCCLM3、PLC/PRF/5、Hep3B和正常细胞株(L02)来自复旦大学附属中山医院肝癌研究所。肝癌细胞株JHH6、SNU449、SNU354、SNU182由上海生命科学研究院高大明课题组惠赠。细胞培养采用Gibco DMEM培养基(含10%胎牛血清、100 U/mL青霉素和100 μg/mL 链霉素)于含5% CO2的37℃恒温培养箱培养。
1.3 总RNA提取 将手术后切取的肝癌组织和癌旁组织迅速放入液氮中,用TRIzol (Invitrogen,15596026)提取组织和细胞中的总RNA,采用紫外分光光度计测定A260/A280值。取2 μg 总 RNA进行反转录。cDNA 反应条件和反应体系参考试剂盒(TaKaRa)说明书。
1.4 RNA-seq定量基因组学 新鲜冷冻组织研磨后加入TRIzol中并纯化总RNA。在Agilent 2100 Bioanalyzer上检测RNA的完整性(RNA完整性数>5)。采用Sera-Mag oligo (dT)珠(Thermo Scientific)分离RNA和fragmentation reagents kit(NEB)快速片段化,并根据TruSeq RNA (Illumina)说明书,进行cDNA合成、末端修复、A尾添加和连接。最后在Agilent 2100生物分析仪上测量产品的大小和浓度。在Illumina Hi Seq X Ten(2 X 150-核苷酸读取长度)进行测序,序列覆盖4 000万个配对读长(reads)。对于每个HCC及癌旁样本,RNA-seq平均分别为40.1 M和39.1 M高质量读长。RNA-seq数据分析鉴定了19 860个蛋白质编码基因,平均每个样本有18 839个基因,涵盖了蛋白质组学鉴定中的绝大多数基因[2]。
1.5 TMT标记及高效液相色谱法(HPLC)分级 将肝癌组织和癌旁组织在液氮中研磨成粉末后进行裂解,采用过滤辅助样品制备(FASP)工艺进行蛋白质消化,多肽通过离心洗脱,用二喹啉甲酸(BCA)试剂盒进行蛋白浓度测定。采用真空离心干燥法对进一步的产物进行胰酶酶解成肽段。50对肝癌和癌旁样本混合样本作为TMT标记中使用的“内参”。 用FASP法制备混合样品中的肽,并对其进行了分离,每个离心管每套TMT标记实验加入400 mg作为内参。根据TMT试剂盒标记肽段:每组11个通道,每个通道用400 mg肽标记,混合肽被标记为126通道并作为内参,其他10个通道分别标记5对肝癌和癌旁样本。肽段采用高pH反向HPLC分级(色谱柱为Waters XBridge BEH300 C18 column)。质谱分析肽段采用HPLC Easy-nLC1000超高效液相系统分离,并同步使用Thermo Scientific QExactive Plus进行检测和分析。肽段分离后进行电离,然后进入Q ExactiveTM Plus质谱进行分析。肽段母离子及其二级碎片均采用Orbitrap(Thermo Fisher Scientific)检测和分析。二级质谱数据采用MaxQuant search engine(v.1.6.1.0)和Swissprot数据库检索,同时进行质谱质控[2]。
1.6 磷酸化肽段富集及分析 磷肽富集是根据High-Select Fe-NTA 试剂盒(Thermo Science,A32992)说明书,用200 mL负载缓冲液[(80% 乙腈(ACN),0.1%三氟乙酸(TFA)]溶解24个组的蛋白。将试剂盒中旋柱的树脂分成24个等份,并与每个肽组分混合,肽-树脂混合物在室温下孵育15 min,然后转移到过滤器尖端(Axygen,TF-20-L-R-S)。离心后取出上清液,然后用200 μL洗涤缓冲液(80% ACN,0.1% TFA)和200 μL H2O对吸附磷肽的树脂进行洗涤,去除非特异性吸附肽。用100 μL洗脱缓冲液(50% ACN,5% NH3,H2O)将磷酸肽从树脂中洗脱。收集洗脱液进行冰冻干燥进行质谱分析。磷酸化肽段采用Orbitrap(Thermo Fisher Scientific)检测和分析[2]。
1.7 免疫多肽组学鉴定MHC-1抗体结合的抗原多肽 依据Pierce 交联免疫共沉淀试剂盒(Thermo Scientific,26147)说明书,首先将肝癌组织和癌旁正常肝组织裂解后测蛋白浓度,每个样品取10 mg蛋白裂解液,对泛人类白细胞抗原Ⅰ(HLA-Ⅰ)分子进行免疫亲和纯化,4℃下将MHC-Ⅰ抗体 (Thermo Scientific,MA1-70111)与Pierce 蛋白 A/G琼脂糖交联柱中结合共价结合3 h,然后在交联柱中加入洗脱缓冲液洗脱HLA-Ⅰ蛋白。免疫沉淀后,用10%乙酸从纯化的MHC分子中洗脱多肽。用10 000相对分子质量过滤器进一步纯化洗脱肽,然后用真空离心法进行浓缩,在C18-based STAGE尖端上冻干脱盐。最后进行液相色谱-串联质谱(LC-MS/MS)分析,方法同以上蛋白组学。基于标准的Uniport数据库和具有IEDB数据库鉴定属于CTNNA2基因编码的抗原肽。本研究使用肿瘤睾丸数据库(CT database,http://www.cta.lncc.br/)的基因列表鉴定所有的CTA[3]。
1.8 RT-PCR检测CTNNA2 mRNA表达 采用RT-PCR法检测CTNNA2的表达。所用引物及扩增片段如下。CTNNA2上游引物: 5′-GGA CGC TAA CAG TGG AAA GG-3′;下游引物:5′-GAG TGG CTT GCT CTA CAG AGG-3′。内参GAPDH上游引物: 5′- GGA GCG AGA TCC CTC CAA AAT-3′;下游引物:5′- GGC TGT TGT CAT ACT TCT CAT GG-3′。PCR 反应条件:60℃退火30 s,扩增40个循环。
1.9 统计学处理 应用 SPSS 21.0 统计学软件进行数据分析,计数资料用率表示,组间比较采用卡方检验(n≥5)或连续校正卡方检验(1≤n<5),检验水准(α)为0.05。
1.10 蛋白相互作用调控网络构建 用STRING在线软件(http://www.string.db.org/)进行CTNNA2蛋白的相互作用网络分析。
2 结 果
2.1 蛋白基因组学提示CTNNA2在HCC高表达 目前,在肿瘤睾丸抗原数据库(CT Database,http://www.cta.lncc.br/)已有276个CTA被发现。本课题组前期对我院159例HCC组织和癌旁组织采用RNA-Seq定量转录组学和TMT定量蛋白组学方法等多组学策略,解析了HCC发生发展的分子机制,进一步发现有17种差异表达的CTA(图1A)。目前关于CTNNA2的研究甚少,且在肝癌中尚未报道。本研究结合TCGA RNA-seq(图2A)及Human Protein Atlas(HPA)数据库(图2B)发现,CTNNA2在HCC、神经胶质瘤、子宫内膜癌、结直肠癌、肾癌等肿瘤中表达水平相比其他肿瘤较高,提示其可能在肿瘤中表达。但是,CTNNA2在HCC中生物功能和临床意义仍不清楚,因此,本研究进一步分析其在HCC中的表达情况及临床意义。

图1 肝癌中CTNNA2在转录组学和蛋白组学中的差异分析A:肝癌中17个CTA在转录组学和蛋白组学中的差异分析;B:CTNNA2在转录组学和蛋白组学的表达阳性率, RNA-seq测序结果显示CTNNA2表达阳性率为80.5%(128/159),TMT定量蛋白组学显示 CTNNA2表达阳性率为54.7%(87/159);C:CTNNA2在转录组学和蛋白组学表达的相关性分析。

图2 在多种肿瘤里面的CTNNA2的mRNA和蛋白水平的表达情况A:CTNNA2在多种肿瘤的mRNA表达水平;B:CTNNA2在多种肿瘤的蛋白表达水平。
RNA-Seq结果(图1B)显示,在HCC癌组织中CTNNA2表达阳性率为80.5%(128/159), TMT定量蛋白组学显示,CTNNA2表达阳性率为54.7%(87/159),其中二者表达相关性的r为0.668(P<0.001,图1C)。二者的不一致说明了CTNNA2-RNA转录后的产物可能经转录后(如甲基化、剪接、加尾等)和翻译后加工修饰(蛋白降解和输出)的精细调控机制。RNA-Seq定量基因组学数据分析(图3A)提示,肝癌中CTNNA2在mRNA水平比癌旁组织表达水平较癌旁高11.24倍(P<0.001)。
同时,本研究收集了33对HCC癌组织和癌旁组织,CTNNA2在癌组织表达阳性率为54.5%,肝癌中CTNNA2在mRNA水平比癌旁组织升高15.23倍(P=0.049;图3B)。RT-PCR结果显示,CTNNA2在HCCLM3、Huh7、SNU449、SNU354、SNU182、PLC/PRF/5、Hep3B 肝癌细胞系中表达较正常肝癌细胞系L02表达水平明显升高(图3C)。TMT定量蛋白组学数据分析(图3D)提示,肝癌中CTNNA2在蛋白水平较癌旁表达高2.66倍(P<0.001),HPA数据库的免疫组化结果亦提示,CTNNA2在睾丸组织中高表达,在HCC组织中中等或高表达,而在正常肝中低表达(图4)。

图3 CTNNA2在HCC组织和肝癌细胞系中的表达A:RNA-seq定量转录组学数据提示CTNNA2在癌组织中较癌旁表达水平高;B:在33配对癌组织和癌旁组织中采用RT-PCR证实CTNNA2在癌组织中较癌旁表达水平高;C:CTNNA2在12种肝癌细胞系中的表达;D:TMT定量蛋白组学数据提示CTNNA2在癌组织中较癌旁表达水平高. *P<0.05,**P<0.01,***P<0.001与癌旁组比较。

图4 免疫组化结果显示CTNNA2在睾丸、正常肝和HCC中的表达Original magnification:×400
2.2 蛋白组学分析CTNNA2表达与HCC临床病理学特征的关系 CTNNA2蛋白表达水平与甲胎蛋白(P=0.019)、门静脉癌栓(P=0.028)显著相关。CTNNA2蛋白表达水平与HCC患者的年龄、性别、肿瘤大小和数量、TNM分期、BCLC分期等因素无明显相关性(表1)。

表1 CTNNA2蛋白表达与HCC临床病理学特征的关系 N=159
2.3 CTNNA2蛋白结构、相互作用蛋白和启动子的甲基化水平 CTNNA2蛋白是一种机械感应蛋白,包含2个长春花素同源结构域,在细胞骨架张力的作用下发生构象变化,从而改变钙黏蛋白与肌动蛋白细胞骨架之间的联系(图5),它与β连环蛋白(β-catenin)、γ-catenin、跨膜蛋白、E-钙黏蛋白(E-cadherin,ECAD)和p120共同构成黏附连接(AJ)复合物。
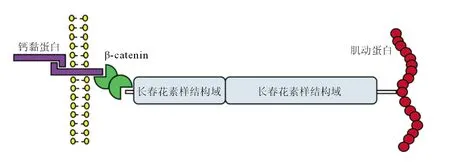
图5 联蛋白α2蛋白结构域
肿瘤细胞中CTNNA2基因发生突变后,其蛋白结构域发生改变不能与β-catenin连接成细胞黏附蛋白细胞骨架,导致细胞质中的β-catenin蛋白Ser552残基磷酸化后入核,增加其靶基因转录,进一步导致肿瘤侵袭和转移。
磷酸化组学结果(图6A)提示,HCC中CTNNB1的磷酸化水平较癌旁偏低(P<0.001)。进一步分析CTNNA2高表达的HCC患者中β-catenin蛋白Ser552残基的磷酸化水平,差异无统计学意义 (P=0.59,图6B)。据此本研究推测,在HCC中高表达的CTNNA2影响β-catenin蛋白Ser552残基的磷酸化可能不是其调控HCC的主要机制。同时本研究还首次检测到CTNNA2蛋白(Ser262、Ser321、Ser640、Ser651、Ser654、Ser667、Tyr653和Tyr657)多个磷酸化位点也发生变化(图6C)。
口咽鳞癌和砷暴露的尿路上皮癌中CTNNA2基因甲基化水平升高。然而本研究通过分析The Cancer Genome Atlas(TCGA)中HCC相关数据发现,HCC癌旁组织中CTNNA2启动子为正常甲基化表现,而癌组织中呈现去甲基化表现(P<0.001,图6D)。

图6 HCC中CTNNB1和CTNNA2蛋白的磷酸化水平及CTNNA2启动子的甲基化水平A:在HCC癌组织中β-catenin蛋白Ser552残基的磷酸水平较癌旁组织低;B:在CTNNA2高表达的癌组织中β-catenin蛋白Ser552残基的磷酸水平较癌旁差异无统计学意义;C:在HCC中CTNNA1编码的蛋白aN-catenin自身的磷酸化水平;D:在肝癌中CTNNA2的DNA启动子区呈低甲基化水平)。
STRING蛋白相互作用调控网络分析提示,与CTNNA2可能存在相互作用的蛋白有β-catenin(CTNNB1)、αE连环蛋白(CTNNA1,αE-catenin)、钙黏蛋白2(CDH2,cadherin-2)、钙黏蛋白4(CDH4,cadherin-4)、精子相关抗原9(SPAG9)、癌基因调节的细胞黏附蛋白(CDON)、细胞分裂周期蛋白42(CDC42)等(图7)。以上结果均提示,参与调控肝癌中CTNNA2基因和蛋白的功能可能与自身磷酸化、启动子区DNA甲基化及与其他多种蛋白相互作用相关,但其具体的生物学功能及其信号通路有待进一步实验证实。

图7 CTNNA2蛋白的相互作用网络分析
2.4 CTNNA2的免疫原性 MHC-Ⅰ参与CD8+T细胞的限制性识别,MHC-Ⅰ类分子将内源性衍生的多肽抗原呈递给CD8+T细胞,进一步诱导其特异性细胞毒性反应。本研究对29例HCC患者的肿瘤和13例癌旁组织进行免疫蛋白组学分析,结果(图8A)显示,与MHC-Ⅰ结合的抗原多肽共有30种,均为8个氨基酸大小,其中KAHVLAAS表达率最高,但其表达丰度偏低(图8B)。另外,IFHQEKSK、LANRFKEF、MRLLSHLK、PLLVLIEA、PVQALSEF、TKKTRDLR、TSLIQAAK、VKLVRMAA、VPLLVLIE和VRAARALL这10种抗原多肽只在HCC的癌组织标本中检测到,其中IFHQEKSK表达丰度最高。

图8 免疫多肽组学鉴定HCC癌组织中的CTNNA2抗原多肽A:MHC-Ⅰ免疫共沉淀的CTNNA2抗原多肽分析实验流程;B:CTNNA2丰度较高的抗原多肽质谱。
3 讨 论
原发性肝癌是我国第2位肿瘤致死病因及第4位常见恶性肿瘤,其中 85%~90%的原发性肝癌为HCC。目前,靶向治疗、免疫治疗或二者联合治疗在肝癌患者的有效应答率仍不太乐观。因此,新的免疫治疗靶点亟待发掘。免疫治疗中的CTA如MAGEA1、纽约食管鳞状上皮癌抗原1(NY-ESO-1)等已作为肿瘤疫苗进入HCC的临床试验中[4]。HCC是异质性最高的肿瘤之一,随着多组学技术的不断进步和发展,精准的肝癌免疫分子分型利于肝癌个体化诊断与个性化疫苗的免疫治疗[5]。
α-联蛋白属于跨膜细胞黏附分子家族。人α-联蛋白有3种亚型,分别由CTNNA1(αE-catenin)、CTNNA2(αN-catenin)和CTNNA3(αT-catenin)基因所编码。CTNNA2基因的定位于2号染色体p12上,基因DNA片段的长度为815 401 bp,含29个外显子,包含7个不同的mRNA转录本。αN-catenin主要表达于神经组织,控制突触接触的稳定性,调节突触、小脑和海马的层压的形态可塑性[6]。其中,αE-和αT-catenin由αN-catenin演化而来。αN-catenin是由860个氨基酸组成的蛋白质,相对分子质量为102 000。αN-catenin作为钙黏蛋白黏附受体与细胞骨架之间的连接子(图5),控制细胞与细胞的黏附和分化[7]。CTNNA2通过多种形式调控肿瘤的发生发展。从克隆进化角度来看,CTNNA2为9种肿瘤的亚克隆扩增的驱动因素[8]。全基因组测序和全基因组关联试验研究(GWAS)提示,乳腺癌和胰腺导管腺癌存在CTNNA2的缺失及内含子的突变[9-10]。
表观遗传学甲基化和乙酰化参与调控CTA的基因表达。口咽鳞癌和砷暴露相关的尿路上皮癌CTNNA2启动子甲基化水平升高。作为黏附分子家族的一员,CTNNA2与肿瘤的侵袭转移相关,microRNA-4885可以结合在CTNNA2的3′非翻译区(untranslated region,UTR)结合来降低CTNNA2基因的表达,并降低影响aN-catenin的表达抑制细胞黏附,促进减少食管癌细胞黏附,促进上皮-间充质转化(EMT)。CTNNA2突变与胃癌细胞中与黏附功能障碍相关。αN-catenin通过抑制NF-κB信号通路调控下游白介素8(IL-8)、前列腺素内过氧化物合酶 (环加氧酶,PTGS)、血管细胞黏附分子1(VCAM-1)和肿瘤坏死因子(TNF-α)等靶基因的表达,从而抑制神经母细胞瘤的生长和血管生成。研究人员证实CTNNA2是一种高突变的抑癌基因,他们首先通过外显子检测发现CTNNA2存在体细胞突变(CTNNA2-S132A和CTNNA2-E266*)。过表达CTNNA2突变体与敲低CTNNA2均抑制细胞生长和侵袭转移,蛋白印迹法检测和双荧光素酶报告基因实验证实,CTNNA2突变体蛋白的功能域结构改变,不能与β-catenin连接成细胞黏附蛋白细胞骨架,导致细胞质的β-catenin磷酸化入核,调控其靶基因TCF/LEF-1家族因子的转录,进一步上调生存素、c-Myc和细胞周期蛋白D1的表达[4]。然而,目前国内外尚未报道过CTNNA2在肝癌中的相关研究。
本研究从TCGA和HPA公共数据库中发现, CTNNA2在HCC中基因和蛋白水平癌旁或正常肝中表达升高,并通过本研究中心的基因组学、转录组及蛋白组学实验数据证实。临床病理学特征分析发现CTNNA2蛋白组学的表达与门脉癌栓(P=0.040),提示CTNNA2可能与肝癌的侵袭转移可能相关。并且,在58例AFP阴性(<200 μg/L)肝癌患者中,51例(32%)患者在蛋白水平上表达阳性,其中20例患者为CTNNA2高表达,故CTNNA2的表达可作为肿瘤标志物用于AFP阴性的肝癌的辅助诊断。CTNNA2 mRNA和蛋白高表达的患者预后不佳,以上结果均提示,CTNNA2在肝癌中可能是一个癌基因。
但本研究的磷酸化组学结果显示,HCC中β-catenin的Ser552残基磷酸化水平较癌旁偏低(图6A),且CTNNA2高表达的HCC患者中β-catenin蛋白Ser552残基的磷酸化水平偏低(图6B)。因此,可以推断β-catenin蛋白Ser552残基的磷酸化并非CTNNA2调控肝癌发生发展的机制。本研究还首次检测到CTNNA2蛋白多个磷酸化位点也发生变化(图6C),其具体的生物学功能需进一步验证。
DNA甲基化修饰的异常是肿瘤基因组最常见的表观遗传学改变之一,主要表现为全基因组广泛低甲基化与抑癌基因的高甲基化。基因启动子区的异常甲基化可以作为高灵敏度的肿瘤生物标志物用于肿瘤的早期诊断、疗效观察及预后判断。HCC癌组织中CTNNA2启动子区呈现去甲基化表现(图6D),癌组织中CTNNA2的高表达可能与启动子区的低甲基化相关,但仍需进一步的实验证实,且CTNNA2的甲基化水平作为肿瘤生物标志物也需要大样本人群的验证。
最后,免疫蛋白组学分析结果显示,30种CTNNA2抗原多肽可与MHC-Ⅰ结合(图8B),表达丰度偏高的IFHQEKSK可作为候选肿瘤疫苗,但仍需后续合成多肽诱导CD8+T细胞活化和杀伤肿瘤靶细胞和动物体内实验证实其免疫原性,并且在高表达CTNNA2的患者肿瘤和外周血中检测针对相应抗原多肽的特异性T细胞。肿瘤免疫浸润和T细胞有效杀伤是目前免疫治疗成功的关键。过继细胞疗法(adoptive cell transfer,ACT)包括嵌合抗原受体T细胞免疫疗法和T细胞受体(TCR)嵌合型T细胞(TCRT)疗法。二者均通过基因改造的手段提高T细胞对特异性肿瘤细胞抗原的识别和杀伤[11-12]。Stadtmauer等[13]最新报道,利用CRISPR技术,敲除编码内源性T细胞受体的TCRα和TCRβ以减少TCR的错配明显提高了其免疫原性。然而CART、TCRT、双特异性抗体(bispecific T-cell engager,BiTE)等发挥的免疫增强作用均依赖于识别肿瘤细胞表面的特异性抗原,CTNNA2可作为理想抗原进一步进行基因工程改造,进而成为有效的肿瘤免疫治疗手段之一[13-14]。
综上所述,本研究首次发现CTNNA2在HCC中表达,为其可能作为HCC的肿瘤疫苗提供了初步的理论探讨,然而,参与调控肝癌中CTNNA2基因的具体的生物学和免疫原性的功能有待后续进一步的实验证实。
