参苓白术散对伴焦虑腹泻型肠易激综合征模型小鼠的改善作用及机制
2021-03-02于洁琼彭思远凌茜文黄振辉褚夫江
于洁琼 彭思远 凌茜文 黄振辉 褚夫江


摘 要 目的:研究參苓白术散对伴焦虑腹泻型肠易激综合征(IBS-D)模型小鼠的改善作用,并从肠道微生态角度初步阐明其作用机制。方法:将C57 BL/6小鼠随机分为空白对照组、模型组、参苓白术散组(3.6 g/kg),每组8只。除空白对照组外,模型组和参苓白术散组小鼠以皮下注射皮质酮联合灌胃番泻叶水煎液及慢性束缚建立伴焦虑IBS-D模型。造模成功后,空白对照组、模型组小鼠灌胃给予生理盐水,参苓白术散组灌胃给予相应药物,连续给药4周。末次给药后,检测各组小鼠的稀便率、腹泻指数、体质量、糖水偏好百分比、穿过旷场中心区域次数、最小疼痛阈值和海马组织中内源性脑神经营养因子(BDNF)及血清中5-羟色氨(5-HT)的水平;提取各组小鼠盲肠内容物进行微生物DNA提取并测序,采用Alpha、Beta多样性分析法分析肠道微生物丰度及多样性。结果:与空白对照组比较,模型组小鼠体质量、糖水偏好百分比、穿过旷场中心区域次数、最小疼痛阈值、海马组织中BDNF水平和肠道中厚壁菌门微生物的相对丰度及Lachnospiraceae_NK4A136_group属微生物的相对丰度均显著降低(P<0.05);稀便率、腹泻指数、血清中5-HT水平和疣微菌门微生物的相对丰度、艾克曼菌属微生物的相对丰度均显著升高(P<0.05);肠道微生物种类差异较大。与模型组比较,参苓白术散组小鼠体质量、糖水偏好百分比、穿中心区域次数、最小疼痛阈值、海马组织中BDNF水平和肠道中厚壁菌门微生物的相对丰度、Lachnospiraceae_NK4A136_group属微生物的相对丰度均显著升高(P<0.05或P<0.01);稀便率、腹泻指数、血清中5-HT水平、疣微菌门微生物的相对丰度、艾克曼菌属微生物的相对丰度均显著降低(P<0.05);肠道微生物种类差异较大。结论:参苓白术散可改善伴焦虑IBS-D模型小鼠的腹泻和焦虑行为,升高其海马组织中BDNF水平,降低血清中5-HT水平;其作用机制可能与降低肠道微生物疣微菌门、艾克曼菌属微生物的相对丰度,升高厚壁菌门、Lachnospiraceae_ NK4A136_group属微生物的相对丰度有关。
关键词 参苓白术散;腹泻型肠易激综合征;焦虑;微生物;肠道
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)03-0314-06
DOI 10.6039/j.issn.1001-0408.2021.03.11
ABSTRACT OBJECTIVE: To study the improvement effect of Shenling baizhu powder on irritable bowel syndrome with diarrhea (IBS-D) model mice with anxiety, and to elucidate its mechanism from the point of view of intestinal microecology. METHODS: C57 BL/6 mice were randomly divided into blank control group, model group, Shenling baizhu powder group (3.6 g/kg), with 8 mice in each group. Except for blank control group, IBS-D model with anxiety was established in model group and Shenling baizhu powder group by giving corticosterone subcutaneously combined with intragastric administration of Folium Sennae decoction and chronic restraint treatment. After modeling, blank control group and model group were given intragastric administration of normal saline, and Shenling baizhu powder group was given relevant medicine intragastrically, for consecutive 4 weeks. After last medication, loose stools rate, diarrhea index, body weight, sugar water preference percentage, the times of crosssing open field center area and minimum pain threshold as well as the levels of BDNF in hippocampal tissue and 5-HT in serum were detected in each group. The cecal contents of mice in each group were extracted for microbial DNA extraction and sequencing; the abundance and diversity of intestinal microorganisms were analyzed by Alpha and Beta diversity analysis. RESULTS: Compared with blank control group, body weight, sugar water preference percentage, the times of crossing open field center area and minimum pain threshold as well as the levels of BDNF in hippocampal tissue, relative abundance of Firmicutes phylum microorganism in intestine, relative abundance of Lachnospiraceae_NK4A136_group genus microorganism were decreased significantly (P<0.05); loose stools rate, diarrhea index, serum level of 5-HT, relative abundance of Verrucomicrobia phylum microorganism and relative abundance of Ackermann phylum microorganism were increased significantly (P<0.05), and there were great differences in the types of intestinal microorganisms. Compared with model group, body weight, sugar water preference percentage, the times of crossing open field center area, minimum pain threshold, BDNF level of hippocampus, relative abundance of Firmicutes phylum microorganism, relative abundance of Lachnospiraceae_NK4A136_group genus microorganism were increased significantly (P<0.05 or P<0.01); loose stools rate, diarrhea index, serum level of 5-HT, relative abundance of Verrucomicrobia phylum microorganism and relative abundance of Ackermann phylum microorganism were decreased significantly (P<0.05), and and there were great differences in the types of intestinal microorganisms. CONCLUSION: Shenling baizhu powder can improve the diarrhea and anxiety behavior of IBS-D model mice with anxiety, increase the level of BDNF in hippocampus and decrease serum level of 5-HT. Its mechanism may be related to decreasing relative abundance of Verrucomicrobia phylum microorganism and Ackermann phylum microorganism, increasing the relative abundance of Firmicutes phylum and Lachnospiraceae_NK4A136_group genus microorganism.
KEYWORDS Shenling baizhu powder; Irritable bowel syndrome with diarrhea; Anxiety; Microorganism; Intestine
腹泻型肠易激综合征(Irritable bowel syndrome with diarrhea,IBS-D)属于中医学“泄泻”“腹痛”的范畴[1],具有病情复杂、迁延难愈的特点[2]。IBS-D患者由于病情反复,常伴有焦虑、抑郁等精神症状,其中IBS-D患者焦虑的共病率高达80%,且存在焦虑的患者也更容易发生IBS-D[3]。现代医学研究发现,IBS-D的发病与脑肠互动功能紊乱密切相关,而肠道微生态是脑肠互动的关键纽带;一旦肠道微生态失调可引发肠内敏感性增加,促使脑肠互动异常并最终诱发IBS-D[4-5]。临床研究表明,IBS-D患者血清中5-羟色胺(5-HT)及海马组织中内源性神经营养因子(BDNF)水平的异常增高与内脏敏感性具有密切关系[6-9],其中BDNF水平升高还可造成慢性疼痛、诱导焦虑和抑郁[10-11]。
参苓白术散来源于《太平惠民和剂局方》,由人参、茯苓、白术、白扁豆、山药、莲子、砂仁、薏苡仁、桔梗和炙甘草等组成[12],临床上常用于治疗慢性腹泻、消化性溃瘍、IBS-D、功能性消化不良、小儿厌食症等消化系统疾病[13],具有提高免疫力、调节肠道菌群、影响胃肠道分泌及吸收、修复黏膜等功能[14]。有研究表明,单用参苓白术散对IBS-D患者的腹泻情况具有明显的改善作用,且作用优于单用蒙脱石散[15]。另有研究者将参苓白术散与双歧杆菌三联活菌胶囊联用以治疗IBS-D,结果发现两者联合可更好地改善IBS-D的临床表现,并推测双歧杆菌对肠道菌群的调节作用可能是增强参苓白术散改善IBS-D作用的原因之一[16-17]。目前,针对参苓白术散改善IBS-D患者焦虑症状的研究较少,仅在个别临床病例观察中发现其具有改善IBS患者焦虑和抑郁的现象[18],因此其具体作用及相关机制尚不明确。
基于此,本课题组拟以皮下注射皮质酮联合灌胃番泻叶水煎液及慢性束缚建立小鼠伴焦虑IBS-D模型,通过检测小鼠糖水偏好百分比、旷场行为学、最小疼痛阈值、海马组织中BDNF和血清中5-HT水平,并基于肠道微生态角度研究参苓白术散对伴焦虑IBS-D模型小鼠的改善作用及机制,以期为临床用药提供参考依据。
1 材料
1.1 主要仪器
本研究所用的主要仪器有:5452型离心机(德国Eppendorf公司)、BSA123S-CW型电子分析天平(德国Sartorius公司)、JC-1型超净工作台(苏州净化设备有限公司)、DHG-9055A型电热鼓风干燥箱(上海一恒科学仪器有限公司)、MDF-U52V型超低温冰箱(日本SANYO公司)、DW-26L252型冰箱(青岛海尔股份有限公司)、FD50A型高压蒸汽灭菌锅(厦门致微仪器有限公司)、Model680型酶标仪(美国Bio-Rad公司)、ZH-ZFT型旷场仪(安徽正华生物科技有限公司)。
1.2 主要药品与试剂
本研究所用的主要药品与试剂有:番泻叶[北京同仁堂(毫州)饮片有限责任公司,批号20160274],参苓白术散(北京同仁堂制药有限公司,批号Z11020564,规格6 g×10袋),皮质酮粉剂(上海迈瑞尔化学技术有限公司,批号68787107,规格500 mg),5-HT、BDNF酶联免疫吸附试验(ELISA)试剂盒(上海酶联生物科技有限公司,批号20191204A、20191504A),磷酸盐缓冲液(美国Boster公司,批号11D16B30);水为纯净水。
1.3 动物
本研究所用的动物为SPF级雄性C57 BL/6小鼠,体质量为19~21 g,购于广东省医学实验动物中心,动物生产许可证号为SCXK(沪)2017-0005。所有小鼠饲养于广东药科大学实验动物中心,均自由摄食、饮水,实验过程遵守《广东药科大学实验动物管理条例》,实验方案经广东药科大学动物保护和使用委员会批准。小鼠均适应性喂养7 d后进行后续实验。
2 方法
2.1 分组、造模与给药
参考文献[19],取100 g番泻叶,加沸水400 mL浸泡0.5 h后,煮沸3 min,待溶液冷却后,用纱布过滤,取滤液于75 ℃水浴中蒸发浓缩,制成质量浓度为1 g/mL的番泻叶水煎浓缩液(以生药量计,下同),并于4 ℃保存备用,临用时将其用水稀释至0.3 g/mL。
将小鼠分为空白对照组(生理盐水)、模型组(生理盐水)、参苓白术散组(3.6 g/kg,剂量参考本课题组前期预实验结果设置),每组8只。除空白对照组外,模型组和参苓白术散组小鼠参考文献[20]造模。具体操作如下:小鼠每天皮下注射皮质酮(20 mg/kg),连续4周,于第2周起,每天禁食不禁水12 h后,灌胃给予番泻叶水煎液,然后使用胶带束缚其四肢、胸部及肩部1 h;每天皮下注射、灌胃及束缚各1次,持续操作3周。当小鼠出现明显精神不振、喜卧恶动并伴有腹泻的情况时,则表明造模成功。造模成功后,各组小鼠灌胃给予相应药物或生理盐水,连续给药4周。
2.2 腹泻情况和体质量测定
末次给药后,采用滤纸印迹法[21]测定并记录各组小鼠6 h内排便的总数以及稀便数(根据滤纸上有无污迹判断),并计算稀便率(稀便率=稀便数/粪便总数×100%)。根据滤纸上粪便污迹直径对稀便进行分级(1级为污迹直径<1 cm;2级为污迹直径1~<2 cm;3级为污迹直径2~<3 cm;4级为污迹直径3~<4 cm;5 级为污迹直径4~<5 cm)并计算腹泻指数(腹泻指数=稀便率×稀便分级)[21]。同时,测量各组小鼠的体质量。
2.3 糖水偏好百分比的测定
末次给药后,将各组小鼠禁水不禁食24 h,然后单笼放置进行糖水偏好实验。每笼小鼠同时供应2%蔗糖水溶液和水,喂养24 h后,测定此时糖水偏好百分比[糖水偏好百分比=蔗糖水溶液消耗量/(蔗糖水溶液消耗量+水消耗量)×100%]。
2.4 旷场行为学实验
参考文献[22],于糖水偏好實验后,将各组小鼠在实验环境中放置10 min,然后放置在旷场仪的中间,记录小鼠5 min内穿过旷场中心区域次数。
2.5 最小疼痛阈值的检测
旷场行为学实验后,各组小鼠禁食、禁水24 h,然后采用乙醚麻醉,再将涂有石蜡油且带气囊的6 F导尿管(导尿管连接1 mL注射器用于向气囊内注水)经肛门插入,使气囊末端距离肛门1 cm,并将其固定在小鼠的尾根部。然后将小鼠放入自制的透明塑料桶笼内(20 cm×6 cm×6 cm),以限制小鼠只能前后运动不能转身。待小鼠完全苏醒后先适应环境15 min,再记录引起小鼠疼痛的最小注水量,即最小疼痛阈值(以小鼠腹背部肌肉出现强烈收缩或腹部抬离地面作为其最小疼痛阈值表现[23]),以评价其内脏敏感性(最小疼痛阈值越大,敏感性越强)。各组小鼠重复测定3次,每次持续30 s,间隔5 min。
2.6 海马组织中BDNF和血清中5-HT水平的检测
最小疼痛阈值检测后,对各组小鼠吸入过量乙醚处死,收集其海马组织及腹主动脉血。将各组小鼠腹主动脉血以3 000 r/min离心15 min后,取上清液作为待测血清样本;称取各组小鼠海马组织10 mg,于冰上充分研磨后,以3 000 r/min离心15 min,取上清液作为海马组织待测样本。按照ELISA试剂盒说明书方法操作,采用酶标仪于450 nm波长处检测海马组织中BDNF和血清中5-HT的水平。
2.7 肠道微生物DNA的提取、测序及丰度和多样性分析
各组小鼠收集海马组织后,分别取3只置于无菌条件下,提取其盲肠内容物样品,委托北京百迈客生物科技有限公司进行DNA提取及16S rDNA高通量测序,并统计数据处理各阶段样品序列条目;分析各组小鼠肠道微生物丰度和多样性的差异,使用USEARCH 10.0软件在相似性97%(默认)的水平上对序列进行聚类[24],默认以测序所有序列数的0.005%作为阈值过滤OTUs。利用Alpha多样性分析法[25]分析各组小鼠盲肠内容物的稀释曲线(测序条数作为横坐标,并基于此测序条数经OTU聚类后得到OTU数量作为纵坐标)、Shannon指数曲线(测序条数作为横坐标,Shannon指数作为纵坐标)、等级丰度曲线(OTU数量作为横坐标,相对丰度作为纵坐标;若曲线越平滑下降则表明样本的多样性高,曲线越陡然下降则表明样本的多样性低)。基于QIIME 22020.6软件,利用Beta多样性分析法[25]分析各组小鼠盲肠内容物中肠道微生物多样性是否存在差异;在每组小鼠盲肠内容物样品经OTU聚类后的每个OTU中选取代表序列与微生物参考数据库[26-30]进行比对,得到每个OTU对应的物种分类信息,并找出各组样品中的共有微生物,进而在门(Phylum)、属(Genus)水平上统计各样品微生物群落组成。利用QIIME 22020.6软件生成不同水平上的物种丰度表,进行物种多样性分析(为使效果更好,笔者只选取相对丰度水平排前10位的物种,并将其它物种合并为“others”进行展示)。
2.8 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以x±s表示;组间两两比较,采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
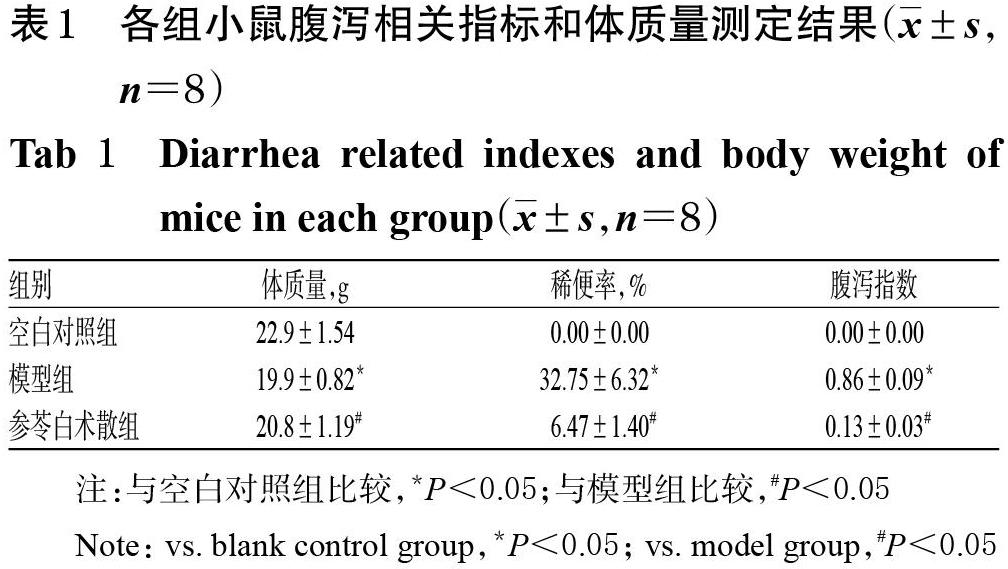
3.1 参苓白术散对伴焦虑IBS-D模型小鼠腹泻情况和体质量的影响
与空白对照组比较,模型组小鼠体质量显著降低(P<0.05),稀便率及腹泻指数显著升高(P<0.05);与模型组比较,参苓白术散组小鼠体质量显著升高(P<0.05),稀便率及腹泻指数均显著下降(P<0.05),详见表1。
3.2 参苓白术散对伴焦虑IBS-D模型小鼠糖水偏好百分比、穿过旷场中心区域次数和最小疼痛阈值的影响
与空白对照组比较,模型组小鼠糖水偏好百分比、穿过旷场中心区域次数和最小疼痛阈值均显著降低(P<0.05);与模型组比较,参苓白术散组小鼠上述指标均显著升高(P<0.05或P<0.01),详见表2。
3.3 参苓白术散对伴焦虑IBS-D模型小鼠海马组织中BDNF和血清中5-HT水平的影响
与空白对照组比较,模型组小鼠海马组织中BDNF水平显著降低(P<0.05),血清中5-HT水平显著升高(P<0.05);与模型组比较,参苓白术散组小鼠海马组织中BDNF水平显著升高(P<0.05),血清中5-HT水平显著降低(P<0.05),详见表3。
3.4 参苓白术散对伴焦虑IBS-D模型小鼠肠道微生物丰度和多样性的影响
3.4.1 Alpha多样性分析结果 空白对照组、模型组、参苓白术散组肠道微生物稀释曲线在测序条数20 000~40 000区间逐渐进入平台期,表明测序数据量可以反映样品中的物种多样性,并能间接反映样品中物种的丰富程度;Shannon指数曲线在测序条数10 000~40 000区间完全进入平台期,且参苓白术散组Shannon指数大于模型组,表明各组样品测序数据量足够大,且参苓白术散组小鼠肠道微生物的物种丰度高于模型组;参苓白术散组等级丰度曲线横坐标的OTU数量明显高于模型组,且整体曲线下降平缓,表明参苓白术散组小鼠肠道微生物的物种相对丰度及多样性高于模型组样品,详见图1。
3.4.2 Beta多样性分析结果 空白对照组与模型组小鼠盲肠内容物所含的肠道微生物种类差异较大,模型组与参苓白术散组小鼠肠道微生物种类差异较大,而参苓白术散组与空白对照组小鼠肠道微生物种类差异性较小,表明参苓白术散能够有效调节肠道微生物,详见图2(注:图中方块颜色越深,两组间差异越大)。
3.4.3 物种多样性分析 在门水平上,与空白对照组比较,模型组小鼠肠道中厚壁菌门微生物的相对丰度显著降低,疣微菌门微生物的相对丰度显著升高(P<0.05);与模型组比较,参苓白术散组小鼠肠道中厚壁菌门微生物的相对丰度显著升高,疣微菌门微生物的相对丰度显著降低(P<0.05)。在属水平上,与空白对照组比较,模型组小鼠肠道中艾克曼菌属微生物的相对丰度显著升高,Lachnospiraceae_NK4A136_group属微生物的相对丰度显著降低(P<0.05);与模型组比较,参苓白术散组小鼠肠道微生物艾克曼菌属微生物的相对丰度显著降低,Lachnospiraceae_NK4A136_group属微生物的相对丰度显著升高(P<0.05),详见表4。
4 讨论
参苓白术散来自《太平惠民和剂局方》,可用于治疗脾胃虚弱、饮食不进、多困少力、中满痞噎、心忪气喘、呕吐泄泻及伤寒咳噫[12-13]。IBS-D属“泄泻”“腹痛”范畴,其主要由外邪、饮食所伤、情志不畅等导致脾胃虚弱所引起[1]。在临床使用中发现,参苓白术散单用时可改善IBS-D患者的症状与体征[9]。本研究结果也证实,参苓白术散能够有效地改善IBS-D小鼠的腹泻情况,降低小鼠的稀便率、腹泻指数,同时增加其体质量。
焦虑、抑郁等精神心理因素与IBS-D的发生存在直接关系,肝气郁结、脾失运化成为伴焦虑IBS-D的主要病因病机[31]。参苓白术散由人参、茯苓和白术组成君药,起益气渗湿健脾的作用[12],其中的人参在单用及组方使用时均具有明确的抗焦虑作用[32]。本研究结果表明,参苓白术散可升高伴焦虑IBS-D模型小鼠的糖水偏好百分比、穿过旷场中心区域次数和最小疼痛阈值,有效地改善了其焦虑行为。
BDNF是脑内促神经生长的活性蛋白质,在焦虑状态下,BDNF的表达水平会明显升高[10-11]。5-HT是一种重要的脑肠肽,相关研究发现,5-HT信号系统与IBS-D关系密切,且IBS-D患者的焦虑、抑郁评分与5-HT含量呈正相关[6-9]。本研究结果发现,参苓白术散能够显著升高小鼠海马组织中BDNF水平,显著降低血清中5-HT水平,这与高春波等[33]研究结果一致。
IBS-D的发生与脑-肠轴功能紊乱密切相关,即中枢神经系统与外周可双向调控胃肠道功能,导致内脏高敏,从而引起患者出现腹痛腹泻等临床症状[4]。其中,肠道微生物在脑-肠轴调节中发挥着关键作用,会对宿主的应激反应、焦虑、抑郁和认知功能产生重要影响[4-5]。本研究发现,模型组与参苓白术散组小鼠肠道微生物种类差异较大,参苓白术散组与空白對照组小鼠肠道微生物种类差异较小,表明参苓白术散能调节小鼠肠道微生物的丰度与多样性,在门水平上,其可显著升高小鼠肠道微生物厚壁菌门微生物的相对丰度,显著降低疣微菌门微生物的相对丰度;在属水平上,可显著升高Lachnosiracea_NK4A136_group属微生物,显著降低艾克曼菌属微生物的相对丰度。
综上所述,参苓白术散可有效改善伴焦虑IBS-D模型小鼠的腹泻、焦虑行为,并升高其海马组织中BDNF水平,降低血清中5-HT水平;其作用机制可能与降低肠道中疣微菌门、艾克曼菌属微生物的相对丰度,升高厚壁菌门、Lachnospiracea_NK4A136_group属微生物的相对丰度有关。后续本课题组拟结合微生物基因组学和代谢组学分析联合应用等技术,进一步阐明参苓白术散改善伴焦虑IBS-D的作用机制。
参考文献
[ 1 ] 周峰.腹泻型肠易激综合征的中医药治疗进展[J].湖南中医杂志,2019,35(3):153-156.
[ 2 ] 罗秀清.腹泻型肠易激综合征的中医外治法治疗研究近况[J].中医药通报,2019,18(5):69-72.
[ 3 ] 陆佳,史丽丽,朱丽明,等.焦虑及其结构因子与腹泻型肠易激综合征患者症状的相关性[J].胃肠病学,2019,24(12):734-740.
[ 4 ] 何力,杨力,凌志维,等.基于脑肠交互机制探讨肠道微生物调节IBS-D内脏高敏的研究进展[J].中国实验方剂学杂志,2019,25(11):224-229.
[ 5 ] ZHOU QQ,VERNE GN. New insights into visceral hypersensitivity:clinical implications in IBS[J]. Nat Rev Gastroenterol Hepatol,2011,8(6):349-355.
[ 6 ] 张川,李定国,王彝康,等.肠易激综合征患者5-羟色胺含量的变化[J].上海第二医科大学学报,2001,21(1):66-68.
[ 7 ] 詹丽杏,许国铭,李兆申,等.肠易激综合征患者活动期和缓解期血浆5-HT、5-HIAA的变化[J].第二军医大学学报,2003,23(2):152-154.
[ 8 ] 夏頔,刘希双,鞠辉.肠易激综合征患者肠黏膜SP、SPR和5-HT的变化[J].世界华人消化杂志,2009,17(30):3169-3173.
[ 9 ] 李运红,朱晓蕾,徐肇敏.腹泻型肠易激综合征患者结肠黏膜5-羟色胺和5-羟色胺3受体的研究[J].胃肠病学,2006,11(8):477-480.
[10] ZHENG Z,ZENG Y,YANG W,et al. Irritable bowel syndrome may be induced by decreased neuroplasticity[J]. Neuro Endocrinol Lett,2014,35(8):655-665.
[11] YU YB,ZUO XL,ZHAO QJ,et al. Brain-derived neurotrophic factor contributes to abdominal pain in irritable bowel syndrome[J]. Gut,2012,61(5):685-694.
[12] 杨凡.参苓白术散临床研究进展[J].新中医,2018,50(10):46-50.
[13] 李方圆,邓明飞.参苓白术散在消化系统肿瘤的临床应用进展[J]. 新疆中医药,2018,36(2):130-132.
[14] 陈明冰,谢胜,戴文杰,等.参苓白术散在消化系统疾病中的应用及机制研究进展[J].辽宁中医药大学学报,2018(10):164-166.
[15] 李倩,蒋军林.参苓白术颗粒治疗腹泻型肠易激综合征80例临床观察[J].中医药导报,2013,19(5):41-42.
[16] 李广宣.参苓白术散联合双歧三联活菌胶囊治疗腹泻型肠易激综合征临床观察[J].实用中医药杂志,2018,34(11):1332-1333.
[17] 魏冬梅.参苓白术散联合匹维溴铵、双歧杆菌三联活菌胶囊治疗腹泻型(脾虚湿阻证)肠易激综合征的临床研究[D].杭州:浙江中医药大学,2015.
[18] 王红霞,朱永钦,付凯.参苓白术散治疗肠易激综合征脾虚湿盛证的临床研究[J].黑龙江中医药,2018,47(2):27-29.
[19] 肖新云,邓艳玲,刘又嘉,等.番泻叶所致脾虚泄泻小鼠血常规的研究[J].湖北中医药大学学报,2016,18(6):49- 51.
[20] ZHAO YN,MS R,SHEN J,et al. A mouse model of depression induced by repeated corticosterone injections[J]. Eur J Pharmacol,2008. DOI:10.1016/j.ejphar.2007.12.005.
[21] 黄玉珍.参苓白术散对脾虚泄泻幼鼠模型肠黏膜屏障的影响[D].南京:南京中医药大学,2016.
[22] LU XY,ROSS B,SCANCHEZ-ALAVEZ M,et al. Phenotypic analysis of GalR2knockout mice in anxiety and depression related behavioral tests[J]. Neuropeptides,2008,42(2):387-397.
[23] ED AL,KAWASKI M,PASRICHA PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development[J]. Gastroenterology,2000,119(5):1276-1285.
[24] ROBBERT CE. UPARSE:highly accurate OTU sequen- ces from microbial ampliconreads[J]. Nat Methods,2013,10(10):996-998.
[25] GRICE EA,KONG HH,SEAN C,et al. Topographical and temporal diversity of the human skin microbiome[J].Science,2009,324(5931):1190-1192.
[26] CALLAHAN BJ,MCMURDIE P,ROSEN M,et al. DADA2:high-resolutionsample inference from Illumina amplicon data[J]. Nat Methods,2016,13(7):581-583.
[27] K?LJALG U,LARSSON KH,ABARENKOVK,et al. UNITE:a databaseproviding web-based methods for the molecular identification of ectomycorrhizal fungi[J]. New Phytol,2005,1 66(3):1063-1068.
[28] DESANTIS TZ,HUGENHOLTZ P,LARSEN N,et al. Greengenes,achimera-checked 16SrRNA gene database and workbench compatible with ARB[J]. Appl Environ Microbiol,2006,72(7):5069-5072.
[29] JORDEN AF,BENLI C,QIONG W,et al. FunGene:the functional gene pipeline and repository[J]. Front Micro- biol,2013. DOI:10.3389/fmicb.2013.00291.
[30] ?PIK M,VANATOA A,VANATOA E,et al.The online database MaarjAM reveals global and ecosystemic distribution patterns in arbuscular mycorrhizal fungi(Glomeromycota)[J]. New Phytol,2010,188(1):223-241.
[31] 舒勁,李花,武正权.腹泻型肠易激综合征伴焦虑抑郁状态的中西医诊治进展[J].西部中医药,2019,32(9):147- 150.
[32] 倪小虎,白洁,孙喜春,等.高架十字迷路课题中人参根和茎叶皂苷抗焦虑效果的研究[J].中草药,2001,32(3):48-51.
[33] 高春波.参苓白术散加艾灸治疗腹泻型肠易激综合征的临床观察[J].陕西中医,2016,37(8):944-945.
(收稿日期:2020-09-18 修回日期:2020-12-18)
(编辑:唐晓莲)
