烟酰胺磷酸核糖转移酶在大肠杆菌中的表达及催化合成烟酰胺单核苷酸
2021-03-02廖一波吴旻晖梁书利林影
廖一波,吴旻晖,梁书利,林影
(华南理工大学生物科学与工程学院,广东广州 510006)
近年来,具有调节Ⅲ型蛋白赖氨酸脱乙酰酶(Sirtuins)活性能力的烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD)被认为具有治疗癌症、帕金森病、肥胖、糖尿病及其他衰老相关疾病的潜力,NAD是Sirtuins唯一的底物,NAD的水平高低直接决定了Sirtuins家族的活性,而Sirtuins活性又对细胞寿命有着重要的影响[1-5]。但NAD难以直接进入细胞,因此需要通过补充其前体来提高NAD在细胞中含量,从而起到抗衰老等作用。在NAD各前体中,NMN在口服管饲小鼠实验中提高胞内NAD的效果最佳,30 min内NMN可以被迅速吸收并有效转化为主要代谢组织中的NAD,因此适合作为NAD补充剂[4,5]。NMN广泛存在于蔬菜、真菌、肉类和虾中等天然食物中,且在长时间干预期中,NMN未显示有任何明显的毒性和副作用,具有较高的食品安全性[6]。加工特性研究发现,NMN在水中或乳中,75 ℃处理5 min,活性稳定;95 ℃处理5 min后活性损失约20%,表明在巴氏杀菌乳中添加NMN具有可行性。日本的Megumi开发了NMN与白藜芦醇的食物组合物,实验表明具有可以降低血液中总胆固醇含量、减少血液中尿酸含量等作用[4,6,7]。
生产NMN的方法中,生物酶法因无有机溶剂残留也不存在手性问题,成为最环保无公害的生产方法。然而利用生物酶法生产NMN仍然存在一些限制。Nampt催化烟酰胺和磷酸核糖焦磷酸合成NMN,但已报道的来源较少。Emmanuel的研究表明在ATP水解与NMN合成的弱偶联下,人源的Nampt合成NMN的系统催化效率可以提高了1100倍,与底物NAM亲和力也大幅度增加[8]。近年来也有表达Nampt应用于生产NMN的研究报道,George在大肠杆菌中单独过表达分别来源于Mus musculus,Shewanella oneidensis和Haemophilus ducreyi的Nampt,补加底物NAM,边发酵边生产NMN。其中过表达Haemophilus ducreyi来源的Nampt的大肠杆菌NMN产量可达14.33 mg/L培养液[9]。筛选和表达一个酶学性质优良、稳定的Nampt酶,成为生物酶法合成NMN的关键。
本研究采用大肠杆菌系统表达来源Meiothermus ruber的Nampt,该酶在前期经过同源建模以及和底物小分子NAM的分子对接等一系列手段进行评估,发现来源于嗜热菌Meiothermus ruber可能是高效稳定催化生产NMN的酶元件。本研究采用大肠杆菌系统表达来源Meiothermus ruber的Nampt,在测定该酶酶学特性的基础上进行单酶催化生产NMN,旨在挖掘一个酶学性质优良、稳定的Nampt,为NMN酶法合成提供研究基础。
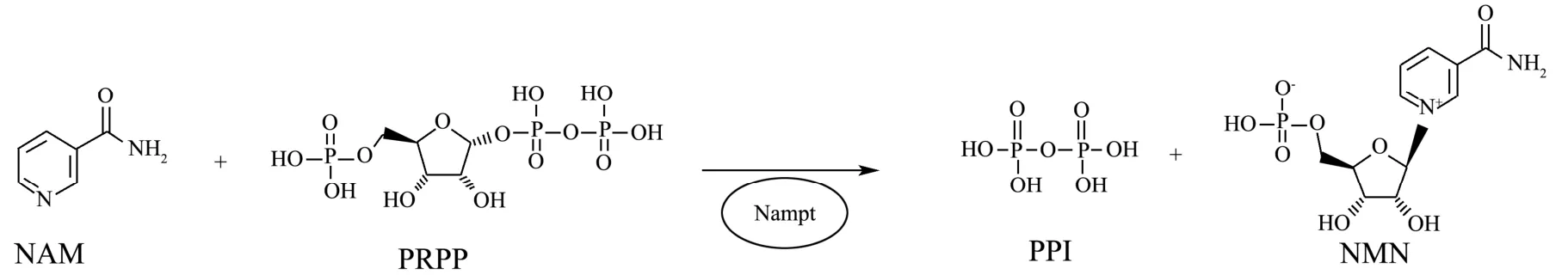
图1 Nampt催化反应示意图Fig.1 Schematic of Nampt-catalyzed reaction
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
克隆宿主菌Escherichia coliTop10、表达宿主菌E. coliBL21(DE3)、表达载体pET-30a(+)由华南理工大学生物科学与工程学院微生物酶学实验室保存。
1.1.2 主要试剂和培养基
限制性内切酶NdeⅠ和NotⅠ、KOD DNA聚合酶、DNA Marker、标准分子量蛋白质购自TaKaRa公司;Bradford蛋白浓度测定试剂盒购自GeneRay公司;IPTG、质粒提取试剂盒,凝胶回收试剂盒购自Magen公司;卡那霉素(KAN)购自上海生工生物工程有限公司;烟酰胺购于Sigama公司,磷酸核糖焦磷酸购于上海阿拉丁生化科技股份有限公司,其余试剂均为分析纯。
1.1.3 仪器与设备
SKY2102S小容量恒温培养摇床,上海速坤仪器仪表有限公司;5804R型高速冷冻台式离心机,德国Eppendorf公司;AKTA蛋白纯化系统,美国通用电气公司;PCR仪,德国Eppendorf公司;HisTrap FF crude预装柱,美国通用电气公司;多功能酶标仪,瑞士Tecan公司。
1.2 方法
1.2.1 pET-30a(+)-nampt载体构建及鉴定
从NCBI上找到来源Meiothermus ruber的Nampt的氨基酸序列(GenBank:ADD29592.1),对编码的基因进行密码子优化,优化后的基因合成由上海捷瑞生物工程有限公司完成。在基因上下游分别引入NdeⅠ和NotⅠ这两个限制性核酸内切酶位点,基因N端引入6*His-Tag标签,将合成的基因克隆至pET-30a(+)的NdeⅠ和NotⅠ位点间,获得的重组质粒命名为pET-30a(+)-nampt。对重组质粒进行双酶切鉴定及测序再次确定后,将鉴定后的质粒转入E.coliBL21(DE3)感受态细胞,在卡那霉素抗性平板上挑取单菌落培养,提取质粒并双酶切鉴定,将验证正确的菌种于-80 ℃甘油管保藏。
1.2.2 目的蛋白的表达、纯化及SDS-PAGE分析
挑取活化的重组大肠杆菌BL21(DE3)/pET30a(+)-nampt单菌落于10 mL含50 μg/L卡那霉素的LB液体培养基中,37 ℃,200 r/min,培养12~15 h。将过夜培养的菌液按2%的接种量转接至100 mL含50 μg/L卡那霉素的LB液体培养基中,37 ℃,200 r/min培养至OD600约为0.6~0.8。加入1 mol/L IPTG至终浓度为0.20 mmol/L,16 ℃,180 r/min条件下诱导培养21 h。
将发酵液7800 r/min离心7 min,弃上清后,用蒸馏水将菌体洗涤1次后加入10 mL Buffer A缓冲液悬浮细胞。在冰浴条件下利用超声波细胞破碎机对重组大肠杆菌进行破碎,破碎条件:6 mm变幅杆,40 min,10 mL菌体悬浮液。对破碎后的悬浮液进行冷冻离心,10000 r/min,4 ℃,30 min,分离上清和沉淀,4 ℃保存待用。
利用Ni亲和层析的方法,对预处理后的菌体破碎上清进行纯化。安装好Ni柱(His TagTMFF),用4倍柱体积的超纯水冲洗至基线平,接着用Buffer B冲洗至基线平,再用Buffer A清洗至基线平,然后以恒定3 mL/min的流速上样,最后以一定浓度的Buffer B(预实验中确定最佳浓度为80%)将目的蛋白洗脱并收集。用5倍柱体积的超纯水冲洗至基线平,最后20%乙醇冲洗保存柱子和系统,卸柱,关闭系统,卸下的柱子置于4 ℃冰箱保存。纯化后样品进行SDS-PAGE分析。
1.2.3 酶活力测定
采用荧光检测法测定Nampt酶活性[9,10]。
酶反应体系:1.5 mL离心管中加入3.45 μL 1 mol/L Tris-HCl、1.38 μL 1% BSA、0.83 μL 1 mol/L MgCl2、1.38 μL 0.1 mol/L ATP、0.28 μL 0.1 mol/L PRPP、1.38 μL 0.1 mol/L二硫苏糖醇、58.10 μL纯水、1.5 μL稀释一定倍数的纯酶液、0.69 μL 200 μmol/L NAM。在恒温震荡仪中反应,45 ℃,15 min。设置纯水代替酶液的反应体系为空白对照。
中止酶反应:将离心管于95 ℃水浴1 min灭活酶。
产物NMN衍生物反应:往离心管中加入27.7 μL 2 mol/L KOH,再加入27.7 μL 20%苯乙酮,短暂涡旋混匀后置于冰中充分冰浴2 min。加入125 μL 88%甲酸,低速短暂离心,在恒温震荡仪中反应,37 ℃,10 min。
测定荧光:吸取离心管中240 μL液体至黑色96孔板测定孔中,用Tecan多功能酶标仪在激发光382 nm,发射光445 nm下测定荧光。
标准曲线:配置若干个0~1 μmol/L浓度梯度的NMN水溶液,每个69 μL。每个离心管中加入27.7 μL 2 mol/L KOH,再加入27.7 μL 20%苯乙酮,短暂涡旋混匀后置于冰中充分冰浴2 min。加入125 μL 88%甲酸,低速短暂离心,在恒温震荡仪中反应,37 ℃,10 min。吸取离心管中240 μL液体至黑色96孔板测定孔中,用Tecan多功能酶标仪在激发光382 nm,发射光445 nm下测定荧光。以纯水作为空白对照。根据NMN浓度和对应的荧光值作标准曲线。
计算:结合测定荧光值和标准曲线计算酶活。酶活力单位(1 U)定义为:在上述条件下,每分钟生成1 μmol产物NMN所需的酶量。
1.2.4 Nampt最适温度、最适pH、热稳定性研究
为确定温度对酶活的影响,在pH 8.0条件下,测定不同温度下(20、25、30、37、40、45、50、60、65、70 ℃)Nampt的酶活力。以超纯水为空白对照,每个样品平行操作三次,绘制温度-相对酶活力曲线。为确定pH对酶活的影响,在45 ℃条件下,测定在不同pH条件下(5、5.5、6、6.5、7、7.5、8、9、10)Nampt的酶活力。以纯水代替酶液的反应体系为空白对照,每个样品平行操作三次,绘制pH-相对酶活力曲线。
为确定该酶的热稳定性,在45 ℃,pH 6条件下,测定相同浓度的酶在不同温度(45、50 ℃)下保温不同时间(15、30、60、90、120 min)的残余酶活力,以0 min未处理的酶液酶活作为100%,以相对酶活力为纵坐标,每个试验点重复三次测定,绘制时间-残余酶活曲线。
为确定该酶的pH稳定性,在45 ℃,pH 6条件下,测定相同浓度的酶在不同pH(5.5、6.0、6.5)下保温不同时间(15、30、60、90、120 min)的残余酶活力,以0 min未处理的酶液酶活作为100%,以相对酶活力为纵坐标,每个试验点重复三次测定,绘制时间-残余酶活曲线。
1.2.5 动力学参数测定
为测定烟酰胺(NAM)作为底物时Nampt的动力学参数,按照“1.2.3”反应体系与方法,设置若干个不同底物NAM浓度(0.039~20 μmol/L)的反应体系。以纯水代替酶液的反应体系为空白对照,使用双倒数作图法,将酶促反应速度的倒数对底物NAM浓度的倒数的作图,得到Km及Vmax值。
1.2.6 Nampt单酶催化生产NMN
反应在2 mL离心管内进行。反应体系为1.5 mL,主要包括终浓度为50 mmol/L Tris-HCl pH 6、0.1 mmol/L NAM、0.1 mmol/L PRPP、12 mmol/L MgCl2、2 mmol/L ATP、一定量的Nampt酶。45 ℃下反应,每隔一定时间取样,根据“1.2.3”方法测定荧光值,以计算NMN的产量。
1.2.7 数据统计分析
酶活力测定以及反应合成NMN设置三个平行,数据值为三个平行样品的平均值,用误差线表示标准偏差。
2 结果与讨论
2.1 重组质粒pET-30a(+)-nampt的构建及鉴定

图2 重组质粒pET-30a(+)-nampt的双酶切鉴定与序列测定结果Fig.2 Identification of recombinant plasmid pET-30a (+)-nampt by enzyme digestion and sequence determination results

图3 SDS-PAGE分析Nampt表达与纯化Fig.3 SDS-PAGE analysis of Nampt expression and purification
将合成的基因克隆至pET-30a(+)获得重组质粒,对构建好的质粒进行双酶切鉴定,结果如图2a:双酶切产物的大小分别有约5000 bp及约1500 bp的条带,与预期大小相符。将重组质粒,送至上海生工生物工程有限公司进行测序,测序结果与密码子优化的目的基因nampt比对结果如图2b所示,可以得出结论pET-30a(+)-nampt构建成功。将鉴定后的质粒转入E.coliBL21(DE3)感受态细胞,在卡那霉素抗性平板上挑取单菌落培养,提取质粒并双酶切鉴定,将验证正确的菌种于-80 ℃甘油管保藏。
2.2 目的蛋白的诱导表达、纯化、比酶活测定
根据方法“1.2.2”对Nampt酶重组菌进行发酵,重组BL21(DE3)/pET30a(+)与BL21(DE3)/pET-30a(+)-nampt发酵后离心收集菌体,经超声破碎仪破碎后,将细胞破碎液在10000 r/min,4 ℃条件下离心60 min,并收集离心上清液。上清液利用AKTA蛋白纯化系统进行纯化,其中80% Buffer B条件下洗脱的收集液为纯化酶液。分别对粗酶液、Ni柱纯化样品等进行SDS-PAGE蛋白电泳分析,结果如图3所示,分析可知SDS-PAGE电泳胶图中纯化样品在接近55 ku处有单一条带,与目的蛋白预期大小相符。根据方法“1.2.3”,在pH 6,45 ℃下测定Nampt纯酶的比酶活为3.20 U/mg。
2.3 Nampt的最适pH和温度、热稳定性研究
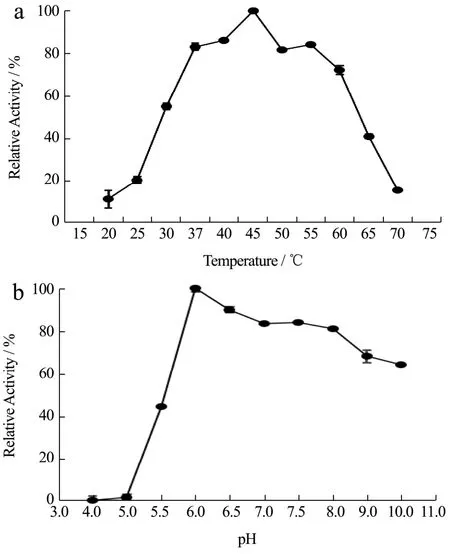
图4 温度和pH对Nampt酶活力的影响Fig.4 Effect of temperature and pH on the activity of Nampt
根据方法“1.2.4”,测定pH和温度对Nampt活性的影响,图4 a结果表明:Nampt在45 ℃的条件下酶活最高,且在37~55 ℃较宽范围内相对酶活力在80%以上,可以保持稳定的酶活力。在20~25 ℃下Nampt的相对酶活力低于20%,65~70 ℃下Namtpt的相对酶活力低于40%。图4 b表明,Nampt在pH 6的条件下酶活最高。在pH 4~5几乎检测不到酶活力,在pH 6~8较宽范围内,可以保持较高的酶活力(高于80%)。在较宽范围的温度和pH下,该酶相对酶活力保持较高水平,有利于此后应用于生产NMN时对温度和pH波动的适应性。
热稳定性方面,图5结果表明,在最适反应温度45 ℃和附近较高的温度50 ℃下水浴保温处理,保温不同时间测定的残余酶活显示,在120 min时,Nampt的残余酶活仍然在80%以上,热稳定性良好,有利于生产NMN过程中酶催化剂能够长时间保持相对稳定。
pH稳定性方面,在最适反应pH 6.0及附近pH 5.5和6.5条件下,于45 ℃水浴保温处理,测定保温不同时间的残余酶活。结果如图6,在pH 6.0和6.5条件下,120 min时Nampt的残余酶活仍然分别在80%和70%以上,pH稳定性良好。但是在pH 5.5条件下,15 min时残余酶活低于50%,90 min以后残余酶活低于20%。pH稳定性结果表明,该Nampt在最适pH 6.0及略大的pH 6.5条件下稳定性良好,但在略小的pH 5.5条件下,短时间酶活损失较大。该酶对过低的pH稳定性较差,在应用于生产NMN时,应避免反应体系pH低于6.0。

图5 Nampt的热稳定性分析Fig.5 Thermal stability analysis of Nampt
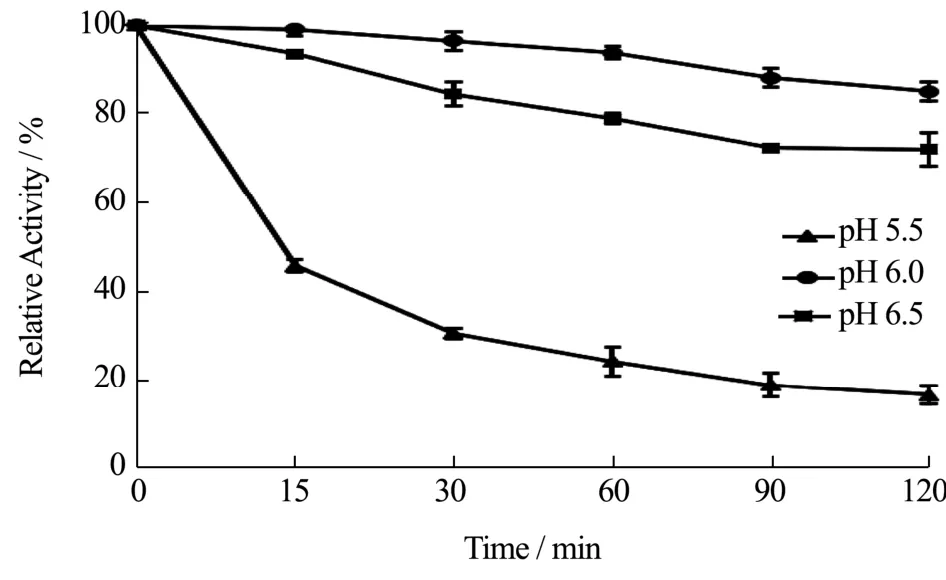
图6 Nampt的pH稳定性分析Fig.6 pH stability analysis of Nampt
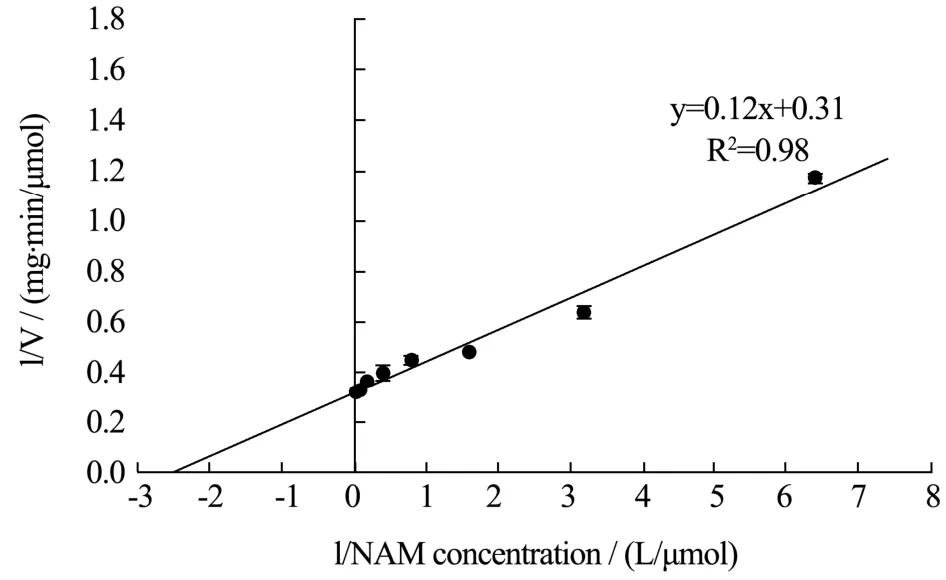
图7 双倒数曲线法测定Nampt的动力学参数Fig.7 Determination of kinetic parameters of Nampt by double reciprocal curve method

表1 Nampt动力学参数比较Table 1 Comparison of Nampt kinetic parameters from different sources
2.4 Nampt动力学参数测定
在最适温度和pH下,设置不同浓度梯度的NAM并进行酶活力测定。使用双倒数作图法,将酶促反应速度的倒数对底物NAM浓度的倒数的作图。结果如图7所示,通过拟合的趋势线与横坐标和纵坐标的截距来计算Km和Vmax值。以NAM为底物,Nampt的Km为0.39 μmol/L,Vmax为3.20 μmol/(mg·min),R2为0.98。与已测定动力学参数来源的Nampt比较如表1所示。Homo sapiens来源的Nampt Km最小,对底物NAM亲和力最好,表中两篇报道测定值相差较大可能是由于测定产物NMN方法不一样导致[8,11]。Homo sapiens与Mus musculus来源的Nampt kcat值较小,可能无法满足工业生产NMN的要求,George研究中使用了Mus musculus来源的Nampt,相对于其他两个细菌来源的Nampt,相同时间内Mus musculus来源的Nampt在大肠杆菌过表达后生产NMN的产量较低[9]。本研究表达的Nampt的Kcat值远高于其他来源,kcat/Km为目前已表征的Nampt中最高,更加适用于工业生产NMN。
2.5 NMN酶法合成及鉴定
测定了Nampt的酶学性质以及热稳定性后,尝试将该酶应用于酶法合成NMN。根据方法“1.2.6”,通过改变Nampt的添加量,观察不同Nampt的添加量对NMN产量的影响。如图8a所示,酶添加量为0.002、0.008、0.02 g/L时,NMN产量达到最高时所需要的反应时间,随着酶添加量的增加而减少,NMN的最高产量随着酶添加量的增加而提高。但当酶添加量增加到0.1 g/L时,NMN最高产量几乎和酶添加量为0.02 g/L时候一致,在反应5 min NMN产量达到最大值约15 mg/L,生产效率为3 mg/(L·min)。NMN产量不再随着酶的添加量增加而提高,可能是由于底物之一的PRPP不稳定,在-80 ℃或室温解冻和反应过程降解损耗导致,体系中另一底物NAM仍未反应完全。为验证此猜想,在酶添加量为0.1 g/L的反应体系中,待反应至5 min时,补加一次0.1 mmol/L的底物PRPP,反应结果如图8b所示,反应至10 min时NMN产量检测到约为30 mg/L,生产效率为3 mg/(L·min)。该实验结果表明通过补加PRPP的方法,提高NMN的产量。

图8 Nampt催化生产NMNFig.8 Nampt catalyzes production of NMN

图9 质谱鉴定反应产物Fig.9 Identification of reaction products by mass spectrometry
3 结论
3.1 本文成功在大肠杆菌中活性表达Meiothermus ruber来源的Nampt。在最适pH 6,最适温度45 ℃条件下,该酶kcat为0.39 μmol/L,Vmax为3.20 μmol/(mg·min),kcat为1.39 1/s,与已报道和表征的其他来源Nampt相比[8,11-14],该酶kcat/Km最高,更加工业生产NMN。该酶在较宽范围的温度和pH下,酶活力在较高水平,有利于此后应用于生产时对温度和pH波动的适应性。在45 ℃和50 ℃保温120 min后,该酶酶活残余仍有80%以上,有利于生产NMN过程中酶催化剂能够长时间保持相对稳定。在pH 6.0和6.5条件下,120 min时Nampt的残余酶活仍然分别在80%和70%以上,pH稳定性良好。但是在pH 5.5条件下,短时间酶活损失较大,在应用于生产NMN时,应避免反应体系pH低于6.0。初步利用该酶进行催化生产NMN,酶添加量为0.1 g/L的情况下,反应5 min时补加一次PRPP,NMN最高产量可达30 mg/L,NMN产量已超过George[9]利用大肠杆菌过表达Nampt边发酵边生产的方法。本研究为Nampt应用于NMN的酶法合成提供良好的研究基础。
3.2 本研究虽然成功表达性质较优的Nampt,但后续仍然存在许多挑战。例如固定化酶技术的使用会提高酶元件的稳定性与重复利用率,进而可以降低生产成本,但固定化酶可能带来酶催化性质变差的问题,如底物亲和力降低等,因此寻求到合适的固定化酶方法将会大大在降低酶消耗带来的生产成本[15,16]。此外单酶法生产NMN的底物之一的PRPP不稳定且价格较贵,影响了生产NMN的经济效益。后续可以通过使用多酶法,先从更为廉价稳定的底物出发得到中间产物PRPP,例如可以通过核糖激酶(EC 2.7.1.15),PRPP合成酶(EC 2.7.6.1)代谢途径,由ATP和核糖出发得到PRPP。
