工业氢氧化铝重溶重结晶制备高纯氧化铝试验研究
2021-03-02李中林李思佳耿继业林杰榜李义兵苏积波黄桃娥
李中林,李思佳,耿继业,林杰榜,李义兵,苏积波,黄桃娥
(1.桂林理工大学 材料科学与工程学院,广西 桂林 541000;2.百色百矿集团有限公司,广西 百色 533000; 3.广西田东锦鑫化工有限公司,广西 田东 531500)
高纯氧化铝(HPA)在高温下具有较高的转化率、较低的钠含量[1]及较强的收缩性能,广泛用于制备单晶材料、发光载体、激光材料、透明陶瓷材料等[2-3]。
目前,已有多种制备HPA工艺,但都存在一些优缺点:结合有机铝醇盐水解法[4-6]可以获得平均粒径25 nm、分散性好、尺寸均一、球形颗粒α-Al2O3粉体,但制备条件要求极高,生产成本高;碳酸铝铵结晶热解法[7-8]和硫酸铝铵结晶热解法[9]工艺相对简单,反应母液可循环利用[10],但制备过程中会产生大量废气造成环境污染,且K、Ga、卤素等杂质很难去除;水热合成法[11]生产周期短,成本低,是制备超细粉体的一种新工艺,但其反应条件较为苛刻,需高温高压,反应时也会产生氢气,易发生爆炸,难以实现产业化生产[12-13];在拜耳法[14]基础上,采用石灰法对拜耳法生产的高纯铝酸钠溶液进行深度脱硅,再脱钠[15-16]、煅烧,所得Al2O3纯度在99.9%左右[17],钠、硅杂质含量有所降低[18],但生产效率较低,烧结温度过高。因此,研究在简单生产条件下,用低成本原料生产HPA有重要意义。
试验研究了以氢氧化钠溶液溶解工业氢氧化铝(Al(OH)3),然后重结晶氢氧化铝,焙烧制备高纯氧化铝。
1 试验部分
1.1 试验材料及设备
试验原料:工业氢氧化铝(w(Al(OH)3)≥96.0%)由广西某公司提供。
试验试剂:氢氧化铝、氢氧化钠,分析纯;盐酸,购自广东西陇科学股份有限公司。
试验设备:高纯水处理器,集热式恒温加热磁力搅拌器,紫外可见分光光度计,反应釜,电热恒温鼓风干燥箱,荧光光谱仪。
1.2 试验原理及方法
在一定温度下,工业Al(OH)3用NaOH重溶为铝酸钠溶液(NaAl(OH)4),此时,只有微量Fe2O3杂质与NaOH反应生成NaFe(OH)4进入溶液;而溶于水中的SiO2与苛性碱在重溶和种分阶段反应生成的可溶性硅酸钠(Na2SiO3)则继续与NaAl(OH)4反应生成水合铝硅酸钠沉淀(Na2O·Al2O3·1.7SiO2·nH2O)。种分所得Al(OH)3粉末中Na2O含量较高,这是Al(OH)3晶体慢慢长大后发生团聚,晶间和晶体内会残留和吸附一定量Na2O杂质所致;最后,在酸性水热条件下,用超声冲击使晶体中残留的Na2O脱落,进一步降低产物中Na2O含量。超声波波长短,近似直线传播,能量较集中,对微粒具有分散冲击作用,能够渗透到Al(OH)3晶粒微孔中,且其产生的高压、高强冲击波可大幅度降低分子间的作用力,能有效阻止Na2O发生团聚和吸附。整个过程中的主要化学反应如下:

(1)

(2)

(3)

(4)
称取219.4 g NaOH和281.4 g工业Al(OH)3,用400 mL高纯水在95 ℃水浴中搅拌至全部溶解,过滤后定容至1 000 mL。NaAl(OH)4溶液中,Na2O和Al2O3质量浓度分别为170、184 g/L。加入5 g分析纯Al(OH)3作为晶种,种分后过滤干燥,以荧光光谱法分析中间产物Al(OH)3粉末中主要杂质含量;种分后中间产物Al(OH)3粉末经过焙烧再与稀盐酸一起加入反应釜中,在200 ℃下反应4 h,沉淀物洗涤过滤后干燥、磨细;在900 ℃下焙烧1.5 h,并在酸性环境下超声加热0.5 h,之后洗涤至中性,干燥后测定产物Al2O3中Na2O杂质含量。
2 试验结果与讨论
2.1 工业Al(OH)3重溶及晶种分解除杂
2.1.1 水质的影响
分别用去离子水和高纯水配制1 000 mL NaAl(OH)4溶液,其中Na2O和Al2O3质量浓度均为170、184 g/L。用钼蓝光度法和邻菲啰啉分光光度法测定NaAl(OH)4中Si、Fe吸光度,结果见表1。

表1 水质对溶液中杂质含量的影响
由表1看出:2种水质所得NaAl(OH)4溶液的Fe吸光度基本相等,表明去离子水不影响Fe2O3杂质含量;去离子水配制的NaAl(OH)4溶液Si吸光度低于参比组溶液Si吸光度,这是因为去离子水中Si含量较高,且配制参比溶液所用去离子水量高于配制NaAl(OH)4溶液,导致参比组中Si含量较高。综合考虑,确定整个制备过程使用高纯水。
2.1.2 分级过筛及洗涤的影响
取一定体积Na2O和Al2O3质量浓度分别为170、184 g/L的NaAl(OH)4溶液,加入适量Al(OH)3晶种,于30 ℃下种分48 h。对种分后的部分溶液分级过筛(用325#945 μm网筛),筛上和筛下的中间产物Al(OH)3分别干燥后,以荧光光谱法测定Al(OH)3中主要杂质质量分数;剩余溶液分别洗涤一次和多次,过滤干燥后分析杂质质量分数。试验结果见表2。
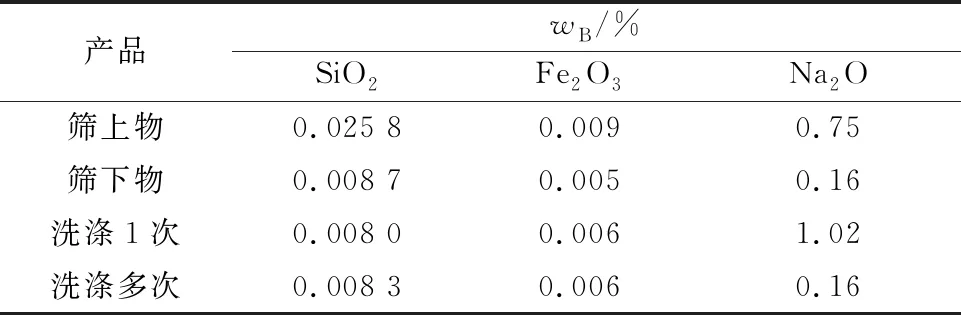
表2 分级过筛及洗涤对产品中杂质质量分数的影响
由表2看出:筛下物Al(OH)3中SiO2和Na2O杂质质量分数明显低于筛上物,这是因为未分级过筛的Al(OH)3颗粒较大,晶间和晶体中残留的杂质更多;洗涤对SiO2和Fe2O3杂质质量分数的影响较小,这是因为洗涤仅能洗去溶液中大部分未反应的Na2O,无法脱除残留在晶体中的杂质。
2.1.3 Na2O和Al2O3初始质量浓度的影响
将Na2O和Al2O3质量浓度170、184 g/L视为D,配制Na2O和Al2O3初始质量浓度分别为0.50D、0.75D、1.00D和1.25D的NaAl(OH)4溶液各1 000 mL,每组加入5 g晶种,30 ℃下种分48 h, 考察Na2O和Al2O3初始质量浓度对Al(OH)3产物中杂质质量分数影响,试验结果如图1所示。
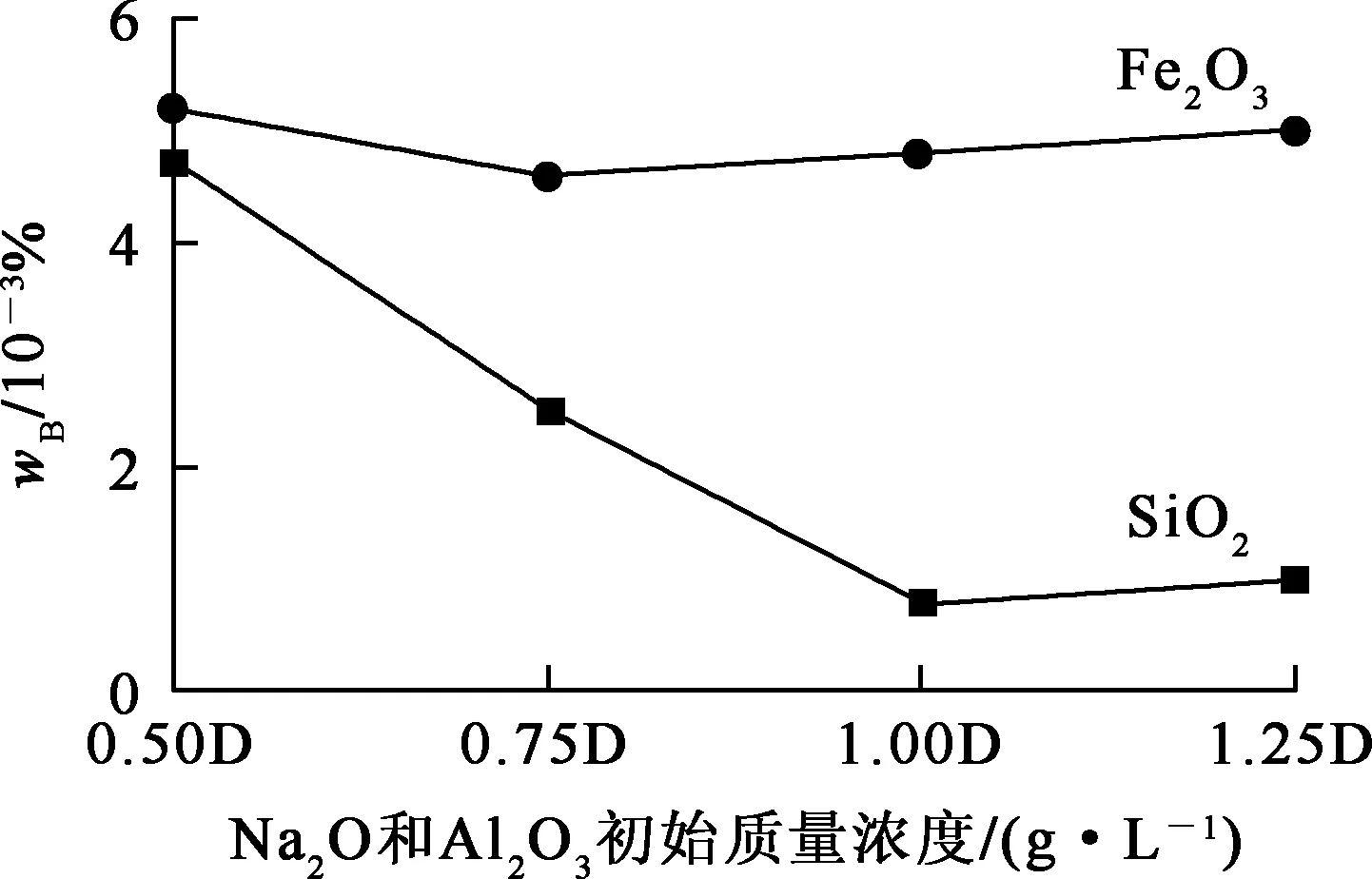
图1 Na2O和Al2O3初始质量浓度对产物Al(OH)3杂质质量分数的影响
由图1看出:随Na2O和Al2O3初始质量浓度升高,中间产物Al(OH)3干粉中SiO2质量分数先降低后略有升高,而Fe2O3质量分数变化较小;NaAl(OH)4溶液中Na2O和Al2O3初始质量浓度为170、184 g/L时,Al(OH)3干粉中SiO2质量分数最低,仅为8.0×10-4%。这表明:在溶解和种分过程中,只有微量Fe2O3进入溶液,而可溶性SiO2与NaOH生成的Na2SiO3则与NaAl(OH)4反应生成沉淀;随溶液中Na2O和Al2O3初始质量浓度升高,溶液苛性比增大,对去除SiO2更有利;但Na2O和Al2O3初始质量浓度过大,则溶液黏度会增大,容易发生团聚,反而不利于杂质的去除。
2.1.4 种分温度的影响
配制5份1 000 mL NaAl(OH)4溶液,其中Na2O和Al2O3初始质量浓度均为170、184 g/L,在不同温度下种分48 h。种分温度对中间产物Al(OH)3干粉中SiO2和Fe2O3杂质质量分数的影响试验结果如图2所示。
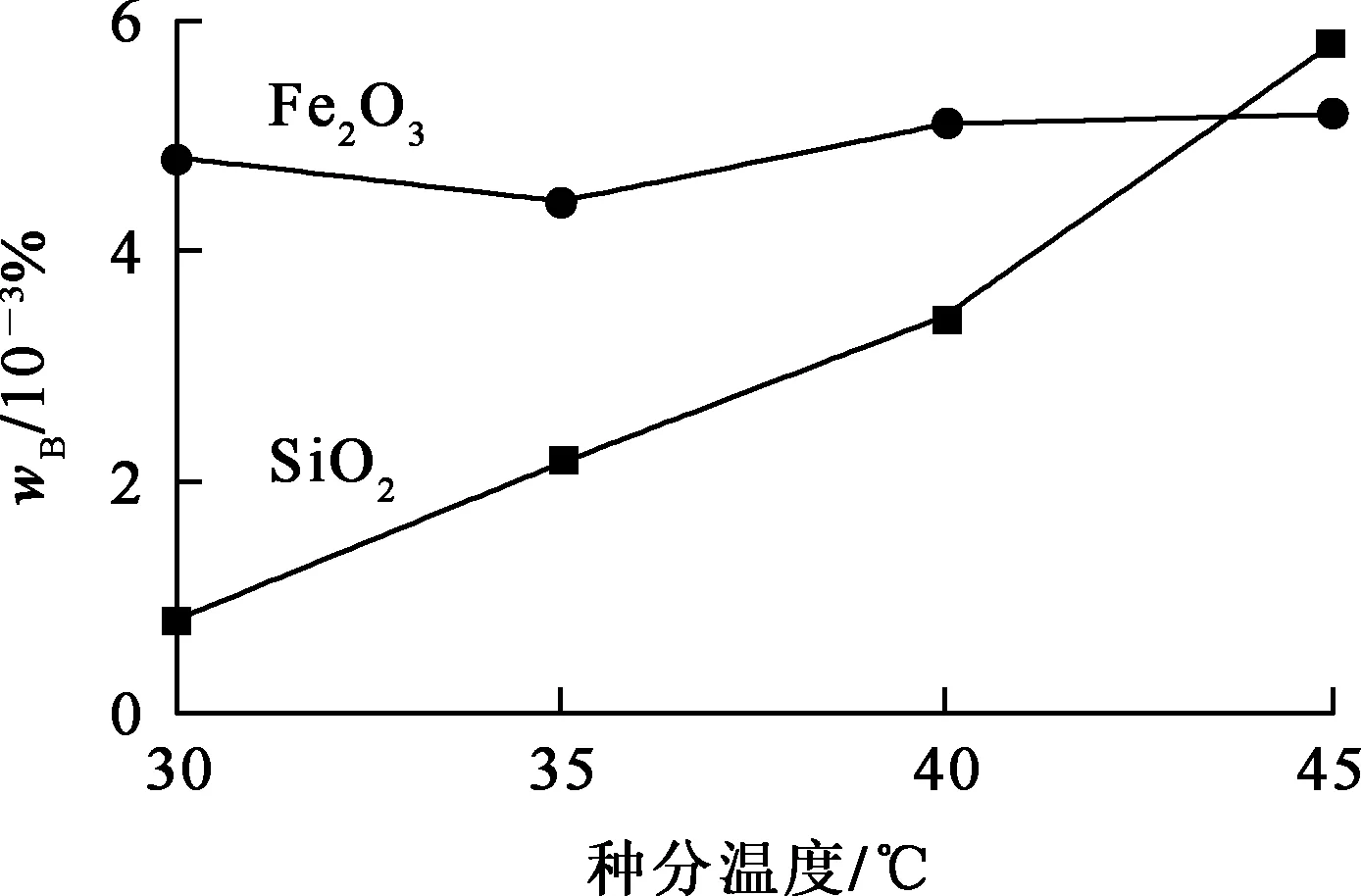
图2 种分温度对Al(OH)3产物中杂质质量分数的影响
由图2看出,种分温度在30~45 ℃条件下,种分温度较低时,杂质含量较低,Al(OH)3纯度更高。体系温度较低时,溶液黏度较大,晶核较多,形成的Al(OH)3颗粒较小,晶体对杂质的作用力较小,杂质残留和吸附得更少;但温度过低,浆料黏度过大,不利于杂质的去除。为提高分解速度、降低中间产物Al(OH)3干粉中杂质质量分数,需要采用起始始温度较高并逐渐降温的控温方式进行种分。
2.1.5 种分时间的影响
配制5份1 000 mL NaAl(OH)4溶液,其中Na2O和Al2O3初始质量浓度分别为170、184 g/L,在30 ℃下进行种分。种分时间对中间产物Al(OH)3干粉中SiO2和Fe2O3杂质质量分数的影响试验结果如图3所示。
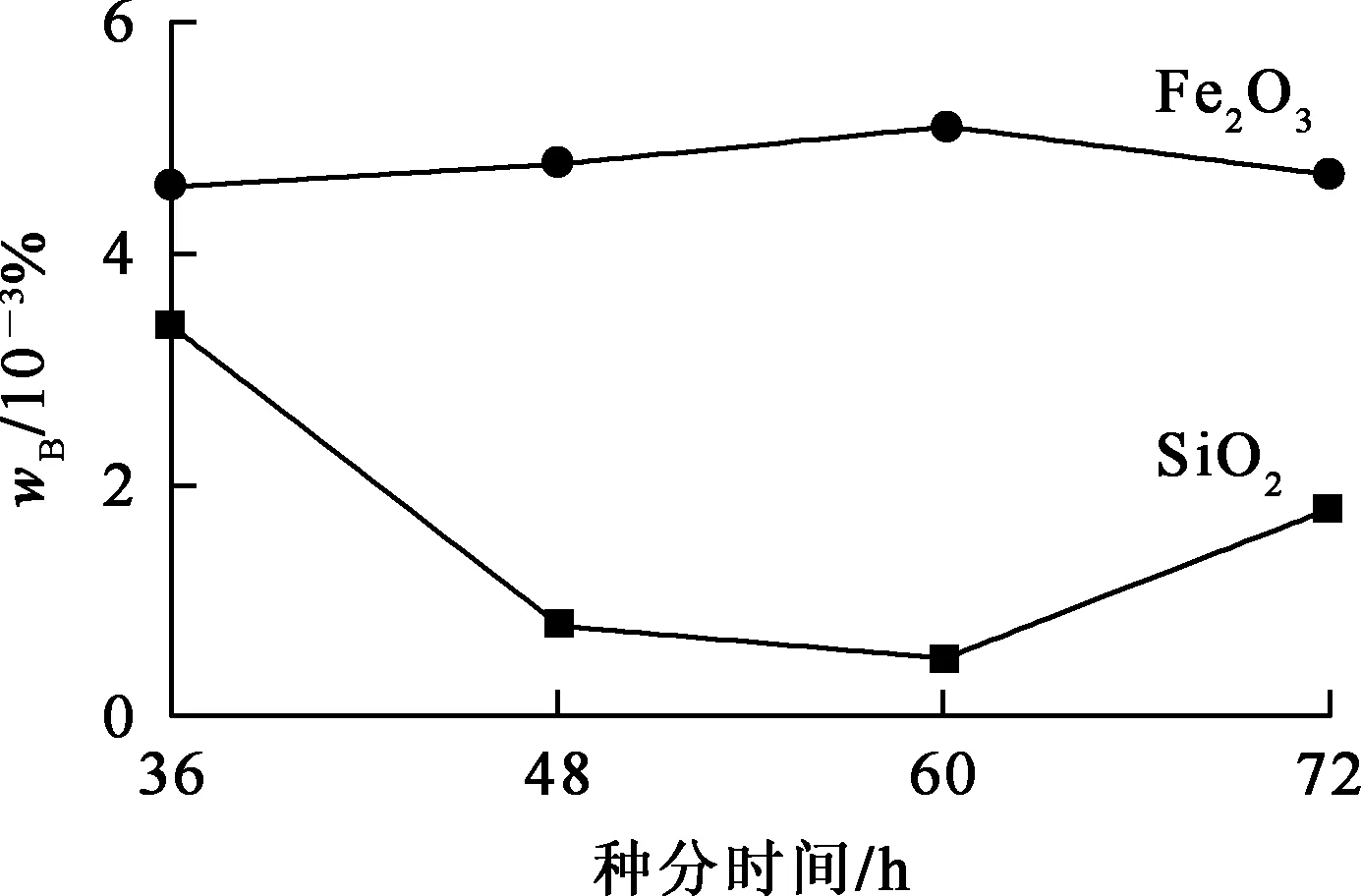
图3 种分时间对Al(OH)3产物中杂质质量分数的影响
由图3看出:中间产物Al(OH)3干粉中SiO2杂质质量分数随种分时间延长先降低后升高,在36~60 h时间范围内去除效果较好;Fe2O3质量分数变化不大。在一定时间范围内,溶液苛性比随种分时间延长而增大;种分时间过长,晶体颗粒过大,晶间和晶体对杂质作用力增大,晶间和晶体包裹的杂质会更多;但过早停止种分不仅会降低Al(OH)3产率,也会降低溶液苛性比,使SiO2和Fe2O3杂质质量分数提高。综合考虑,种分时间以60 h为宜。
2.2 料液酸度的影响
表3为料液酸度对最终产物Al2O3中杂质质量分数的影响试验结果。可以看出:与高纯水(盐酸质量浓度为0)相比,料液中添加适量盐酸,最终产物Al2O3中Na2O质量分数会显著降低;随盐酸质量浓度增大,Al2O3产物中Na2O杂质质量分数降低;用质量浓度100 g/L的盐酸溶液深度脱钠效果最好,Al2O3产物中Na2O质量分数可低至3.8×10-2%。在超声波冲击下,热的酸性环境中,焙烧中间产物Al(OH)3得到的Al2O3晶间和晶体中残留的Na2O发生脱落,但脱落Na2O的物质的量是一定的。

表3 盐酸质量浓度对最终产物Al2O3中Na2O质量分数的影响
2.3 种分产物的形貌
图4为Al(OH)3种分产物的SEM照片。可以看出,Al(OH)3晶体形貌为块状颗粒上附着类似于金字塔的细小圆锥形颗粒。结合Al(OH)3结晶机制可知:结晶早期,NaAl(OH)4溶液处于过饱和状态,主金字塔侧面通过填充扭结部位形成次金字塔并继续生长,次生金字塔出现在前核簇中,金字塔底部则通过填充螺旋结构的方式逐渐展开;结晶后期,溶液过饱和度慢慢降低,侧面仅通过填充扭结部位而生长,螺旋结构也逐渐收缩变形,初始阶段的锥形颗粒渐渐变形为最终的块状颗粒。

图4 Al(OH)3种分产物的SEM照片
3 结论
Al(OH)3重溶时,只有微量Fe2O3会与苛性碱反应进入到溶液中,而可溶性SiO2在重溶和种分过程中与NaOH反应生成的NaSiO3则会与NaAl(OH)4反应生成沉淀。采用起始温度较高并逐渐降低的控温方式,将较高浓度NaAl(OH)4溶液置于30 ℃温度下进行种分,延长种分时间至60 h左右,中间产物Al(OH)3晶体中SiO2杂质质量分数低于3.0×-3%,Fe2O3杂质质量分数低于5.0×10-3%, 但残留和吸附的Na2O杂质含量相对较高,需要进一步去除。在超声波的冲击下,热稀酸中晶体残留的部分NaAl(OH)4被脱除,最终的Al2O3产物中Na2O质量分数可降至3.8×10-2%左右,纯度可达99.9%。
