海藻酸钠-纳米纤维素胶粒对乳酸菌胃肠液耐受性的影响
2021-03-02陈秉彦林晓姿李维新林晓婕郑宝东何志刚
陈秉彦,林晓姿,李维新,林晓婕,郑宝东,何志刚,*
(1.福建省农业科学院农业工程技术研究所,福建 福州 350002;2.福建省农产品(食品)加工重点实验室,福建 福州 350002;3.福建农林大学食品科学学院,福建 福州 350002)
近年来,乳酸菌作为一种功能性益生菌,被广泛用于发酵果汁以及各种奶制品(软硬奶酪、冰淇淋、酸奶、冷冻乳制品甜点)加工。乳酸菌不仅赋予食品特殊的发酵风味,同时也通过改善肠道微生物群落平衡,有效抑制有害菌生长从而有益于宿主健康[1]。有研究表明,至少需要106~107CFU/g的乳酸菌定植于肠道才可以发挥其对人体的益生效应[2]。然而,人体摄入活性乳酸菌产品时,菌体在经过低pH值胃酸以及高胆汁酸盐肠液环境后活性损失相当严重。因此,如何提高乳酸菌在胃肠液中的耐受性受到越来越多研究人员的关注。
微胶囊化是保护益生菌的有效方法,微胶囊将菌体与外界逆环境隔离,减少了不利因子对乳酸菌的干扰及破坏,增加了乳酸菌的稳定性。海藻酸钠的价格低廉、凝胶条件温和并具有良好的生物相容性,含有的α-L-古洛糖醛酸可与二价阳离子作用形成“蛋盒”凝胶结构[3]。许多研究都报道了海藻酸钠可通过挤压滴入法包埋乳酸菌,海藻酸钠的浓度[4]、分子质量与α-L-古洛糖醛酸比例[5]以及交联剂[6]都会改变微胶囊胶粒的尺寸与机械强度,从而影响乳酸菌的包埋率及保护效果。然而,海藻酸钠胶粒表面粗糙、呈现出部分孔状结构,易受外界环境因素影响导致凝胶强度下降[7],限制了它在食品以及医药领域中的应用。目前,通过海藻酸钠与高分子聚合物进行复配凝胶的方式,是修饰海藻酸钠胶粒结构、提高其机械强度的有效方法。
纳米纤维素是直径为纳米尺寸、具有一定长径比的线性或颗粒状高分子聚合物。根据微观形态的差异,可分为纤维素纳米微晶(cellulose nanocrystal,CNC)以及纤维素纳米微纤丝(cellulose nanofibrils,CNF)。纳米纤维素已被证实具有多羟基结构[8-9],可通过非共价作用力提高如淀粉[10]、蛋白[11]、果胶[12]等亲水胶体的凝胶强度。基于此推测,利用纳米纤维素可强化海藻酸钠胶粒结构,提高胶粒对乳酸菌的保护效果。目前,关于海藻酸钠-纳米纤维素胶粒对乳酸菌胃肠液耐受性的影响研究鲜见报道。
因此,本实验以果蔬加工副产物豆渣为原料,通过酸法与机械法分别制备豆渣纤维素纳米微纤丝(soybean cellulose nanofibrils,SCNF)与豆渣纤维素纳米微晶(soybean cellulose nanocrystal,SCNC),利用不同种类的纳米纤维素协同钙离子诱导海藻酸钠溶液形成微胶粒,研究两种复合微胶粒的包埋率、表面形态、胶体结构;进一步考察两种微胶粒对乳酸菌胃肠液逆环境存活率的影响。本研究有利于拓展果蔬纳米膳食纤维在乳酸菌等益生菌保护领域中的应用,可为构建新型载菌递送体系以提高乳酸菌的胃肠道耐受性提供新思路。
1 材料与方法
1.1 材料、菌株与试剂
豆渣由三明市扬晨食品有限公司提供。
副干酪乳杆菌R37(CCTCC:M 2012311)由福建省农产品(食品)加工重点实验室提供,该菌从枇杷果酒中分离得到。
碱性蛋白酶(200 000 U/g)、胃蛋白酶(50 000 U/g)江苏锐扬生物有限公司;海藻酸钠(分析级)、胰酶(4 000 U/g)、胰蛋白酶(250 000 U/g)、胆盐(纯度高于65%) 北京索莱宝生物科技公司;溴化钾(光谱级)德国默克试剂公司;MRS肉汤及培养基 广东环凯微生物科技有限公司;其余有机溶剂均为国产分析纯。
1.2 仪器与设备
GM-200型德国莱驰刀式研磨仪 上海弗尔德仪器有限公司;SPCH-35型超高压纳米均质机 英国STANSTED仪器公司;FD5-3型冷冻干燥机 美国SIM公司;Nova NanoSEM 230场发射扫描电子显微镜 美国FEI仪器公司;TENSOR II型傅里叶变换红外光谱仪 德国布鲁克仪器有限公司;NMI-25型低频氢谱核磁共振仪 江苏泰纽科技有限公司;TA.XT Plus质构仪 英国SMS公司。
1.3 方法
1.3.1 豆渣纳米纤维素的制备
采用碱提法[13]制备豆渣纤维素,获得的纤维素经干燥粉碎,密封保存。实验进一步以豆渣纤维素粉为原料,采用酸法与微射流均质制备SCNC以及SCNF。
参考Yang Xue等的方法[14]并略作修改,通过酸解制备SCNC:粉碎过筛的20 g豆渣纤维素粉溶于1 L硫酸中,搅拌降解36 h,加水稀释为2 倍体积后离心(13 000 r/min、20 min)。沉淀经水洗再次离心后调节pH值为中性,透析24 h后冻干保存。
参考Wang Yihong等的方法[15]并略作修改,通过微射流均质制备SCNF:粉碎过筛的20 g豆渣纤维素粉溶于1 L去离子水,经微射流均质降解(150 MPa,循环5 次)后冻干保存。
1.3.2 乳酸菌R37的培养
采用MRS肉汤活化培养副干酪乳杆菌R37,接种量为培养基体积的5%,培养温度为37 ℃,时间为24 h。活菌数量采用平板计数法计算(菌量大于108CFU/mL),乳酸菌菌悬液经离心(5 000 r/min、5 min)、水洗后收集,用于后续包埋实验。
1.3.3 载菌海藻酸钠-纳米纤维素胶粒的制备
采用挤压滴入法制备载菌胶粒:SCNC或SCNF粉末添加至菌悬液使其终质量浓度分别为10 g/L与30 g/L,之后添加海藻酸钠至终质量浓度为10 g/L,搅拌水合1 h,挤压滴入氯化钙溶液(柠檬酸调节pH值至3.5,溶液保持搅拌状态),硬化20 min,抽滤获得湿基复合胶粒,冻干后密封保存。海藻酸钠-纤维素纳米微晶胶粒根据纳米纤维素不同质量浓度分别命名为SA-SCNC(10 g/L)与SA-SCNC(30 g/L);海藻酸钠-纤维素纳米微纤丝胶粒根据纳米纤维素不同质量浓度分别命名为SA-SCNF(10 g/L)与SA-SCNF(30 g/L);未添加纳米纤维素粉末的样品作为对照。湿基胶粒用于包埋率、低频氢谱核磁共振、质构以及胃肠液耐受性的分析,而干基胶粒用于扫描电子显微镜观察以及傅里叶变换红外光谱的结构分析。
1.3.4 海藻酸钠-纳米纤维素胶粒的乳酸菌包埋率
根据Darjani等的方法测定胶粒对乳酸菌的包埋率[16]。取1 g海藻酸钠-纳米纤维素胶粒,加入9 mL磷酸二氢钠缓冲溶液(0.1 mol/L、pH 7.5、37 ℃),漩涡振荡5 min使胶粒溶解,乳酸菌完全释放。之后,取1 mL样液进行梯度稀释,根据平板计数法测得包埋菌的数量。海藻酸钠-纳米纤维素胶粒对乳酸菌的包埋率按照公式(1)计算。
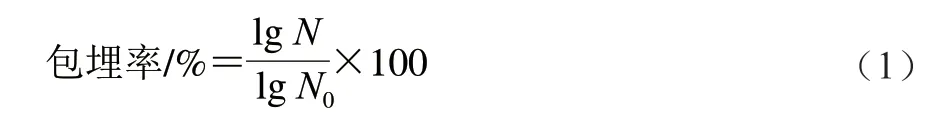
式中:N为包埋后胶粒释放的活菌数量/(CFU/g);N0为初始活菌数量/(CFU/g)。
1.3.5 海藻酸钠-纳米纤维素胶粒的微观形态观察
将冻干的胶粒黏附在贴有导电胶的载物平板上,进行喷金处理,之后采用Nova NanoSEM 230场发射扫描电子显微镜对冻干胶粒的整体形态及微观结构进行观察,放大倍数分别为100 倍与10 000 倍。
1.3.6 海藻酸钠-纳米纤维素胶粒的傅里叶变换红外光谱分析
采用TENSOR II型傅里叶变换红外光谱仪对冻干胶粒的基团结构进行分析。冻干粉碎的海藻酸钠-纳米纤维素胶粒25 mg,加入500 mg干燥的光谱纯溴化钾(105 ℃、2 h),快速研磨,之后取少量粉末倒入模板夹具中进行压片,置于傅里叶变换红外光谱仪通道中进行分析。仪器的测定波数范围为400~4 000 cm-1、分辨率为4 cm-1、扫描32 次。
1.3.7 海藻酸钠-纳米纤维素胶粒的低频氢谱核磁共振分析
采用NMI-25型低频氢谱核磁共振对湿基海藻酸钠-纳米纤维素胶粒的水分分布进行分析,取2 g胶粒于25 mL核磁管中,以CPMG序列进行弛豫时间T2扫描,回声时间为400 μs,回声次数为8 000 次,等待时间为8 s,每次测量扫描8 次,温度为25 ℃,获得弛豫时间曲线。
1.3.8 海藻酸钠-纳米纤维素胶粒的硬度分析
采用TA.XT Plus型质构仪,选取TP-2型探头,触发力为1 g,测前速率1.0 mm/s、测试速率1.0 mm/s、测后速率1.0 mm/s、触发力5.0 g、压缩程度30%,每个样品重复实验3 次,用TPA软件分析海藻酸钠-纳米纤维素胶粒经胃肠液消化后的硬度变化。
1.3.9 海藻酸钠-纳米纤维素胶粒经胃肠液消化后的活菌损失量分析
根据Li Kailing等的方法[17]并稍作修改进行胃肠液耐受实验,取1 g海藻酸钠胶粒或海藻酸钠-纳米纤维素胶粒加入9 mL模拟胃液(pH 2,含3 g/L胃蛋白酶)在37 ℃条件下孵化2 h,之后将胶粒转移至9 mL肠液(pH 6.5,含5 g/L胰酶、3 g/L胰蛋白酶、5 g/L胆盐)中混合均匀,继续孵化3 h。待静置结束后,加入10 mL 0.1 mol/L磷酸盐缓冲液,漩涡振荡5 min,使胶粒完全溶解,吸取1 mL样液进行梯度稀释,根据平板计数法测得活菌数量。对照组采用1 g未包埋的菌悬液进行模拟胃肠液耐受实验。乳酸菌的损失量根据公式(2)计算。

式中:C为乳酸菌的损失量(lg(CFU/g));N为嵌入胶粒的乳酸菌数量/(CFU/g);N0为胶粒经消化后溶解释放的乳酸菌数量/(CFU/g)。
1.4 数据处理与分析
各组实验数据均重复3 次,结果用平均值±标准差表示。采用DPS 9.05软件中最小显著性差异法进行显著性分析,以P<0.05表示数据之间具有显著差异;采用Origin Pro 8.5软件作图。
2 结果与分析
2.1 海藻酸钠-纳米纤维素胶粒对乳杆菌R37的包埋率
不同类型的海藻酸钠-纳米纤维素胶粒对副干酪乳杆菌R37的包埋率如图1所示。所有凝胶样品的初始菌量基本一致,活菌量为9.41(lg(CFU/g))。当凝胶与Ca2+交联后,不同胶粒对乳酸菌的包埋程度存在差异。海藻酸钠胶粒的包埋率为87.51%。当海藻酸钠体系中加入SCNC与SCNF后,胶粒的载菌量与包埋率显著提高。当SCNC或SCNF添加质量浓度为10 g/L时,SA-SCNC与SA-SCNF的包埋率分别为92.77%与96.80%。此结果高于Darjani等报道的海藻酸钠-多糖复合胶粒的包埋率(约90%)[16]。进一步研究发现,提高SCNC与SCNF的添加量对副干酪乳杆菌R37的包埋率影响不显著。这些结果说明SCNF的加入能更好地提高海藻酸钠胶粒的包埋率,这可能与CNF具有更高的比表面积[18],能够较大程度地黏附菌体有关。
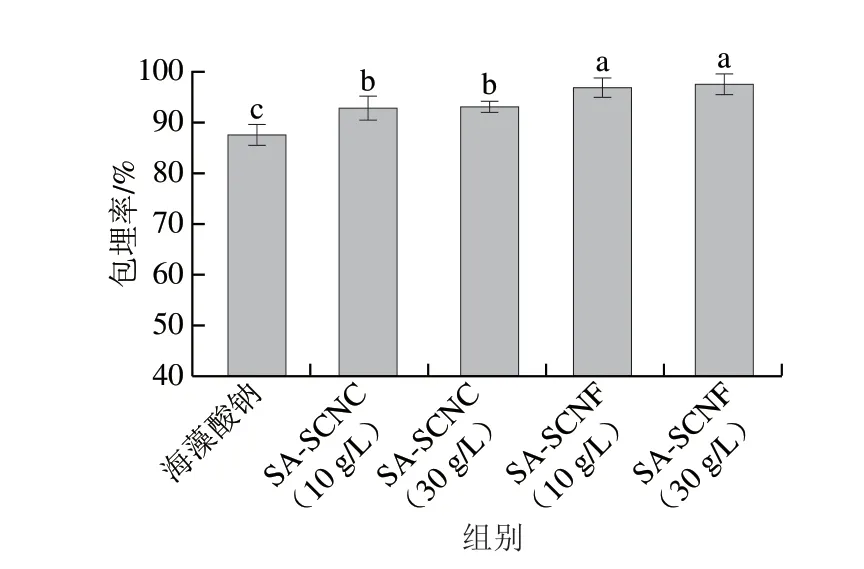
图1 海藻酸钠-纳米纤维素胶粒对乳酸菌的包埋率Fig.1 Encapsulation efficiency of LAB in SA-nanocellulose beads
2.2 海藻酸钠-纳米纤维素胶粒的微观形态
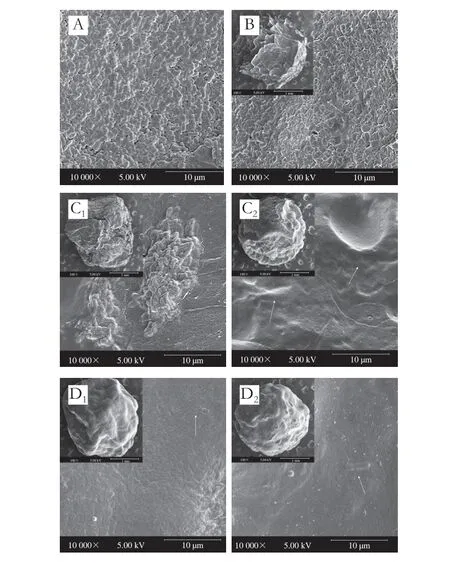
图2 海藻酸钠-纳米纤维素胶粒的形态(×100)及表面结构(×10 000)Fig.2 Morphology (× 100) and microstructure (× 10 000) of SA-nanocellulose beads
不同类型的海藻酸钠-纳米纤维素胶粒的微观形态如图2所示。副干酪乳杆菌R37呈现乳酸菌典型的棒状形态,菌体表面平整,尺寸约为2~5 μm(图2A)。海藻酸钠胶粒呈现扁球状,表面粗糙且伴有孔状间隙,经海藻酸钠胶粒包埋的乳杆菌R37主要分布于胶粒的表面。当SA体系中加入纳米纤维素后,胶粒呈现圆球状,但表面形态发生明显变化,变化程度与纳米纤维素的种类有关。与海藻酸钠胶粒相比,SA-SCNC胶粒表面缺少孔隙结构,呈现粗糙的表面形态,大量的乳杆菌R37聚集黏附在胶粒表面。当SCNC的添加量为30 g/L时,SA-SCNC胶粒的表面裂纹消失。另一方面,当海藻酸钠中添加SCNF后,SA-SCNF胶粒表面的粗糙起伏程度变弱,呈现出更加致密的表面形态,只有少量的乳酸菌在表面上可观察到,说明大量的乳杆菌R37被包裹在胶粒的内部。进一步观察发现,SCNF添加量的增大使得复合胶粒的表面变得更加光滑平整。这些观察结果表明纳米纤维素的加入会优化海藻酸钠胶粒的表面形态,从而影响乳杆菌R37在胶粒中的分布状况,相比于添加SCNC,海藻酸钠能够与SCNF形成更加致密的微观结构。基于此,有必要对不同形态胶粒的结构进行研究。
2.3 海藻酸钠-纳米纤维素胶粒的官能团结构及氢键结合状态
不同类型的海藻酸钠-纳米纤维素胶粒的官能团结构如图3A所示。海藻酸钠胶粒显示出4 个明显的特征峰(1 030、1 430、1 600、3 400 cm-1),其中1 030 cm-1处的特征峰表示钙离子盐桥上醚键(—O—)的拉伸振动[19],1 430 cm-1与1 600 cm-1处的特征峰表示海藻酸钠羧酸基团(—COOH)的不对称振动与对称拉伸振动[20],而3 400 cm-1处的特征峰表示海藻酸钠分子间羟基的伸缩振动[21],其强度反映体系中氢键的缔合程度。所有样品的傅里叶变换红外光谱图在1 700 cm-1处均显示出一个明显的羰基振动吸收峰,但该吸收峰可能是来源于酸度调节剂柠檬酸的羧基[22]。当海藻酸钠体系中添加纳米纤维素后,这些特征峰的位置并没有出现明显偏移,说明在离子交联形成胶粒的过程中未有新的化学键生成。进一步观察发现,当纳米纤维素的添加量增大时,1 030 cm-1与3 400 cm-1振动吸收峰透光率下降,振动吸收强度增加。其中SA-SCNF(30 g/L)胶粒显示出最低的透光率,分别为0.641与0.507,分别是海藻酸钠胶粒的75.32%与71.10%。这些结果表明纳米纤维素有利于强化海藻酸钠凝胶体系的盐桥结构与氢键结构,其中纤维素微纤丝比较纤维素微晶发挥着更加重要的作用。
T2弛豫时间对1H原子运动十分敏感,可间接反映海藻酸钠凝胶中水分的结合状态,从而判定凝胶体系中的氢键形成强弱[23-24]。根据水分的自由程度差异,水分的结合状态可被大致分为3 类:结合水(T21:1~10 ms)、束缚水(T22:10~100 ms)、自由水(T23:100~1 000 ms)[25]。海藻酸钠-纳米纤维素胶粒中水分的T2弛豫时间如图3B所示。所有胶粒都展现出唯一的单峰形态,说明胶粒的水分分布均一,从而能够有效束缚溶剂中的水分子。与海藻酸钠胶粒相比,SA-SCNC胶粒的水分分布向低弛豫时间转移,且偏移程度随纳米纤维素的添加量增加而增大,SA-SCNF胶粒较SA-SCNC胶粒具有更低的弛豫时间。当SCNF的添加量为30 g/L时,SA-SCNC胶粒的弛豫时间为25.53 ms。这些结果表明纳米纤维素的多羟基结构可提高海藻酸钠体系的成氢键能力,从而增强对自由水的有效束缚。另外,Mishnaevsky等采用计算机系统模拟了纳米纤维素结构与高聚物之间的相互作用,确定了纳米纤维素的强化机制不仅与分子间非共价作用力(氢键、范德华力)的强弱有关,同时还取决于纤维素是否呈现封闭的微观形态[26]。SCNF在形态上表现为相互缠绕[27],具有更大的比表面积,在空间内能形成更加致密的网络结构,这可能也是微纤丝能够提高海藻酸钠胶粒持水能力的重要原因。此结果与海藻酸钠-纳米纤维素胶粒的傅里叶变换红外光谱分析结果一致,进一步证明了与SCNC相比,SCNF能够通过强化分子间氢键相互作用,更好地维持海藻酸钠凝胶的网络结构。
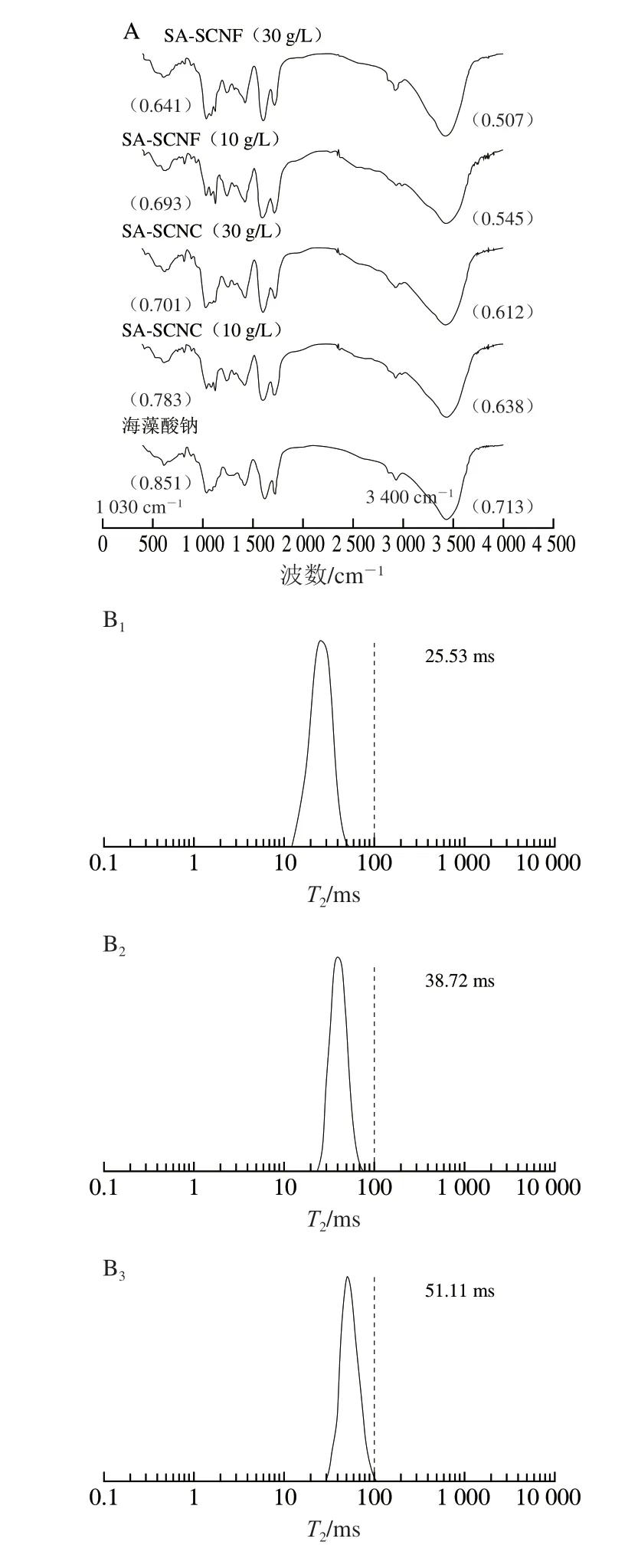

图3 海藻酸钠-纳米纤维素胶粒的傅里叶变换红外光谱图(A)与低频氢谱核磁图(B)Fig.3 Fourier transform infrared spectra (A) and low-frequency 1H nuclear magnetic resonance (B) of SA-nanocellulose beads
2.4 海藻酸钠-纳米纤维素胶粒经胃肠液消化后的硬度变化
不同类型的海藻酸钠-纳米纤维素胶粒经胃肠液消化后的硬度差异如表1所示。海藻酸钠胶粒在模拟胃液消化过程中结构稳定,胶粒的硬度未发生明显变化。然而,海藻酸钠胶粒经模拟肠液消化后,硬度下降为初始值的31.1%,这可能是海藻酸钠分子链的—COOH在碱性条件下电离程度下降,分子链趋向展开所致[28-29]。纳米纤维素可显著增加海藻酸钠胶粒的硬度并表现出浓度依赖性,SA-SCNC(30 g/L)胶粒与SA-SCNF(30 g/L)胶粒的硬度分别为海藻酸钠胶粒的153.8%与215.1%。进一步研究发现,与海藻酸钠相比,SA-SCNF胶粒经胃肠液消化后的硬度变化大幅度减小,这说明SCNF的加入更有利于稳定海藻酸钠胶粒的凝胶网络结构,避免胶粒经胃肠液消化后机械强度发生较大程度变化。推测SCNF具有强氢键缔合能力[30],能够抑制海藻酸钠的分子链在肠液环境中的快速溶胀。

表1 海藻酸钠-纳米纤维素胶粒在胃肠液消化后的硬度变化Table 1 Changes in hardness of SA-nanocellulose after digestion in stimulated gastrointestinal fluid
2.5 海藻酸钠-纳米纤维素胶粒在胃肠液消化过程中的活菌数量变化
不同类型的海藻酸钠-纳米纤维素胶粒经模拟胃肠液消化后活菌损失量如图4所示。乳酸菌R37经模拟胃肠液消化后活菌数量出现大量损失,由9.27(lg(CFU/g))下降为5.43(lg(CFU/g))。与裸菌相比,海藻酸钠载菌胶粒经模拟胃肠液耐受后活菌数量由9.25(lg(CFU/g))减少为6.26(lg(CFU/g)),下降了2.99(lg(CFU/g))。此结果与许多研究报道相似,证实了单纯采用海藻酸钠胶粒负载乳酸菌对提高其胃肠道耐受能力十分有限[31-32]。当纳米纤维素的添加质量浓度为30 g/L时,SA-SCNC胶粒经模拟胃肠液消化后活菌数量由9.37(lg(CFU/g))减少为7.21(lg(CFU/g)),下降了2.16(lg(CFU/g));然而,SA-SCNF胶粒的活菌数量变化幅度更小,由9.32(lg(CFU/g))减少为7.81(lg(CFU/g)),下降了1.51(lg(CFU/g))。这些结果说明纳米纤维素的加入对提高乳酸菌的胃肠道耐受能力有着积极的影响,不同类型的纳米纤维素的影响效果不同,添加SCNF比SCNC能更好地改善海藻酸钠胶粒对乳酸菌R37的保护效果。有研究报道了高聚物胶粒的机械强度与乳酸菌的胃肠道存活率呈现正相关关系[33]。这与本研究结果一致,增加纳米纤维素质量浓度有利于提高海藻酸钠胶粒机械强度与稳定性,从而增强胶粒对胃肠液的阻隔效果。
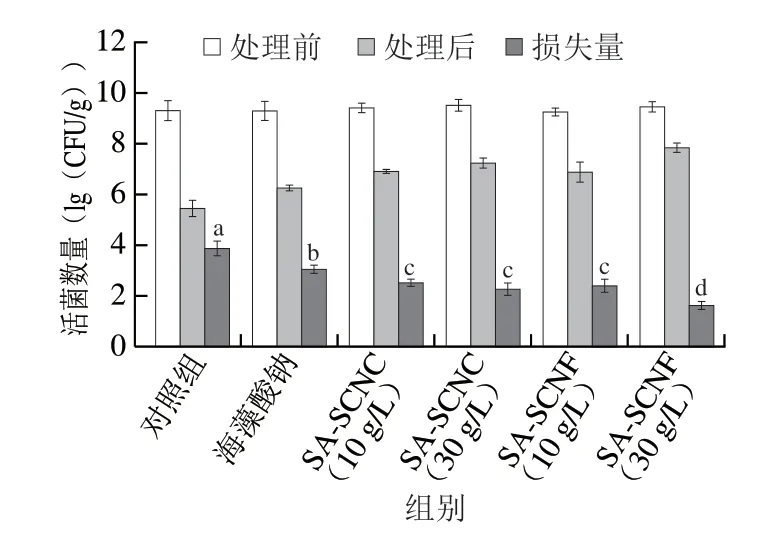
图4 载菌海藻酸钠-纳米纤维素胶粒经模拟胃肠液消化后的活菌数量变化Fig.4 Changes in viability of LAB in SA-nanocellulose beads after simulated gastrointestinal fluid treatment
3 结 论
豆渣纳米纤维素可改善海藻酸钠胶粒的表面形态与分子间作用力,进而影响胶粒对乳酸菌的保护作用,其中SCNF较SCNC表现出更好的改性效果。SCNF的加入不仅提高了海藻酸钠胶粒的包埋率,同时也降低了胶粒表面的粗糙度,抑制了孔隙产生,赋予胶粒更加致密平整的微观形态,这与SCNF能够提高海藻酸钠分子链的氢键缔合能力以及增加与Ca2+之间形成盐桥数量有关。进一步研究发现,这些结构致密的SA-SCNF胶粒经模拟胃肠液消化后能够更好地维持原有的机械强度,并对乳酸菌胃肠道逆环境起到良好的保护效果。另一方面,SCNF的添加对增加乳酸菌胃肠道逆环境耐受性具有积极影响。SCNF复合胶粒经模拟胃肠液消化后活菌数量超过107CFU/g,显著高于海藻酸钠载菌胶粒的106CFU/g。
