茶树精油对扩展青霉线粒体功能的影响
2021-03-02陈雪昱邹秀容韦莹莹王鸿飞邵兴锋
陈雪昱,邹秀容,2,韦莹莹,许 凤,王鸿飞,邵兴锋,*
(1.宁波大学食品与药学学院,浙江 宁波 315800;2.韶关学院英东食品学院,广东 韶关 512005)
扩展青霉(Penicillium expansum)引发的青霉病是造成苹果[1]、西红柿[2]、樱桃番茄[3]等果蔬采后腐烂的主要原因。化学杀菌剂是目前防治此类真菌病害的主要手段,但其局限性明显,易导致真菌产生耐药性,对人体健康和农业生态产生危害,这迫使研究人员寻找对人类健康和环境安全的方法来替代或部分替代化学杀菌剂。近年来,植物精油作为一种天然的绿色农药、环境友好型的生防试剂,广泛用于多种果蔬的采后真菌病害防控,不但抑菌谱广,且安全可靠[4]。在樱桃番茄[3]、甜桔[5]、胡萝卜[6]、蓝莓[7]等果蔬上的应用都表明,植物精油具有显著的防腐保鲜效果。
茶树精油(tea tree oil,TTO)是由桃金娘科(Myrtaceae)白千层属(Melaleuca)灌木树种互生叶白千层(Meloleuca ahernifolia)的新鲜枝叶经水蒸气蒸馏得到的芳香精油,包含松油烯-4-醇,α-松油醇和1,8-桉叶油等挥发性物质[8]。TTO无毒、气味清新怡人,被认为是抗菌、抗氧化和抗癌药品的良好选择[9]。Shi Ce等[10]研究发现TTO可以抑制金黄色葡萄球菌的生长和肠毒素的产生,且精油浓度越高,其抑制作用越明显。静玮等[11]研究TTO对香蕉的影响时发现,TTO能显著抑制炭疽病菌菌丝的生长,有利于香蕉的保鲜。钟业俊等[12]研究也表明,TTO能延缓香蕉腐烂。程赛等[13]用熏蒸法处理草莓,发现TTO可抑制灰葡萄孢霉(Botrytis cinerea)和根霉的孢子萌发以及菌丝生长,降低其发病率,延长草莓的货架期;TTO也可以有效控制樱桃番茄上由B.cinerea和P.expansum导致的腐烂[14]。因此,TTO具备商业化应用前景。
本课题组前期的研究发现,TTO的特征组分松油烯-4-醇和1,8-桉叶素可以作用于B.cinerea的不同亚细胞部位[15]和不同靶基因[16],进而通过破坏B.cinerea的膜结构导致细胞内物质泄漏[17]、影响B.cinerea线粒体功能[18]来发挥抑菌作用。TTO对P.expansum的抑制效果弱于对B.cinerea的抑制[19],这可能与P.expansum含有更高的细胞膜脂质和甾醇有关[14]。当TTO剂量在6.5 mL/L时可完全抑制P.expansum的菌丝生长[14],造成P.expansum细胞膜中的脂质和甾醇含量的下降,进而破坏呼吸代谢和细胞膜透性,导致P.expansum菌丝体和超微结构的显著改变[14]。本实验以TTO处理的P.expansum为对象,进一步深入研究活性氧(reactive oxygen species,ROS)的积累及线粒体功能相关酶活性的变化,并采用扫描电子显微镜(scanning electron microscopy,SEM)和透射电子显微镜(transmission electron microscopy,TEM)观察线粒体自身形态和超微结构受TTO的影响,以期能更好地揭示TTO对P.expansum生理功能的干扰机制,为TTO在果蔬采后领域的商业化应用提供理论参考。
1 材料与方法
1.1 菌株、材料与试剂
扩展青霉(P.expansum)购自中国农业微生物菌种保藏中心。
TTO由福州美乐莲生物科技有限公司提供,符合ISO 4730规定(松油烯-4-醇质量分数>30%、1,8-桉叶素质量分数<5%),是一种GRAS(generally recognized as safe)物质,可用于食品行业。
ROS测试盒、ATP酶(ATPase)试剂盒、柠檬酸合成酶(citrate synthase,CS)检测试剂盒、异柠檬酸脱氢酶(isocitrate dehydrogenase,ICDH)检测试剂盒、α-酮戊二酸脱氢酶(α-ketoglutarate dehydrogenase complex,α-KGDH)检测试剂盒、苹果酸脱氢酶(malate dehydrogenase,MDH)检测试剂盒、琥珀酸脱氢酶(succinate dehydrogenase,SDH)检测试剂盒 南京建成生物工程研究所;锇酸、环氧树脂包埋剂、醋酸双氧铀 美国SPI-CHEM公司。
1.2 仪器与设备
QHZ-12A型组合式恒温振荡培养箱 江苏省太仓市华美生化仪器厂;H2500R-2型高速冷冻离心机 长沙湘仪离心机仪器有限公司;Infinite M200 Pro多功能荧光酶标仪 瑞士Tecan公司;HCP-2临界点干燥机、20nm E-1010真空离子溅射镀金膜机、S-3400N SEM、H7650 TEM 日本日立公司;1260高效液相色谱仪 美国安捷伦公司。
1.3 方法
1.3.1 TTO对P.expansum的处理
1.3.1.1 TTO对P.expansum孢子的处理
根据Tian Jun等[20]的方法并略加修改,进行TTO对P.expansum孢子的处理。参考Li Yonghua等[14]报道的TTO对P.expansum的最小抑菌浓度(minimum inhibition concentration,MIC),本实验设置TTO的处理浓度为6.5 μL/mL(即MIC)。P.expansum菌种经活化后,转接到PDA培养基(去皮马铃薯200 g,加水1000 mL煮沸30 min,过滤后加入20 g葡萄糖和20 g琼脂)上25 ℃培养3 d,用无菌生理盐水洗下孢子,用血球计数板调节孢子浓度至2×107个/mL。孢子分别在浓度为1/4 MIC、1/2 MIC、MIC和2 MIC的TTO中处理2 h,处理后5 000 r/min离心5 min,并用0.05 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.0)清洗3 次,离心收集孢子。
1.3.1.2 TTO对P.expansum菌丝的处理
P.expansum菌种在PDA培养基上25 ℃培养3 d后用无菌生理盐水冲洗孢子,用血球计数板调至孢子浓度为106个/mL。移取3 mL孢子悬浮液,加入到含有150 mL PDB培养基(去皮马铃薯200 g,加水1 000 mL煮沸30 min,过滤后加入20 g葡萄糖)的锥形瓶中,25 ℃下150 r/min摇床培养3 d。在收集菌体2 h前(即摇床培养70 h时),在锥形瓶中分别加入一定量的含TTO的1%无菌吐温-80液体培养基,使TTO浓度分别为1/4 MIC、1/2 MIC、MIC和2 MIC;以加入不含TTO的6%无菌吐温液体培养基为对照组(即锥形瓶中仅含有1%的吐温-80)。每个组别设3 个平行,所有的锥形瓶在摇床25 ℃ 150 r/min继续培养2 h,再4 000 r/min离心10 min,并用4 ℃无菌的生理盐水清洗3 遍后收集得到菌丝,用于后续的线粒体提取和线粒体功能相关代谢酶活性研究。
1.3.2 孢子ROS相对含量的测定
ROS的相对含量按照ROS测试盒说明书步骤进行测定,使用多功能荧光酶标仪测定荧光值,以对照组荧光值为100%,计算各处理组与对照组荧光值的比值,记为ROS相对含量。
1.3.3 菌丝线粒体的提取
线粒体的提取参考罗曼等[21]的方法并稍作改进,所有过程均在4 ℃下操作完成。配制线粒体分离介质(含0.01 mol/L Tris、1 mmol/L Na2EDTA、10 g/100 mL蔗糖,pH 7.4)并预冷。将1.3.1.2节收集到的菌丝于研钵中加入液氮进行快速充分研磨,将研磨后的样品与线粒体分离介质按照1∶8(m/V)的比例加入预冷的离心管中,4 ℃、4 000 r/min离心10 min。收集上清液再于4 ℃、10 000 r/min离心15 min后保留沉淀,沉淀物再次按照1∶8(m/V)的比例加入线粒体分离介质后漩涡振荡20 s使其悬浮,继续4 ℃、10 000 r/min离心15 min。重复上述步骤洗涤2 次,向最终的沉淀物中加入1 mL线粒体分离介质,用移液枪吹打均匀,即得到线粒体原液,并于-40 ℃保存备用。
1.3.4 菌丝线粒体的形态结构观察
采用SEM观察线粒体形态,具体参照Yu等[15]的方法。将MIC TTO处理组菌丝和对照组所提取的线粒体样品,利用体积分数2.5%的戊二醛固定,样品经乙醇逐级洗脱,放入临界点干燥机中进行干燥,再在高真空离子溅射镀膜机进行金/钯涂层,于SEM下放大40 000 倍观察和拍照,每个重复组中取2 个平行进行观察。
采用TEM观察线粒体超微结构,具体参照Yu等[15]的方法。将经MIC TTO处理组菌丝和对照组所提取的线粒体样品,于体积分数2.5%的戊二醛中固定,再用体积分数1%锇酸固定,后经乙醇逐级脱水、环氧树脂包埋、聚合后修块,超薄切片。切片经醋酸双氧铀和柠檬酸铅染液分别进行铀、铅双染后,于TEM下放大120 000 倍观察和拍照,每个重复组中取2 个平行进行观察。
1.3.5 菌丝体内ATP含量和三羧酸循环相关酶活力的测定
1.3.5.1 ATP含量测定
ATP含量测定参考Jiang Weibo等[22]的方法。取1.3.1.2节收集到的MIC TTO处理组和对照组菌丝各2 g,加入10 mL 0.6 mol/L高氯酸溶液,冰水浴1 min,8 000×g离心10 min,吸取6 mL上清液,用1 mol/L KOH溶液调节其pH值至6.5~6.8之间,冰水浴30 min使高氯酸钾大量沉淀,过滤除去沉淀。ATP含量采用高效液相色谱法测定,色谱柱为配备的XDB C18柱(150 mm×4.6 mm),柱温25 ℃,缓冲液为50 mmol/L KH2PO4-K2HPO4(含1 mmol/L EDTA,pH 6.0),流动相:V(缓冲液)∶V(甲醇)=97.5∶2.5,15 min等梯度洗脱,流速为1.0 mL/min。检测波长为259 nm,进样量为10 µL。以ATP为标准品,以保留时间定性,峰面积定量,每个进样重复3 次。
1.3.5.2 ATPase活力测定
称取1.3.1.2节收集到的MIC TTO处理组和对照组的菌丝各1 g,加5 mL 0.05 mol/L PBS (pH 7.2),超声破碎15 min后4 ℃、1 500 r/min离心10 min获得粗酶液。ATPase活力用ATPase试剂盒进行测定。
1.3.5.3 三羧酸循环相关酶活力测定
取1/4 MIC、1/2 MIC、MIC、2 MIC TTO处理组和对照组菌丝样品各0.2 g,加5 mL 0.05 mol/L PBS(pH 7.2),超声破碎15 min后4 ℃、1 500 r/min离心10 min获得粗酶液。用相应试剂盒测定CS、ICDH和α-KGDH活力。
1.3.5.4 MDH和SDH活力测定
称取1/4 MIC、1/2 MIC、MIC、2 MIC TTO处理组和对照组菌丝样品各0.2 g,分别加入1.8 mL生理盐水,冰水浴条件下机械匀浆,2 500 r/min离心10 min获得粗酶液。用相应试剂盒测定MDH和SDH活力。
1.4 数据统计与分析
所有实验重复3 次,数据图片用Origin Pro 8.0软件绘制。采用SASS 17软件的单因素方差分析中的邓肯氏多重比较进行显著性差异分析,P<0.05表示差异显著。
2 结果与分析
2.1 TTO处理对P.expansum孢子ROS相对含量的影响
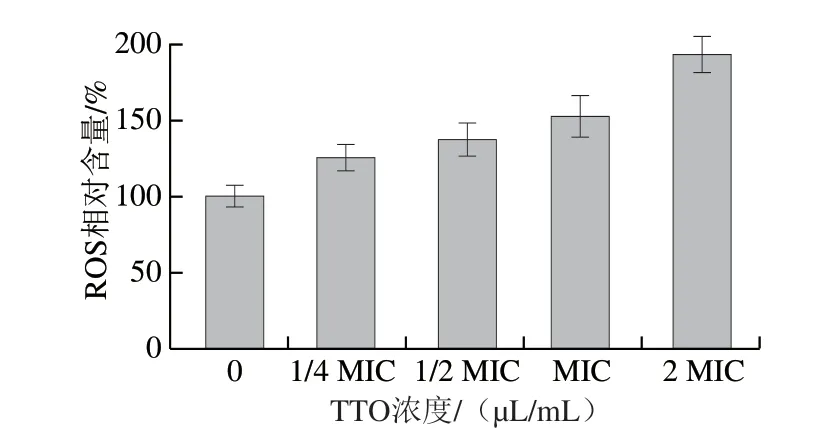
图1 TTO对P.expansum孢子中ROS相对含量的影响Fig.1 Effect of TTO on ROS relative content of P.expansum spores
由图1可知,随着精油浓度的增加,P.expansum孢子中ROS相对含量增加。与对照组相比,1/4 MIC、1/2 MIC、MIC、2 MIC TTO处理组的ROS相对含量分别上升了125%、137%、152%和193%。结果表明,不同浓度TTO处理均能使孢子内ROS大量积累。
2.2 TTO处理对P.expansum菌丝体内线粒体形态和超微结构的影响
SEM观察发现对照组P.expansum线粒体呈正常均匀的短棒状,形态饱满、表面光滑、完整、有规则;TTO处理组P.expansum的线粒体则出现皱缩、干瘪、不规则凹陷,形状异常(图2A)。TEM观察发现对照组P.expansum内外线粒体膜清晰可见,线粒体脊排列规则有序,而TTO处理组P.expansum的线粒体则呈现出肿胀的形态,短脊断裂、消失,囊泡出现(图2B),说明TTO使P.expansum线粒体基质肿胀、透明化,导致线粒体原先的内部结构被破坏,基质损失。

图2 P.expansum菌丝体内线粒体形态(A)及超微结构(B)变化Fig.2 Changes in mitochondrial morphology (A) and ultrastructure (B) of P.expansumc observed by TEM and SEM
2.3 TTO处理对P.expansum菌丝体内ATP含量和ATPase活力的影响
如图3所示,对照组P.expansum菌丝体细胞内部ATP含量为2.13 µg/g,而MIC TTO处理后P.expansum菌丝体细胞内部ATP含量为0.43 µg/g,下降了79.8%,表明MIC TTO处理极显著降低了P.expansum菌丝体细胞内部ATP的含量(P<0.01),导致了细胞内部ATP的流失。ATPase的活力呈现出与ATP含量相同的变化趋势,对照组ATPase活力为8.53 U/g,MIC TTO处理组ATPase活力为2.62 U/g,下降了69.3%(P<0.01)。结果表明,MIC浓度TTO处理导致菌丝体细胞内部ATP泄漏,并抑制了ATPase活力。
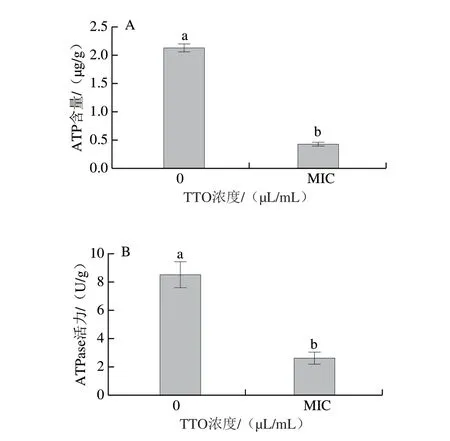
图3 TTO处理对P.expansum菌 丝体内ATP含量(A)和ATPase活力(B)的影响Fig.3 Effect of TTO on the content of ATP (A) and the activity of ATPase (B) in P.expansum mycelia
2.4 TTO处理对P.expansum菌丝体内CS、ICDH、α-KGDH活力的影响
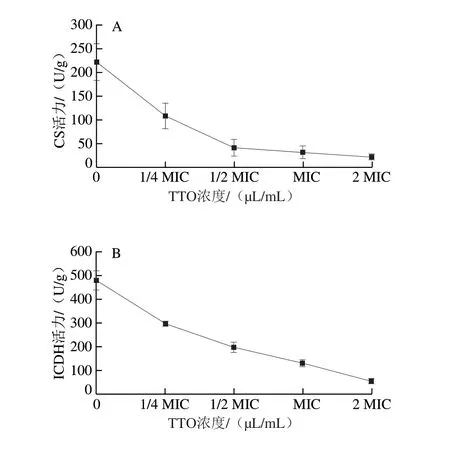
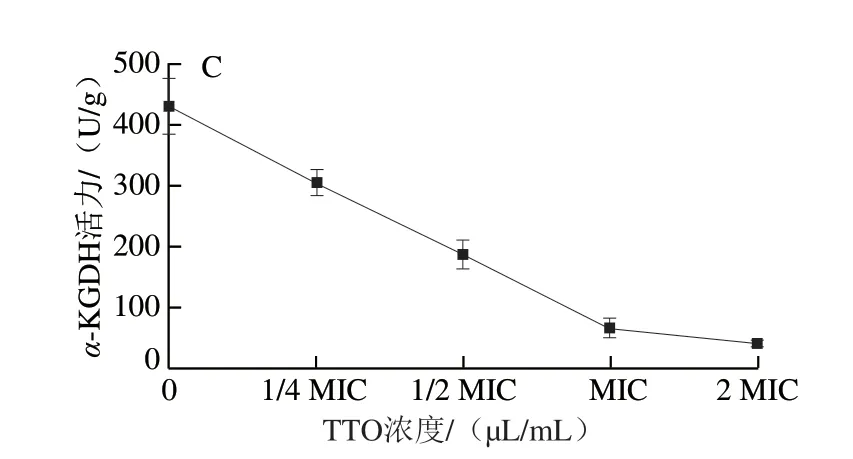
图4 TTO对P.expansum 菌丝体内CS(A)、ICDH(B)和α-KGDH(C)活力的影响Fig.4 Effect of TTO on the activities of CS (A), ICDH (B) and α-KGDH (C)in P.expansum mycelia
由图4可知,TTO处理组P.expansum中CS、ICDH、α-KGDH活力随着TTO处理浓度的增加均呈现出下降的趋势。当TTO浓度为1/2 MIC时,相对于对照组,CS、ICDH、α-KGDH活力分别下降了81.33%、58.81%和56.41%。当TTO浓度增加至MIC时,CS、ICDH、α-KGDH活力与对照组相比较分别下降了85.8%、72.6%和84.6%。而当TTO浓度增加到2 MIC时,CS、ICDH、α-KGDH活力与对照组相比分别下降了90.15%、88.49%和90.68%,酶活力基本被抑制,说明P.expansum的三羧酸(tricarboxylic acid,TCA)循环受到抑制。
2.5 TTO处理对P.expansum菌丝体内MDH和SDH活力的影响

图5 TTO对P.expansum 菌丝体内SDH活力(A)和MDH活力(B)的影响Fig.5 Effect of TTO on the activities of SDH (A) and MDH (B)in P.expansum mycelia
如图5所示,随着TTO浓度的增加,SDH和MDH活力均明显下降。当TTO浓度为1/4 MIC时,P.expansum的SDH和MDH活力分别为27.5 U/g和117.7 U/g,同对照组相比分别下降了36.5%和7.82%。当TTO浓度增加到MIC时,SDH和MDH活力与对照组相比分别下降了59.6%和69.8%。而当TTO浓度增加到2 MIC时,SDH和MDH活力同对照组相比分别下降了82.7%和80.6%。结果表明,TTO处理可通过降低线粒体功能关键酶活力,从而影响P.expansum中线粒体的正常功能,从而抑制菌体活性。
3 讨 论
近年来,植物精油作为一种天然的绿色农药、环境友好型的生防试剂,广泛用于多种果蔬的采后真菌病害防控,不但抑菌谱广,且安全可靠[4]。但植物精油潜在的抑菌机制还没有被完全了解,以前的研究认为植物精油对细胞膜有作用,包括对细胞膜的损伤,影响脂质、甾醇以及膜脂肪酸含量的变化[20,23-24],最终导致细胞物质的外泄和细胞的死亡。也有一些研究报道植物精油和其主要成分也可以通过影响线粒体的结构和功能产生抗菌活性[20,25],如本课题组的前期研究发现TTO可以显著影响B.cinerea线粒体的形态和功能[18]。
线粒体是真核生物细胞内提供能量产生和代谢的关键细胞器,除此外还起到维持pH值稳定、调节膜电位、细胞代谢与凋亡的信号传递等作用[26]。Zheng Shiju等[25]研究表明柠檬醛可以通过影响线粒体来发挥其抑菌活性,而且随着柠檬醛浓度的增加,线粒体的凹陷越明显,内部结构被破坏越严重。原因是线粒体膜的通透性增加,膜内小分子物质的损失和细胞新陈代谢的差异导致了线粒体的损伤,从而影响线粒体的组织和功能[20]。在本研究中,通过SEM和TEM观察,可以清晰发现TTO对线粒体的内外部结构产生作用,导致线粒体内部呈现出空腔和混乱,表面凹陷破损,内部成分被严重破坏,从而使线粒体无法正常发挥功能。细胞内外ATP含量的变化可以用来反映线粒体膜发生了不可逆转的破坏[25]。本实验发现,TTO处理后细胞内部ATP含量明显下降,所以TTO处理确实使线粒体膜的通透性发生变化,造成线粒体表面缺陷,从而导致细胞内部ATP的泄漏和细胞外部ATP含量的增加。ATP的泄漏通常意味着能量产生途径的损伤。ATPase是细胞内产生能量的关键酶。在ATPase的分解作用下,ATP中存储的能量被释放出来,用于生物的生命活动,例如细胞分裂、生长和矿质元素的吸收等[25]。本研究得出,TTO处理明显抑制了ATPase的活性,表明TTO处理不仅造成线粒体破损,导致细胞内部ATP泄漏,还对细胞内能量产生途径造成损伤,从而影响菌体活性,达到抑菌效果。
线粒体内部的TCA循环途径可以提供细胞生命活动所需要的能量和减少还原力[27],TCA循环的破坏会导致细胞死亡[28]。CS、ICDH、α-KGDH、MDH和SDH都是在TCA循环、线粒体功能中发挥重要作用的酶。CS可以促进乙酰辅酶A的缩合,形成柠檬酸盐、辅酶A和一个质子[29]。ICDH可以调节异柠檬酸进入TCA循环或者乙醛酸循环[30]。α-KGDH活力下降会导致TCA循环产生NADH和随后细胞合成ATP的能力下降[31]。MDH可以将苹果酸盐转化为草酰乙酸盐[32]。SDH可以将氧化的琥珀酸盐转化为延胡索酸盐,还可以将电子从琥珀酸盐转移到泛醇[33]。Zheng Shiju等[25]报道称柠檬醛可以抑制青霉的TCA循环,而且随着柠檬醛浓度的增加,CS、ICDH、α-KGDH的活性下降。在本研究中,MIC TTO处理几乎完全抑制了CS、ICDH、α-KGDH的活性。Wu Xiuzhen等[34]研究表明羽苔素E能够通过降低假丝酵母线粒体脱氢酶的活性来发挥抗菌活性。Tian Jun等[20]报道称莳萝精油可以降低黄曲霉中脱氢酶的活性,表明莳萝精油可以通过破坏细胞膜的通透性来发挥抗菌活性。也有报道称肉桂精油可以通过降低SDH和MDH活性来影响根霉菌的能量代谢[35],杨树芽活性提取物对青霉处理后也出现了同样的效果[36]。在本研究中,P.expansum菌丝体内的SDH和MDH的活力均随着TTO处理浓度的增加而降低。可见,在TTO处理下,线粒体内TCA循环和线粒体功能相关的几个重要酶的活性均被抑制,TCA循环和线粒体功能受到严重干扰,导致细胞无法正常代谢,菌体活性降低或丧失。说明TTO处理可破坏P.expansum线粒体相关代谢途径,从而有效抑菌。
同时,线粒体呼吸链是内生ROS的主要来源,尤其是在线粒体受到破坏后[20]。ROS的积累会导致酶失活、膜破坏和细胞死亡[37]。ROS的积累也被认为是细胞凋亡的主要生物标记,还会导致细胞形态学的改变、细胞核的断裂、染色质的凝集、细胞肿胀等[38]。莳萝油处理会导致黄曲霉ROS的积累和氧化损伤[20]。硼酸盐处理也会使盘长孢状刺盘孢子内部ROS积累,导致线粒体的损伤[39]。Wu Xiuzhen等[34]报道称羽苔素E可以导致白色念珠菌线粒体的破坏和内部ROS的产生。Zheng Shiju等[25]研究发现柠檬醛处理会导致一个和多个电子传递链组分的显著缺乏,损伤青霉的抗氧化系统和增加细胞内部的氧化压力。本研究结果表明TTO处理可以诱导P.expansum体内ROS的产生和积累,这与线粒体的功能紊乱会导致细胞氧化损伤有关。
TTO处理导致了P.expansum孢子体内ROS的大量积累,损坏了菌丝线粒体形态和超微结构,造成了菌丝体内ATP流失,降低了菌丝体内线粒体功能相关酶类的活性。因此,认为线粒体功能的严重受损是TTO对P.expansum发挥抑制作用的重要原因。
