纳米二氧化铈杂化改性SDB载体的合成及模拟吸附
2021-03-02陈文姣陈海燕于杰昌刘才林任先艳杨海君
陈文姣,陈海燕,2,于杰昌,余 莉,刘才林,*,任先艳,杨海君
1.西南科技大学 材料科学与工程学院,四川 绵阳 621010;2.四川大学 高分子研究所,四川 成都 610065
含氚废水处理是我国核电发展的瓶颈,尤其是内陆核电站发展亟待解决的难题,Pt/苯乙烯-二乙烯基苯共聚物(Pt/SDB)氢-水液相催化交换(LPCE)除氚是各国竞相重点发展的氚废水处理技术[1-2]。但目前使用的SDB载体存在疏水能力不足、强度低、Pt分散性差等缺点,克服以上不足,是目前SDB改性合成的主要目标[3]。有机-无机杂化基于两相间的强相互作用或复合作用,有望制得有机高分子韧性与无机材料刚性兼备的性能突出的新材料,尤其是聚合物基体与无机纳米粒子的杂化,能明显提高聚合物的机械力学性能、耐热性能等[4]。纳米二氧化铈(nano-CeO2)属于立方晶系,无毒性、热稳定性优异,其结构中具有特殊的4f电子轨道,可有效提高聚合物材料的抗老化、抗辐射和耐候性,且作为纳米无机材料,表现出突出的物理性能[5]。研究表明,Pt/CeO2复合材料较二者混合物具有更强的催化能力及优异的热稳定性[6]。在LPCE实际操作过程中,Pt/SDB催化剂中Pt的负载量、分散性以及颗粒直径等对其催化性能有明显影响。浸渍法是制备Pt/SDB的有效方法,然而关于Pt离子的吸附过程与相关检测的报道很少。Ni与Pt同属Ⅷ族的过渡金属元素,两者理化性质具有相似性,且现已报道了多种快速检测Ni2+的方法,便于监控反应过程中Ni2+浓度的变化[7]。此外,本课题组之前对Ni2+在不同改性载体表面的吸附行为进行了讨论分析,提供了一定的理论方法和实践经验[8]。因此,尝试采用Ni元素代替Pt元素进行SDB的负载模拟研究,具有一定的可行性,有助于深入探究Pt与载体之间的作用,促进国内含氚废水的液相催化交换技术的发展。
本工作拟采用界面相容剂硬脂酸进行表面疏水化改性的纳米二氧化铈(Y-CeO2)、苯乙烯(St)、二乙烯基苯(DVB)为原料,通过原位聚合法,制备无机纳米材料改性的Y-CeO2/SDB疏水催化剂载体,以期实现其超疏水化与高强度化;采用Ni2+模拟Pt离子分别进行SDB、Y-CeO2/SDB的离子吸附研究,通过吸附动力学、吸附热力学等对吸附过程进行分析描述,为SDB负载Pt提供理论支持。
1 实验部分
1.1 试剂与仪器
苯乙烯、二乙烯基苯、纳米CeO2,均为分析纯,阿拉丁生化科技股份有限公司;其它试剂均为分析纯,成都市科隆化学品有限公司。
DF-101S集热式磁力加热搅拌器,江苏金怡仪器科技有限公司;DZF-6050真空干燥箱,上海齐欣仪器有限公司;SHZ-DⅢ循环水真空泵,巩义予华仪器有限公司;AL104电子天平,精度为0.1 mg,梅特勒托利多有限责任公司;KQ3200DE数控超声波清洗器,昆山市超声仪器有限公司;UV-1800PC型紫外-可见分光光度计,上海美谱达仪器有限公司;Spectrum One傅里叶变换红外光谱仪(FTIR),美国PE公司;X Pert Pro MPD X射线衍射仪(XRD),荷兰帕纳科公司;UItra 55高分辨冷场发射扫描显微镜,德国Carl zeissNTs GmbH公司;DSA 30研究型接触角测量仪,德国克吕士公司;CMT 4104微机控制型电子万能试验仪,美斯特工业(中国)公司;SDT Q600同步热分析仪,美国TA公司;Autosorb-iQ全自动比表面和孔径分布分析仪,美国康塔公司。
1.2 实验过程
1.2.1纳米CeO2的表面疏水改性 称取适量纳米CeO2,超声分散于溶剂体系,氮气保护下,加入有冷凝装置的三口烧瓶中搅拌反应,一定温度下,加入适量硬脂酸,加热至80 ℃,反应1.5 h,经甲苯、乙醇洗涤后抽滤,60 ℃真空干燥,即得改性后的Y-CeO2。
1.2.2SDB及Y-CeO2/SDB的制备 SDB的制备:以m(去离子水)∶m(聚乙烯醇(PVA))=100∶1配制分散水相;以St、DVB为聚合单体,与适量甲苯、二氯乙烷、正庚烷混合为油相;混合油、水两相,在过氧化苯甲酰(BPO)的引发下,悬浮共聚制备SDB疏水载体,产物使用去离子水、乙醇和丙酮洗涤数次。纳米CeO2杂化改性苯乙烯-二乙烯基苯共聚物(Y-CeO2/SDB)的制备:将适量Y-CeO2超声分散于上述油相中,并混合油、水两相,原位共聚制备改性SDB疏水载体,其余步骤同上。
1.2.3SDB及改性SDB载体的模拟吸附研究
(1) Ni2+浓度标准曲线
通过紫外分光光度法,以Ni2+浓度标准曲线为基准,精确计算载体吸附后剩余Ni2+浓度,快速检测吸附量。具体步骤如下:配制0.5 g/L的NiCl2·6H2O溶液,分别配制w=30%的(NH4)2S2O8和5%的NaOH水溶液,将0.5 g丁二酮肟溶解于50 mL 乙醇中,采用紫外分光光度计测定430~470 nm范围的Ni2+配合物的特征吸收曲线。
(2) 吸附动力学
取120 mL 0.5 g/L NiCl2溶液,依次加入(NH4)2S2O8溶液、NaOH溶液、丁二酮肟溶液、乙醇溶液,将SDB及Y-CeO2/SDB载体分别分次取0.8、1.6、2.4 g加入混合溶液中,进行吸附实验。分别在10、20、30、40、50、60、70、80、90 min,2.5、7.5、24 h时测试其UV-vis吸收光谱。
采用拉格朗日(Lagrangain)准一级/二级动力学方程描述该吸附过程,动力学方程如式(1)、(2)。
准一级动力学方程:
lg(qe-qt)=lgqe-(k1t)/2.303
(1)
准二级动力学方程:
(2)
式中:qe、qt分别表示平衡时和t时刻单位质量吸附剂的离子吸附量,mg/g;k1为准一级吸附速率常数,min-1;k2为准二级吸附速率常数,g/(mg·min);t为吸附时间,min。分别采用lg(qe-qt)、t/qt对t作图,根据所得直线的斜率计算k1、k2和qe值。
(3) 吸附热力学
取30 mL上述NiCl2溶液,加入体积分数为6%的乙醇溶液,分别加入0.5 g待测SDB或Y-CeO2/SDB载体,分别在25、35、45、55、65、75 ℃下搅拌吸附3 h后,取12 mL溶液至50 mL容量瓶中,加入(NH4)2S2O8溶液、NaOH溶液、丁二酮肟溶液各5 mL,用去离子水定容,测定每组溶液的UV-vis吸收光谱。
吸附热力学可用于描述该过程的驱动力及反应程度,采用式(3)—(5)计算各组分的热力学参数。
lnK=-ΔH/(RT)+C
(3)
ΔG=-RTlnK
(4)
ΔS=(ΔH-ΔG)/T
(5)
式中:K为平衡常数;ΔG、ΔH、ΔS分别为吉布斯自由能、焓变、熵变;R为气体常数(R=8.314 J/(mol·K));T为绝对温度,K。
由lnK-1/T的拟合曲线计算ΔH,由式(4)、(5)计算ΔG、ΔS。
2 结果与讨论
2.1 改性纳米CeO2的硬脂酸用量
采用硬脂酸改性纳米CeO2,并通过静态水接触角测试判定改性结果的优良程度,方案列入表1。由表1可知,采用方案3得到的改性纳米CeO2疏水性最优。因此,建立的纳米CeO2疏水改性方案为:2.5 g纳米CeO2,超声分散于60 mL乙醇中,氮气保护下,加入有冷凝装置的三口烧瓶中搅拌反应,缓慢升温至70 ℃后加入6%的硬脂酸,加热至80 ℃,反应1.5 h,经甲苯、乙醇洗涤后抽滤,60 ℃真空烘干,即得改性后的Y-CeO2。

表1 硬脂酸用量及实验条件对改性纳米CeO2疏水性的影响Table 1 Effects of amount and experimental conditions of stearic acid on modified nano-CeO2
2.2 杂化改性的Y-CeO2用量
Y-CeO2的用量对Y-CeO2/SDB颗粒形貌、粒径分布的影响示于表2。由表2可知:优化的Y-CeO2的反应投入质量为0.8 g,建立的原位聚合Y-CeO2用量与单体的质量比为:m(St)∶m(DVB)∶m(Y-CeO2)=10∶10∶0.8。
2.3 SDB及Y-CeO2/SDB载体测试分析

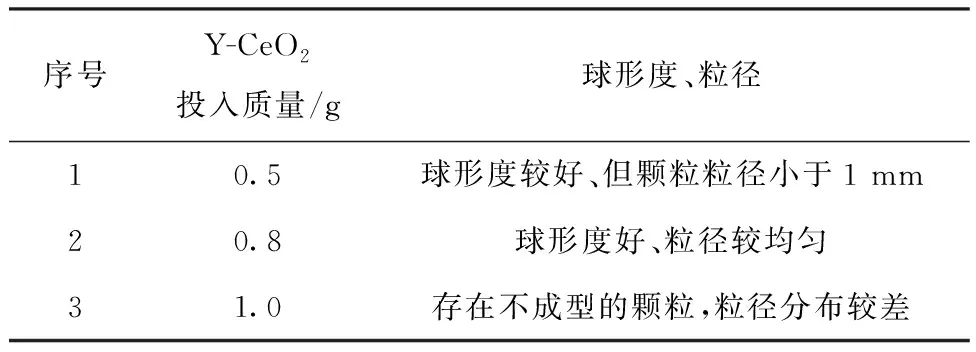
表2 Y-CeO2的用量对Y-CeO2/SDB颗粒形貌、粒径分布的影响Table 2 Effect of amount of Y-CeO2 on morphologyand size distribution of Y-CeO2/SDB
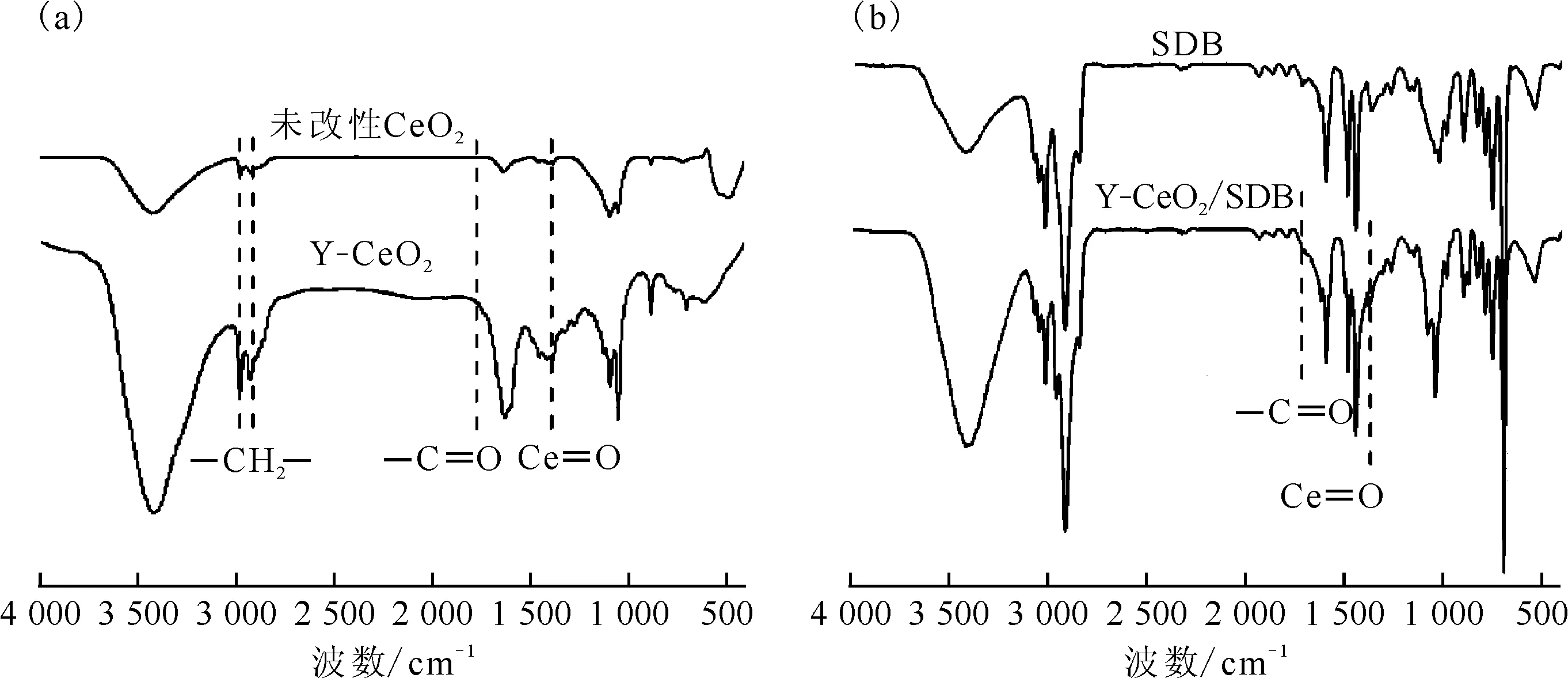
图1 CeO2、Y-CeO2粉体(a)和SDB、Y-CeO2/SDB载体(b)的FTIR图Fig.1 Infrared spectra of CeO2, Y-CeO2(a) and SDB, Y-CeO2/SDB carriers(b)
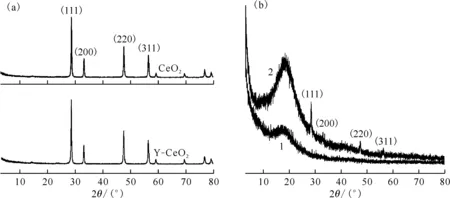
(b):1——SDB,2——Y-CeO2/SDB图2 CeO2、Y-CeO2粉体(a)及SDB、Y-CeO2/SDB载体(b)的XRD图Fig.2 X-ray pattern of CeO2, Y-CeO2 powder(a) and SDB, Y-CeO2/SDB carriers(b)
2.3.2XRD分析 采用X射线衍射法测定纳米CeO2粉体改性前后的晶体结构和SDB、Y-CeO2/SDB改性载体的分子结构,衍射图谱示于图2。由图2(a)可知:纳米CeO2粉体改性前后的衍射峰完全相同,分别在2θ=28.5°、33.1°、47.5°和56.4°附近出现CeO2的(111)、(200)、(220)和(311)晶面衍射峰且没有位移,未出现杂质吸收峰,与标准卡片(PDF#75-0151)一致,说明表面改性剂吸附在CeO2粉体表面或与表面羟基发生化学键合作用,没有引起晶体结构(萤石结构)的变化。由图2(b)可知:SDB、Y-CeO2/SDB改性载体的图谱类似,均在2θ=10°~20°范围内出现高分子基体的非晶弥散峰,与文献[11]一致,其中Y-CeO2/SDB曲线中出现与CeO2一致的明显晶面衍射峰,说明Y-CeO2存在于改性载体结构中,且晶相没有发生破坏。
2.3.3SEM分析 SDB、Y-CeO2/SDB载体的表面形貌扫描图示于图3。由图3可知:整体而言,两种载体的颗粒规整度良好,表面平整无裂缝或突起,粒径约为3~4 mm。对SDB载体的表面微区放大约6 000倍(图3(c)),其表面相对光滑,没有明显的沟纹或开裂,且均匀分布有尺寸不同的孔隙,符合SDB载体的多孔性质。Y-CeO2/SDB载体在电子束照射成像时,其结构中的CeO2晶体呈现出亮白光点,如图3(d),与基体形成鲜明的颜色对比,可明显观察到其分散均匀,且进一步放大后,可清楚地观察到表面存在的交联孔或堆叠孔隙,交联密实且孔分布良好,具有较多的活性反应位点(图3(e))。
2.3.4疏水性能分析 Y-CeO2改性粉体、SDB及Y-CeO2/SDB改性疏水载体的静态水接触角示于图4。经测试,未改性CeO2的水溶性较好,静态水接触角为0°。而改性后Y-CeO2粒子吸附了硬脂酸,实现了表面疏水化,静态水接触角达到134.08°(图4(a))。由图4(b)和(c)可知:SDB的静态水接触角为132.81°,较文献[12-13]有所提高,达到LPCE的使用要求,而Y-CeO2/SDB载体由于共聚的Y-CeO2表面的长碳链向外,与H2O之间形成较强的位阻效应,静态水接触角提高至152.96°,达到超疏水。

图3 SDB载体不同放大倍数表面形貌图(a、b)及局部放大图(c),Y-CeO2/SDB载体表面形貌图(d)和局部放大图(e)Fig.3 SEM images of SDB carriers at different magnifications(a, b) and that of partial enlarged SDB surface(c), SEM images of Y-CeO2/SDB carrier(d) and that of partial enlarged Y-CeO2/SDB surface(e)

图4 Y-CeO2(a)、SDB(b)及 Y-CeO2/SDB载体(c)的静态水接触角Fig.4 Static water contact angle of Y-CeO2 powder(a), SDB(b) and Y-CeO2/SDB carriers(c)
2.3.5抗压强度测试 万能试验机测定SDB和Y-CeO2/SDB载体的抗压强度值列入表3。由表3可知,SDB的抗压强度值为32.07 N,Y-CeO2/SDB则提高至113.54 N,较前者提高了254%。这可能是由于Y-CeO2改性引入了长碳链,分子链间相互缠绕使得SDB载体内部规整性被破坏,避免了应力集中。同时,作为无机刚性材料,CeO2本身就具有更加优异的力学性能。因而Y-CeO2进入SDB基体能有效提高SDB载体的抗压强度,体现出了无机杂化改性的增强效应。

表3 SDB及Y-CeO2/SDB载体的抗压强度值Table 3 Compressive strength of SDB and Y-CeO2/SDB carriers
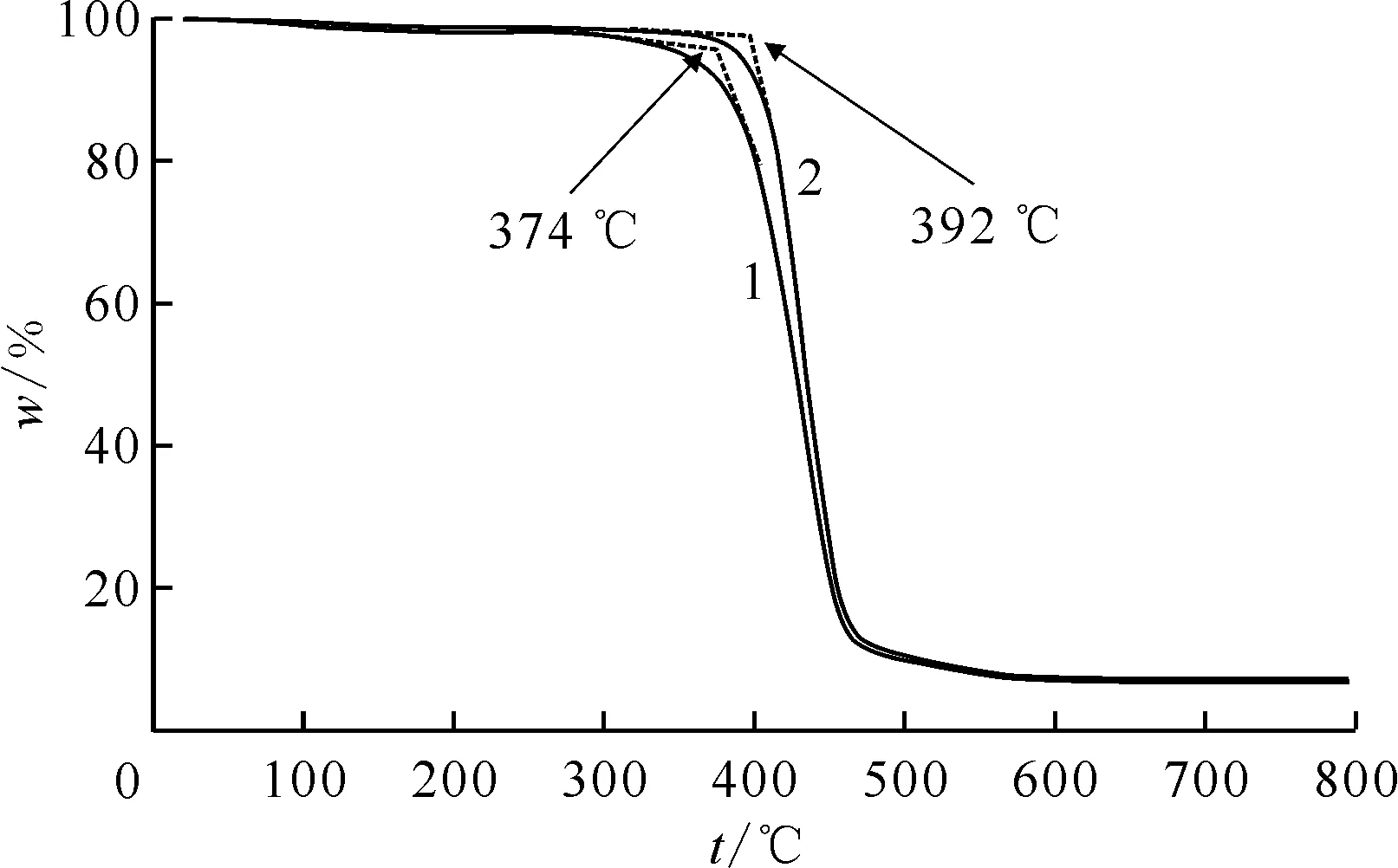
1——SDB,2——Y-CeO2/SDB图5 SDB及Y-CeO2/SDB载体的TGA曲线Fig.5 Thermogravimetric curves of SDB and Y-CeO2/SDB carriers
2.3.6热学性能分析 N2气氛下SDB和Y-CeO2/SDB两种载体从室温~800 ℃的热重(TGA)曲线示于图5。由图5可知:两种载体具有相似的热性质,SDB载体、Y-CeO2/SDB载体的初始分解温度分别为374 ℃和392 ℃,而且后续分解温度均较高,热稳定性明显提高。
2.3.7氮吸附测试 SDB和Y-CeO2/SDB改性载体的氮吸附-脱附曲线示于图6。由图6可知,两条曲线形状相似,均出现滞后环且最终在饱和蒸气压处重合,属国际纯粹与应用化学联合会(IUPAC)分类中第Ⅵ型等温线。两组曲线在p/p0<0.6时近乎重叠,表明存在对N2的单层吸附和微孔填充;随着p/p0的增加,吸附量迅速增加,两组吸、脱附曲线逐渐发生分离,形成形状不同的H1型迟滞回线,且曲线斜率有显著差异,可能是由于样品结构中存在堆积形成的介孔或大孔对N2的多层吸附及毛细凝聚。采用比表面积测试法(BET)和Barrett-Joyner-Halenda(BJH)分别计算比表面积、平均孔径及孔容,结果列入表4。由表4可知:原位聚合引入的无机纳米CeO2杂化改性的Y-CeO2/SDB,较改性前的SDB孔容略微减小,但是平均孔径降低更为显著,因而载体的比表面积更大。
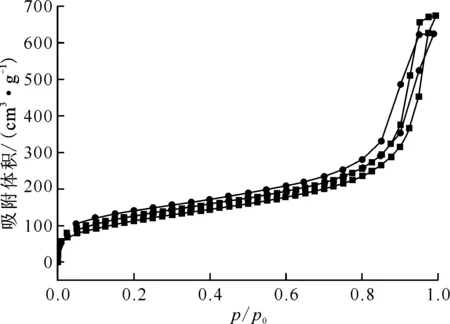
■——SDB,●——Y-CeO2/SDB图6 SDB及Y-CeO2/SDB载体的氮吸附-脱附中相对压力与吸附体积的关系曲线Fig.6 Relationship between relative pressure and adsorption volume on nitrogen adsorption-desorption curves of SDB and Y-CeO2/SDB carriers
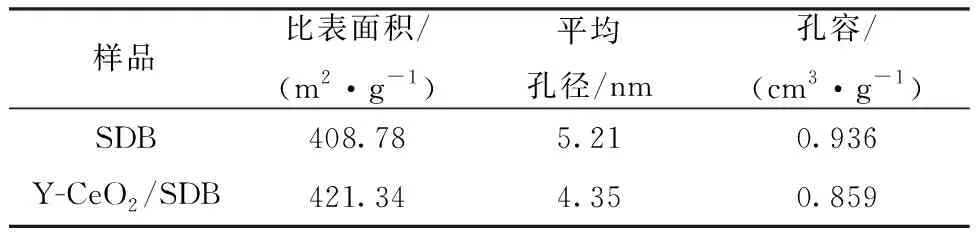
表4 SDB和Y-CeO2/SDB载体的孔结构参数Table 4 Pore structure parametersof SDB and Y-CeO2/SDB carriers
2.4 Ni2+的吸附性能研究
(1) Ni2+标准曲线
丁二酮肟与Ni2+可形成酒红色配合物,在一定范围内,Ni2+浓度与吸光度关系遵循Lambert-Beer定律。空白实验加入丁二酮肟等物质后未显色,说明显色是基于生成的Ni2+配合物。以V(去离子水)∶V(乙醇)=1∶1为参比背景,配合物的吸收峰值位于439 nm。本实验所对应的八组UV-vis吸收光谱曲线示于图7(a),吸光度列入表5。
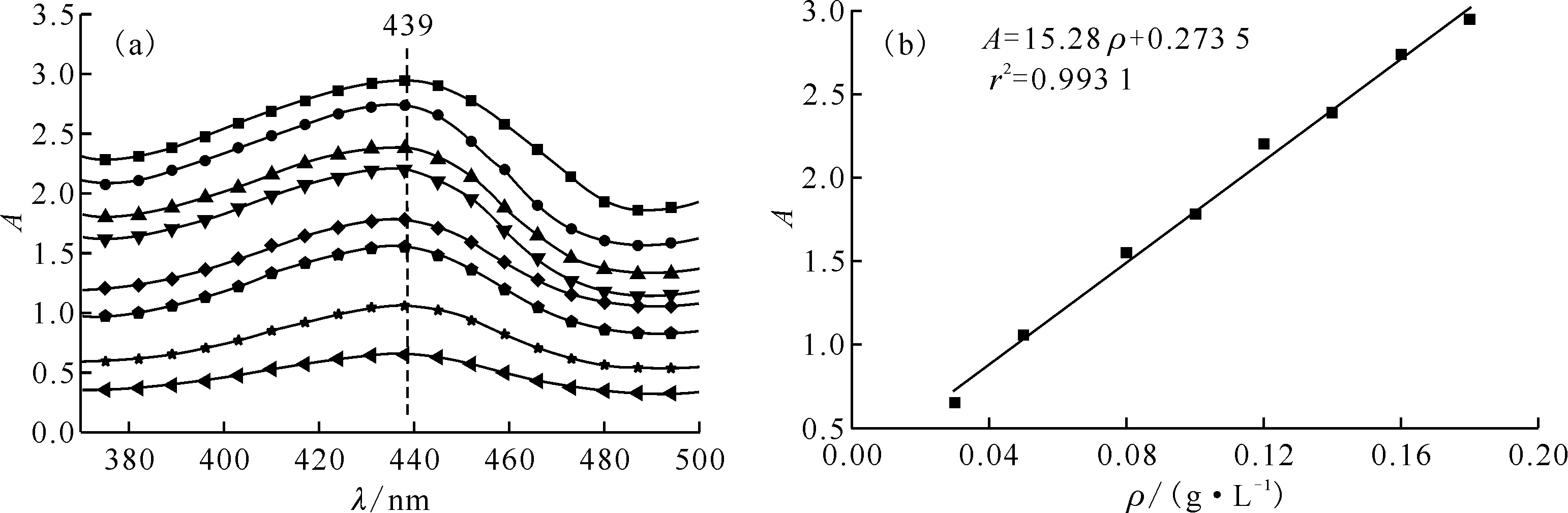
(a):ρ(Ni2+),g/L:■——0.18,●——0.16,▲——0.14,▼——0.12,◆——0.10,——0.08,★——0.05,◀——0.03(b):λ=439 nm;■——实验值,— ——拟合曲线图7 不同Ni2+浓度的UV-vis吸收曲线(a)和Ni2+浓度的标准曲线(b)Fig.7 UV-vis absorption curves(a) for different concentrations of Ni2+, standard curve(b) of Ni2+ concentration
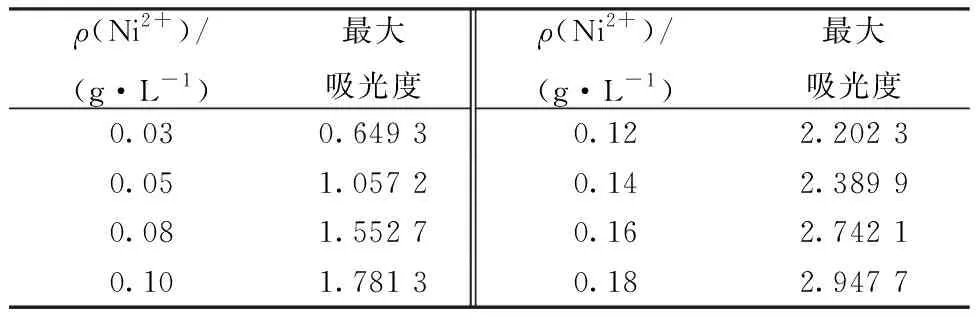
表5 不同Ni2+浓度下的UV-vis最大吸光度Table 5 UV-vis maximum absorbanceat different concentrations of Ni2+
通过最小二乘法计算该曲线的线性拟合方程为式(6)(图7(b))。
A=15.28ρ+0.273 5
(6)
式中:A为波长439 nm处的吸光度;ρ为Ni2+质量浓度,g/L。拟合系数r2=0.993 1,说明吸光度与Ni2+浓度具有良好线性关系。
(2) 吸附动力学
载体的吸附动力学对研究其吸附热力学性质至关重要。取SDB载体、Y-CeO2/SDB载体,测定并对比其对Ni2+的吸附量随时间的变化关系,结果示于图8,曲线上各点的斜率反映该时间点的瞬时吸附速率。由图8可知:SDB载体、Y-CeO2/SDB载体对Ni2+的吸附速率均为反应初期增长较快,吸附量随时间的延长而增大;当吸附2.5 h后,吸附过程趋于平衡,吸附量随时间的变化较小,吸附速率逐渐降低至接近0。反应初期,载体上存在大量可吸附位点,载体与Ni2+溶液的界面浓度梯度较大,传质推动力起主要作用,促进Ni2+在表面的吸附和进入孔道内部。改性载体的平均吸附量高于SDB,因为Y-CeO2/SDB表面存在的CeO2的4f轨道、引入的官能团,可能与Ni2+发生化学作用,增加了其吸附量。随着吸附的持续进行,吸附位点被大量占据,孔道的吸附量逐渐接近饱和,表面官能团全部参与Ni2+的化学键合或配位作用,且浓度梯度减小,直到进入扩散作用主导的动态吸附平衡过程,曲线上表现为吸附速率降低至零。整个吸附过程中,随着载体质量的增加,吸附量反下降,这是因为相同浓度下,载体数目增多必使吸附反应位点增加,短时间内更易达到吸附平衡,且由于形成竞争吸附,造成吸附量降低。
分别采用拉格朗日准一级/二级动力学,对SDB及Y-CeO2/SDB载体与Ni2+之间的吸附动力学进行拟合,结果示于图9、图10,相关动力学参数列入表6。其中,拉格朗日准一级动力学主要用于描述固液界面之间的物理吸附过程,而准二级动力学更适合描述吸附质与吸附剂之间的化学吸附作用。
综合分析图9、10和表6可知,对于Y-CeO2/SDB载体,采用拉格朗日准二级动力学拟合的r2值更接近于1,因此更适合采用化学吸附描述该载体与Ni2+的吸附特征,说明化学键的形成是Y-CeO2/SDB载体吸附Ni2+的主导因素。对SDB载体而言,采用拉格朗日准一级/二级动力学拟合的结果相差较小,说明该吸附过程中,存在吸附推动能力相近的固液界面扩散型物理吸附和化学配位或反应的化学吸附,但物理吸附更为主动。
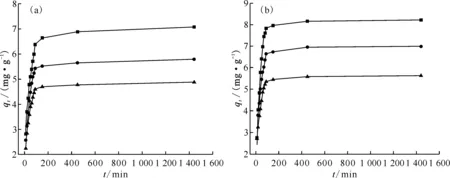
m,g:■——0.8,●——1.6,▲——2.4图8 SDB(a)及Y-CeO2/SDB载体(b)对Ni2+吸附量与吸附时间的关系Fig.8 Relationship between SDB(a) and Y-CeO2/SDB carriers(b) on adsorption amount of Ni2+ with time
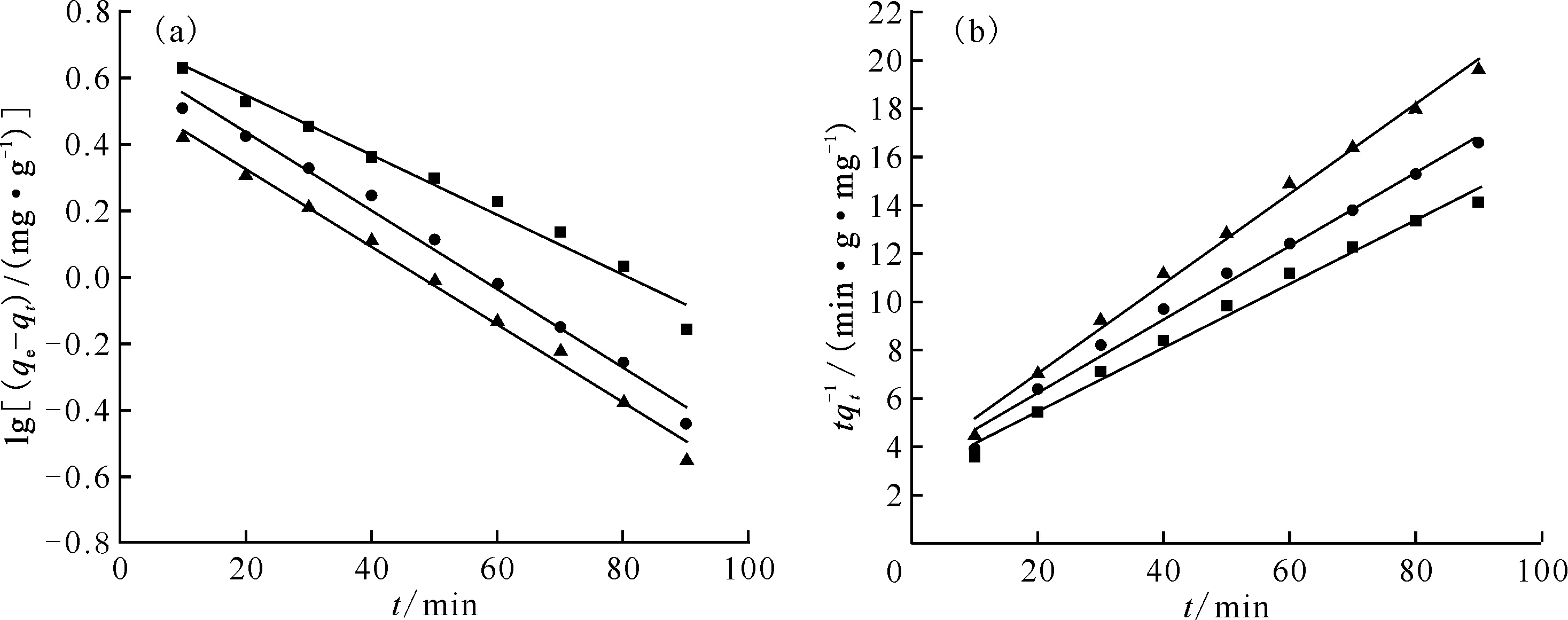
m(SDB),g:■——0.8,●——1.6,▲——2.4(a):■——y=-0.009 010x+0.729 4,●——y=-0.011 77x+0.672 9,▲——y=-0.011 74x+0.560 5;(b):■——y=0.131 9x+2.865,●——y=0.152 1x+3.220,▲——y=0.185 5x+3.337图9 SDB载体对Ni2+吸附的拉格朗日准一级动力学拟合曲线(a)和准二级动力学拟合曲线(b)Fig.9 Lagrangian pseudo-first-order kinetics fitting curves(a) and pseudo-second-order kinetics fitting curves(b) of SDB carriers for Ni2+ adsorption
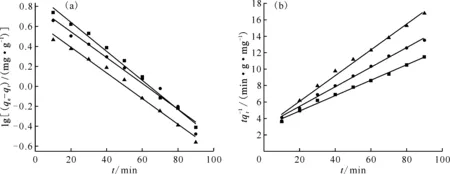
m(Y-CeO2/SDB),g:■——0.8,●——1.6,▲——2.4(a):■——y=-0.014 47x+0.932 8,●——y=-0.012 94x+0.807 0,▲——y=-0.012 90x+0.651 5;(b):■——y=0.093 69x+3.037,●——y=0.118 8x+3.109,▲——y=0.156 8x+2.935图10 Y-CeO2/SDB载体对Ni2+吸附的拉格朗日准一级动力学拟合曲线(a)和准二级动力学拟合曲线(b)Fig.10 Lagrangian pseudo-first-order kinetics fitting curves(a) and pseudo-second-order kinetics fitting curves(b) of Y-CeO2/SDB carriers for Ni2+ adsorption
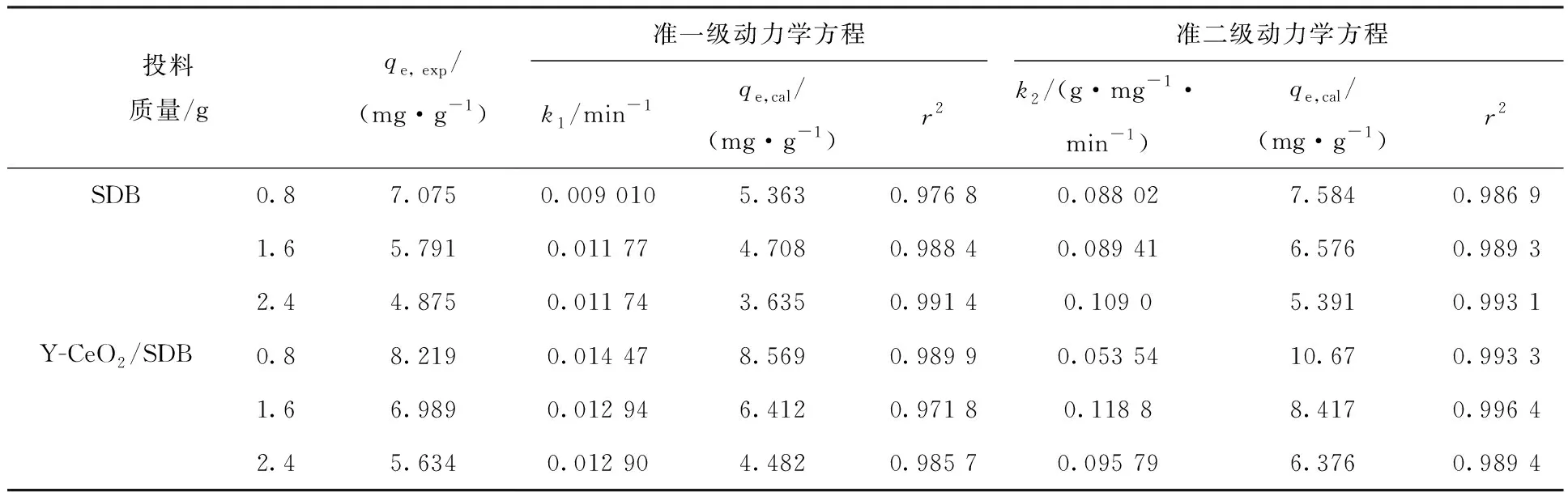
表6 SDB及Y-CeO2/SDB载体对Ni2+的吸附动力学参数Table 6 Adsorption kinetics parameters for Ni2+ of SDB and Y-CeO2/SDB carriers
(3) 吸附热力学
测定SDB、Y-CeO2/SDB载体对Ni2+的吸附热力学,采用lnK-1/T拟合曲线结合式(3)计算ΔH值,曲线示于图11,并通过式(4)、(5)计算相关参数值,结果列入表7。由表7可知:实验温度范围内,两种载体的K值随温度的升高而增加,且吸附过程中焓变ΔH>0,说明吸附过程吸热;吉布斯自由能ΔG>0,吸附过程为非自发,但ΔG随温度升高而降低,说明升温有助于反应的自发进行;熵变ΔS>0,表明载体在吸附过程中,体系有序性减小,这可能是由于溶质Ni2+和溶剂H2O分子与固体载体的表面作用能力不同,分子体积也不同,当温度升高,Ni2+的解吸和H2O分子的吸附同时发生,H2O分子的解吸使溶液体系熵值增加,Ni2+的吸附使体系熵值减小,但离解回到溶液中的H2O分子的量远高于载体吸附的Ni2+的量,表现为熵增大于熵减,吸附熵值为正。吸附热力学研究表明,SDB及Y-CeO2/SDB载体对Ni2+的吸附在高温下易自发进行,但反应体系的有序性会有所降低。
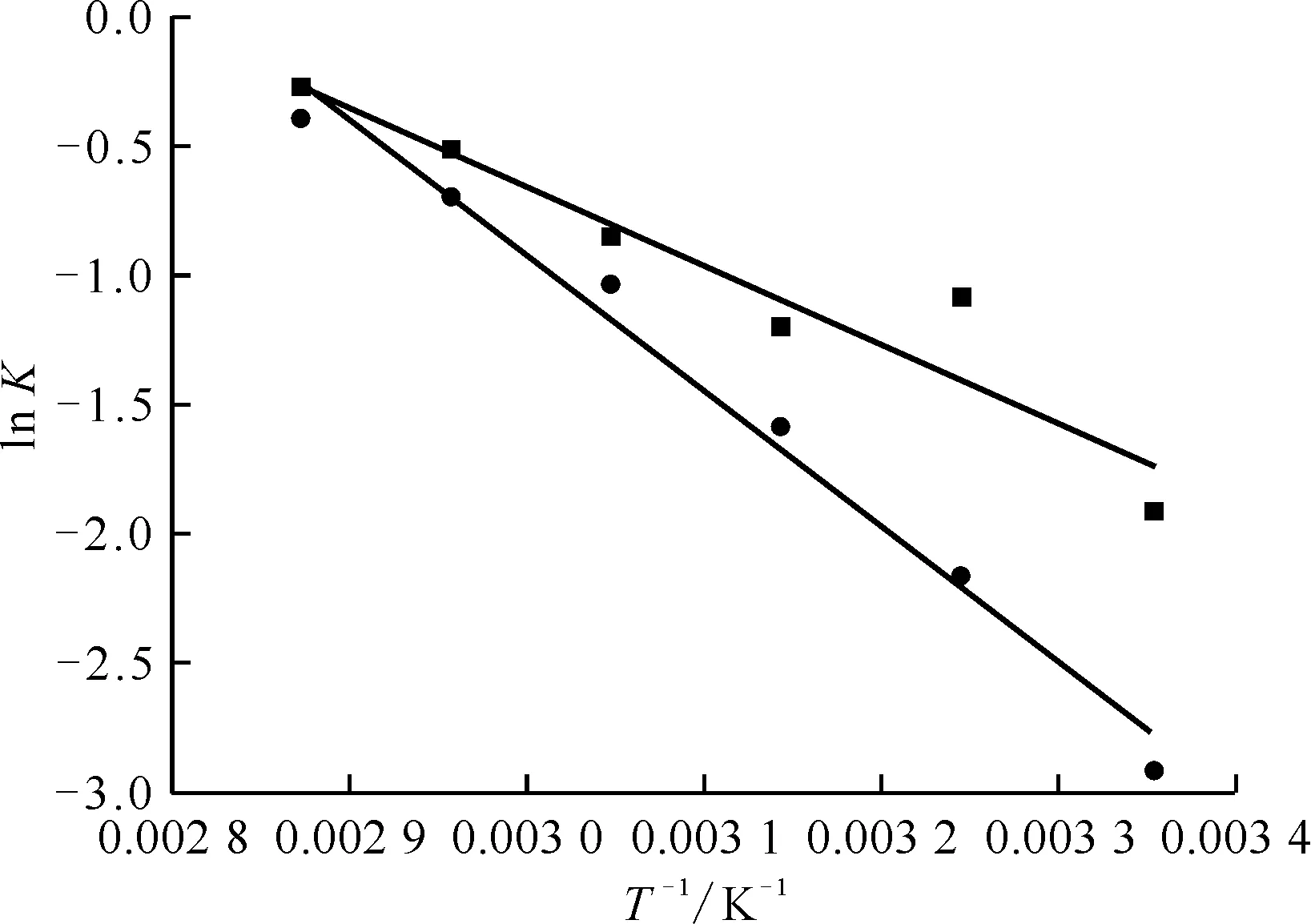
SDB或Y-CeO2/SDB质量为0.5 g■——y=-3.057×103x+8.515,r2=0.889 7;●——y=-5.244×103x+14.81,r2=0.981 7图11 SDB及Y-CeO2/SDB载体对Ni2+吸附的ln K与1/T之间的拟合曲线Fig.11 Fit curves between ln K and 1/T of SDB and Y-CeO2/SDB carriers for Ni2+ adsorption

表7 SDB及Y-CeO2/SDB载体对Ni2+的吸附热力学参数Table 7 Thermodynamic parameters of adsorption for Ni2+ of SDB and Y-CeO2/SDB carriers
3 结 论
(1) Y-CeO2的加入使SDB载体的平均孔径明显减小,其强度和疏水性能有较大提升,并且改善了SDB的耐热性能,初始分解温度从374 ℃提高到392 ℃。
(2) 成功采用Ni2+模拟Pt离子与载体之间的吸附过程,Y-CeO2/SDB载体对Ni2+主要为化学吸附,SDB载体则存在吸附能力相近的化学吸附和物理吸附;两种载体对Ni2+的吸附过程均为吸热过程,升温有助于反应自发进行,且在吸附的动态过程中,体系有序性降低。
