接种生物胺降解菌对鱼露生物胺含量及品质的影响❋
2021-03-02朱翠翠何晓霞王海英汪东风
蓝 翔,朱翠翠,何晓霞,王海英,徐 莹❋❋,汪东风
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003; 2.即墨海关,山东 青岛 266200)
生物胺是一类低分子含氮有机化合物[1],广泛存在于鲐鱼(Scomberjaponicus)、沙丁鱼(Sardinepilchardus)等黑皮红肉海水鱼以及某些发酵食品中,如发酵肉香肠、奶酪、酱油和发酵酒等[2-4]。其中最常见的生物胺有组胺、尸胺、腐胺、酪胺、色胺以及苯乙胺[5]。生物胺作为生物体多种生化反应的有效介质,在维持正常的神经传递、免疫调节、控制细胞生长和造血功能等方面发挥重要作用[6]。但是,摄入过量轻则导致头晕、头痛、高血压、心悸、呼吸系统疾病等症状,重则可能会晕厥甚至死亡[7]。
鱼露又称鱼酱油,是我国沿海地区最常见的发酵鱼类产品之一,以其独特的风味和口感深受消费者喜爱[8-9]。但传统的鱼露加工仍以自然发酵为主,很容易受外源有害微生物污染从而产生大量生物胺[10]。降低鱼露中生物胺含量对于保障消费者健康具有重要的意义。研究表明在食品发酵过程中添加葡萄糖、亚硝酸盐、植物提取物等能减少生物胺的产生,气调、高压处理以及辐射也能减少生物胺的产生[11-12]。但是这些方法会对食品的口感、风味和质构造等成不良影响,而且不能消除已经产生了的生物胺[13]。目前,学者发现并筛选出多株有胺氧化酶活性的酵母菌和乳酸菌,具有降解生物胺能力,但在降解生物胺的种类和效率方面还不甚理想,如BacillusamyloliquefaciensFS05[14]只能降解59.9%组胺、26.4%尸胺和7.6%酪胺,Lactobacilluscasei4a[15]只能降解36.2%组胺和47.9%酪胺。本实验室研究人员从发酵酱油中筛选到两株具有生物胺降解活性的菌株:酵母菌MillerozymafarinoseA3和乳酸菌EnterococcusfaeciumR7具有同时降解组胺、尸胺、酪胺、腐胺、色胺和苯乙胺的能力,且在培养基条件下对上述6种生物胺的降解率均超过60%。本研究将M.farinoseA3、E.faeciumR7及两者复合菌作为发酵剂接种在发酵鱼露中,探究它们对鱼露发酵过程中生物胺含量及鱼露品质的影响,为应用发酵剂控制发酵食品中生物胺含量,提高发酵食品品质提供参考。
1 材料与设备
1.1 材料
试验用传统发酵鱼露样品由山东省威海市某鱼露生产企业提供。试验所用菌株M.farinoseA3和E.faeciumR7由中国海洋大学食品科学与工程学院食品化学与营养研究室分离并保存。
1.2 试剂
组胺、尸胺、腐胺、酪胺、色胺以及苯乙胺标准品、丹磺酰氯,购于美国Sigma公司;色谱级甲醇、乙腈购于德国Merck公司;其余试剂均为分析纯,购于国药集团化学试剂有限公司。
YPD培养基:10 g/L葡萄糖,10 g/L酵母浸粉,20 g/L蛋白胨。
MRS培养基:10 g/L蛋白胨,10 g/L牛肉膏,5 g/L酵母膏,2 g/L柠檬酸氢二铵,20 g/L葡萄糖,1 mL/L吐温80,5 g/L乙酸钠,2 g/L磷酸氢二钾,0.85 g/L硫酸镁,0.25 g/L硫酸锰。
1.3 仪器
1260 Infinity II高效液相色谱仪,美国Agilent公司;CAPCELL PAK C-18 MGⅡ分离柱(5 μm, 4.6 mm I.D.×150 mm),日本Shiseido公司;L-8900氨基酸全自动分析仪,日本Hitachi公司;6890N/5973气相质谱联用仪、HP-5MS非极性毛细管柱(30 m×0.25 mm, 0.25 μm),美国Agilent公司;75 μm CAR/PDMS纤维萃取头,美国Supelco公司;Kjeltec 8400型自动凯氏定氮仪,瑞典FOSS公司;UV-2550型紫外分光光度计,苏州岛津仪器公司;PHSJ-3F型酸度计,上海雷磁仪器公司。
2 方法
2.1 生物胺降解菌的制备
将-80 ℃冰箱中保存的M.farinoseA3和E.faeciumR7分别在YPD和MRS培养基中连续活化2次,在4 ℃、5 000 r/min条件下离心10 min。弃去上清液,将沉淀的细胞团用0.05 mol/L,pH为7.0磷酸二氢钠和磷酸氢二钠缓冲液洗涤2次,然后重悬至菌悬液浓度为107CFU/mL。取等量上述浓度的2种菌悬液混合,制备1∶1复合降胺菌。将3种降胺菌存放于4 ℃冰箱备用。
2.2 添加生物胺降解菌的鱼露发酵过程
将盐含量为19.2%发酵0 d的鱼露分为4组(N=3),每组鱼露质量为500 g。A3组:接种M.farinoseA3;R7组:接种E.faeciumR7;复合组:接种复合降胺菌;对照组(Control):加入等量无菌水。在发酵0 d的时候接种降胺菌,每组接种量按照鱼露质量与发酵剂体积比为5%接种,混合均匀,在30 ℃、60%湿度条件下发酵。在发酵0、5、10、20、40和80 d时取样分析。
2.3 pH、挥发性盐基氮和氨基酸态氮含量的测定
pH测定:取样品(10.0 g)于100 mL煮沸的蒸馏水中,在摇床中200 r/min振荡30 min后,然后2 000 r/min离心10 min得到上清液,用电子pH计测量上清夜pH;挥发性盐基氮(TVB-N)测定参考Sun[16]前处理方法,使用全自动凯氏定氮仪测定,结果表示为mg/100 g;氨基酸态氮(AAN)测定参考GB5009.5-2016中的测定方法,单位为g/100 g。
2.4 微生物生物量测定
用平板计数法[17]测定鱼露的微生物,取10 g鱼露置于90 mL无菌生理盐水中,制成连续10倍稀释液。总需氧微生物:PCA固体培养基37 ℃培养48 h计数; 乳酸菌:MRS固体培养基30 ℃培养48 h计数;肠杆菌:VRBDA培养基37 ℃培养48 h计数。
2.5 风味物质含量的测定
鱼露挥发性风味物质测定参考王悦齐等[18]的方法,并做部分修改:取5.00 g鱼露样品置于25 mL顶空进样瓶中,加入2 μg内标TMP(三甲基吡啶),于50 ℃条件下磁力搅拌10 min,然后将CAR/PDMS纤维萃取头插入样品瓶,吸附30 min,随后将萃取头插入GC/MS进样口250 ℃解析5 min。使用HP-5MS非极性毛细管柱(30 m×0.25 mm, 0.25 μm);GC/MS参数设置:氦气为载气,流速为1.0 mL/min;起始温度40 ℃,以5 ℃/min程序升温至150 ℃,保持1 min后,再以6 ℃/min程序升温至230 ℃,保持5 min;离子源温度为200 ℃;电子能量为70 eV;质量扫描范围为35~350 m/z。挥发性物质绝对含量的分析参照王悦齐等[18]的方法。
2.6 游离氨基酸含量的测定
样品前处理:取鱼露样品0.5 g,加入5 mL 5%的三氯乙酸溶液,用高速组织捣碎机匀浆后,10 000 r/min离心15 min,取上清液于旋蒸仪上浓缩至干,用0.02 mol/L的盐酸定容至10 mL,过0.22 μm滤膜后供上机测定。测定:L-8900氨基酸全自动分析仪进样,柱后茚三酮衍生,254 nm紫外检测,含量表示为mg/100 g。
2.7 生物胺含量的测定
生物胺测定采用高效液相丹磺酰氯柱前衍生紫外检测法测定,CAPCELL PAK C-18 MGⅡ型分离柱(5 μm, 4.6 mm I. D.×150 mm)。样品前处理以及高效液相参数设置参考于金芝等[19]方法,生物胺的单位为mg/kg。
2.8 数据处理与统计分析
每组试验重复3次,分析结果采用平均值±标准差表示,使用SPSS 20.0进行单因素方差分析,置信区间为95%(P<0.05)。使用Origin 9.0软件作图。
3 结果
3.1 生物胺降解菌对鱼露微生物的影响
鱼露发酵过程中微生物的变化如表1所示,随着发酵时间的增加,对照组和试验组中总好氧微生物、乳酸菌和肠杆菌数量均呈现增长趋势,且增长速度随发酵时间的延长而下降。试验组鱼露总好氧微生物数量在发酵0~10 d期间显著高于对照组(P<0.05),但是随着发酵时间延长差异减小。R7组和复合组在发酵0~40 d期间,乳酸菌数量显著高于A3组和对照组(P<0.05),在发酵10~40 d期间,A3组乳酸菌数量显著高于对照组(P<0.05),但是在发酵80 d时,试验组和对照组乳酸菌数量无显著差异(P>0.05)。在发酵0~5 d时,试验组和对照组鱼露肠杆菌数量基本一致,在发酵10 d后,肠杆菌数量排序为:对照组>A3,R7>复合组,在发酵80 d时,复合组鱼露肠杆菌数量相比对照组减少了43.54%。
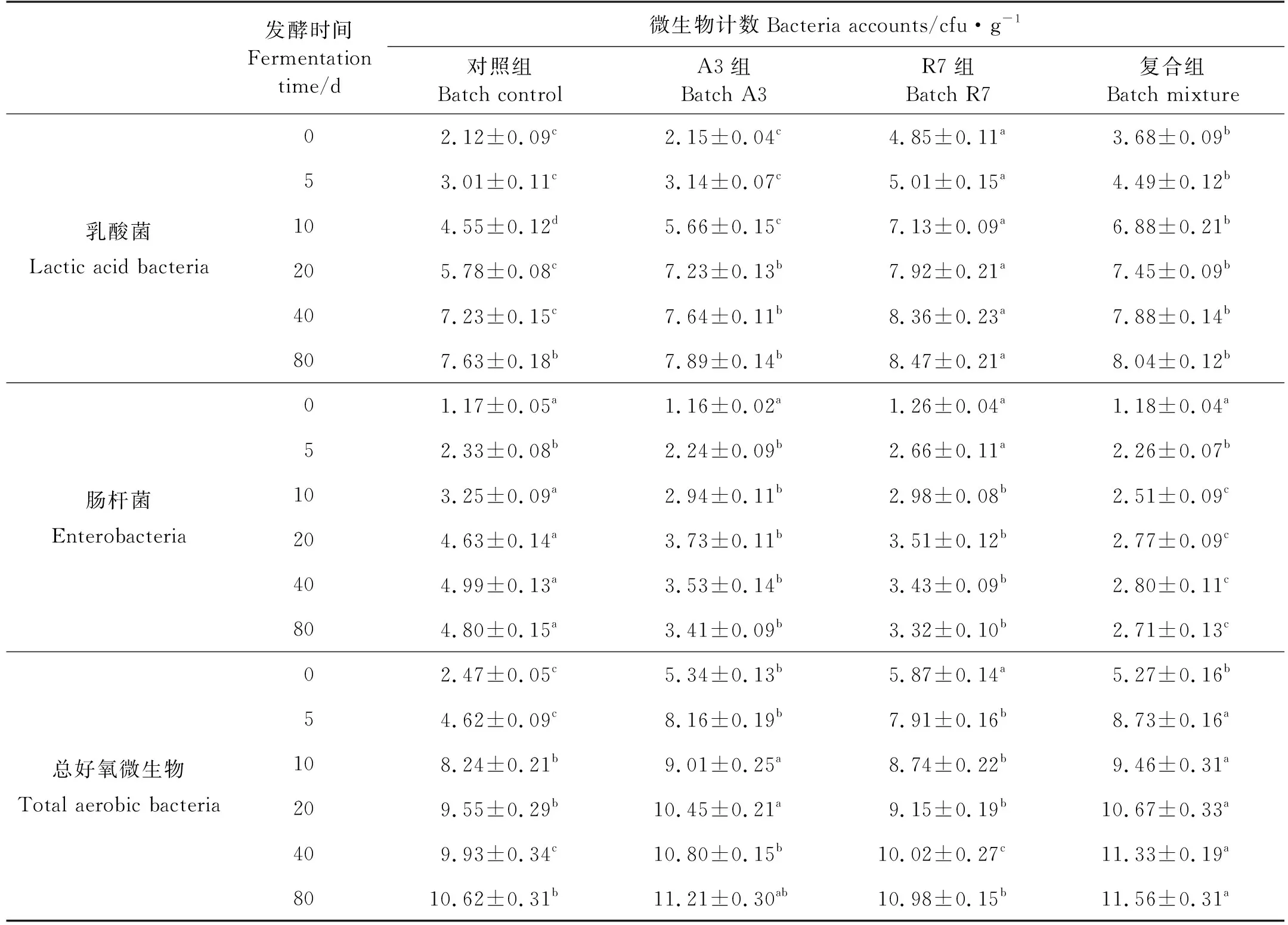
表1 鱼露发酵期间微生物变化
3.2 生物胺降解菌对鱼露pH的影响
鱼露发酵过程中试验组和对照组pH的变化如图1所示。试验组和对照组鱼露pH的变化趋势一致,即先上升随后逐渐下降。在发酵10~80 d期间,无论是接种M.farinoseA3和E.faeciumR7还是复合菌的鱼露,pH都低于对照组。
3.3 生物胺降解菌对鱼露挥发性盐基氮和氨基酸态氮含量的影响
鱼露发酵过程中挥发性盐基氮含量变化如图2(A)所示,从图2中可知鱼露发酵过程中TVB-N含量呈上升趋势,且0~20 d增长迅速,随后增长减缓。在发酵10 d后,试验组鱼露TVB-N含量显著低于对照组(P<0.05)。在发酵80 d时,与对照组相比,A3组TVB-N含量减少25.06%,R7组减少31.35%,复合组减少50.31%。氨基酸态氮含量的变化如图2(B)所示,在发酵前20 d,AAN含量增长较快,之后趋于平缓。在0~5 d,试验组和对照组鱼露AAN含量基本一致;在10~40 d,A3、R7和复合组鱼露AAN含量均显著高于对照组(P<0.05),且A3和复合组高于R7组;在发酵80 d时,试验组鱼露AAN含量高于对照组,但试验组之间无显著差异(P>0.05)。

(对照组代表的鱼露,A3组代表接种M. farinose A3的鱼露,R7组代表接种E. faecium R7的鱼露,复合组代表接种复合降胺菌的鱼露,下图同。 Batch control is fish sauce without starter culture, batch A3 is fish sauce inoculated with M. farinose A3, batch R7 is fish sauce inoculated with E. faecium R7, batch control is fish sauce inoculated with mixture of M. farinose A3 and E. faecium R7, and the following Figures are the same meaning.)
3.4 生物胺降解菌对鱼露生物胺含量的影响
鱼露发酵过程中,试验组和对照组鱼露生物胺含量在0~20 d迅速增加,随后增长减缓;发酵鱼露生物胺含量高低依次为尸胺、酪胺、腐胺、组胺、色胺和苯乙胺(见图3)。从图3(A)可知,试验组鱼露组胺含量显著低于对照组(P<0.05),接种M.farinoseA3和复合菌鱼露组胺在40~80 d期间含量下降,在80 d时,复合组鱼露组胺含量最低,相比对照组下降了54.75%。尸胺和腐胺可以作为食品卫生的指标,而且它们的存在能加强组胺的毒性,它们的含量变化如图3(B)和3(C)。在发酵10~80 d,试验组鱼露尸胺和腐胺含量显著低于对照组(P<0.05),其中A3和R7组鱼露尸胺含量相似,复合鱼露尸胺含量最低(P<0.05)。酪胺、色胺和苯乙胺含量的变化趋势与尸胺腐胺相似(见图3(D)、3(E)和3(F)),在发酵20~80 d时,对照组鱼露酪胺、色胺和苯乙胺含量显著高于试验组(P<0.05)。从图3还可得知,M.farinoseA3对酪胺的抑制与E.faeciumR7相似,对苯乙胺的抑制效果优于E.faeciumR7,对色胺的抑制效果低于E.faeciumR7,复合菌对酪胺、色胺和苯乙胺的抑制效果最好。在发酵80 d 时,M.farinoseA3、E.faeciumR7以及复合菌对总生物胺的抑制率分别为36.25%、33.37%和48.61%。

(同一时间不同字母表示差异显著(P<0.05)。 Different letters in the same time show significant differences (P<0.05).)
3.5 生物胺降解菌对鱼露挥发性风味成分含量的影响
根据王悦齐等[18]的研究,选定11种主体呈味化合物为对象,在发酵80 d时测定含量,结果见表 2。相比于对照组,A3、R7以及复合组三甲胺含量分别下降了1.63、1.45和2.08 ng/g,庚醛含量分别下降了2.41、2.77和3.12 ng/g,可以看出复合菌对三甲胺和庚醛的降低效果更显著(P<0.05);在试验组鱼露中,醛类物质3-甲硫基丙醛、2-甲基丙醛、3-甲基丁醛、己醛和2-辛烯醛的含量都高于对照组,且在复合组中含量最高。但是,对于醇类物质1-辛烯-3-醇和2-甲基-1-丁醇含量,试验组略低于对照组;乙酸乙酯在发酵鱼露中含量:复合组>R7组>A3组>对照组,复合组比对照组含量高71.52%。
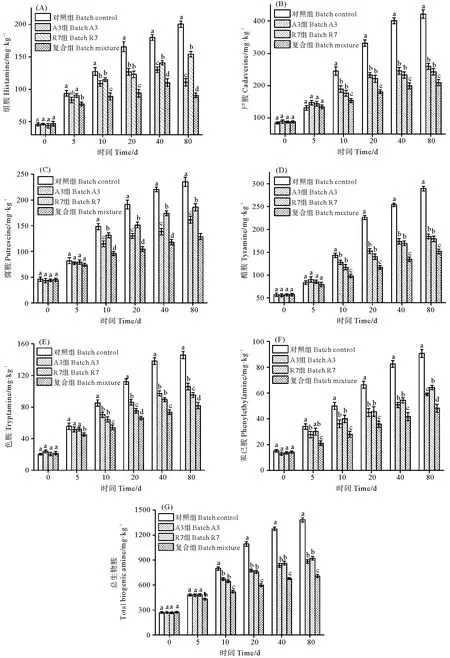
(同一时间不同字母表示差异显著(P<0.05)。 Different letters in the same time show significant differences (P<0.05).)
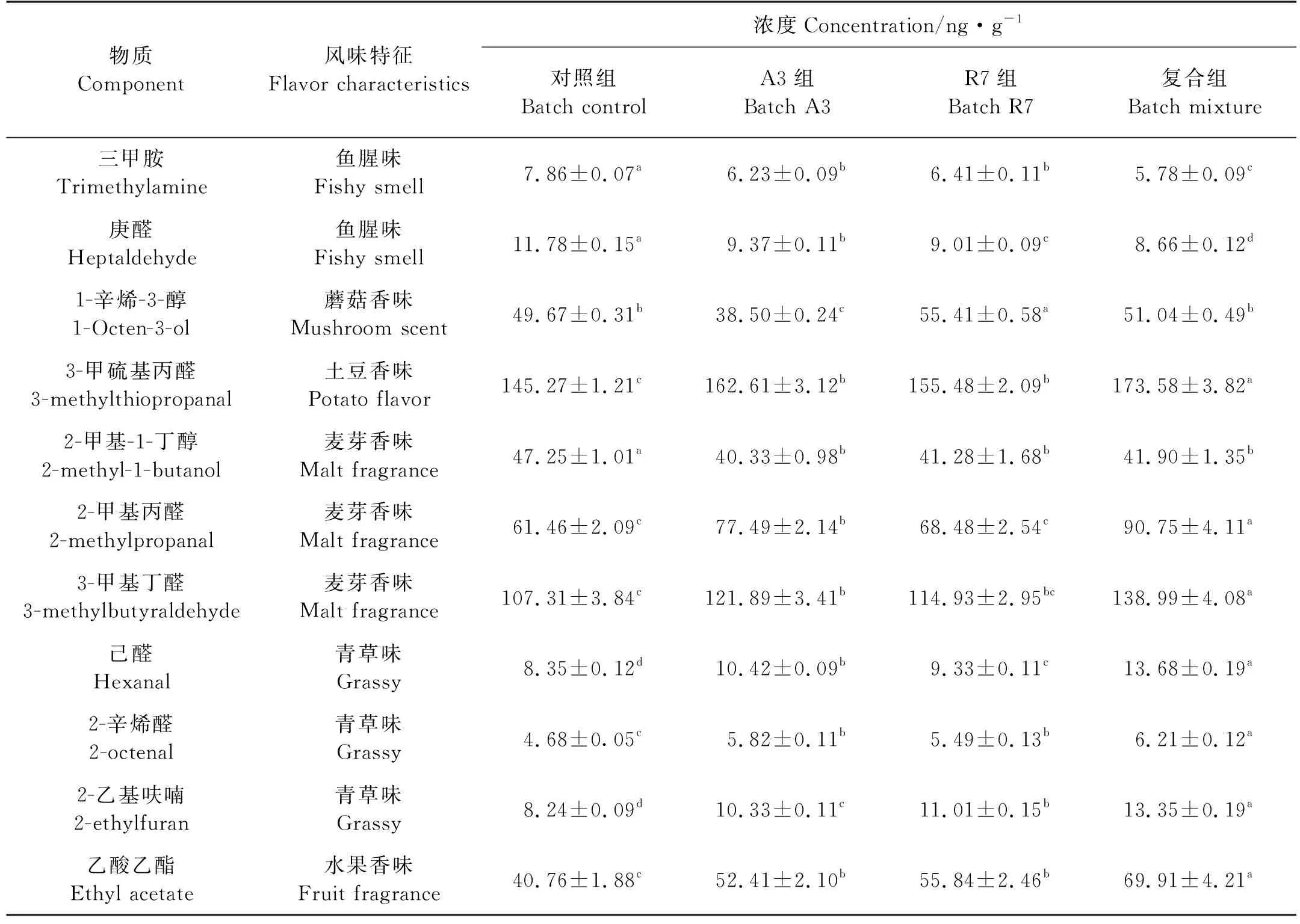
表2 鱼露挥发性风味成分含量
3.6 生物胺降解菌对鱼露游离氨基酸含量的影响
经80 d发酵鱼露游离氨基酸含量如表3所示,从表3可以看出,试验组鱼露中除天门冬氨酸、甘氨酸、丙氨酸以及酪氨酸含量略低于对照组外,其它氨基酸含量均高于对照组。对照组、A3和R7组鱼露的鲜味氨基酸含量接近,复合组鲜味氨基酸含量最高;实验组和对照组鱼露的甜味氨基酸含量接近;试验组鱼露的芳香味氨基酸含量均高于对照组,且复合组芳香味氨基酸含量最高。对照组、A3、R7和复合组鱼露必需氨基酸含量分别为1 037.55、1 159.99、1 224.13和1 332.63 mg/100 g,总氨基酸含量分别为2 446.85、2 556.33、2 649.45和2 872.81 mg/100 g,均呈现复合组>A3,R7>对照组的规律。
4 讨论
乳酸菌在鱼露发酵过程中发挥重要作用,可以产生有机酸、活性肽等物质,与鱼露的风味和品质有密切的关系[20]。肠杆菌数量是衡量鱼露生产过程中卫生程度的重要指标,且肠杆菌具有氨基酸脱羧酶活性,能促进生物胺的产生[20]。发酵初期由于环境营养物质丰富、适宜的pH和温度,所以微生物生长迅速。但随着发酵时间延长,由于微生物代谢产物积累、pH降低等原因,部分微生物的生长会受到抑制。R7组接种的降胺菌为乳酸菌,复合组接种降胺菌也含有乳酸菌,所以在发酵0~10 d期间,R7组和复合组总好氧微生物和乳酸菌数量更多。A3组接种的降胺菌为酵母菌,在发酵10~40 d时,乳酸菌数量明显高于对照组,这可能是因为M.farinoseA3能促进乳酸菌的生长。但是在发酵80 d时,试验组和对照组中总好氧微生物和乳酸菌数量基本一致,这与Zhang等[21]报道的结果相似。接种M.farinoseA3和E.faeciumR7能抑制肠杆菌的生长,且复合降胺菌抑制作用更显著(P<0.05),这一现象可能是因为接种M.farinoseA3和E.faeciumR7促进了乳酸菌的生长,使pH快速下降从而抑制肠杆菌的生长[20]。
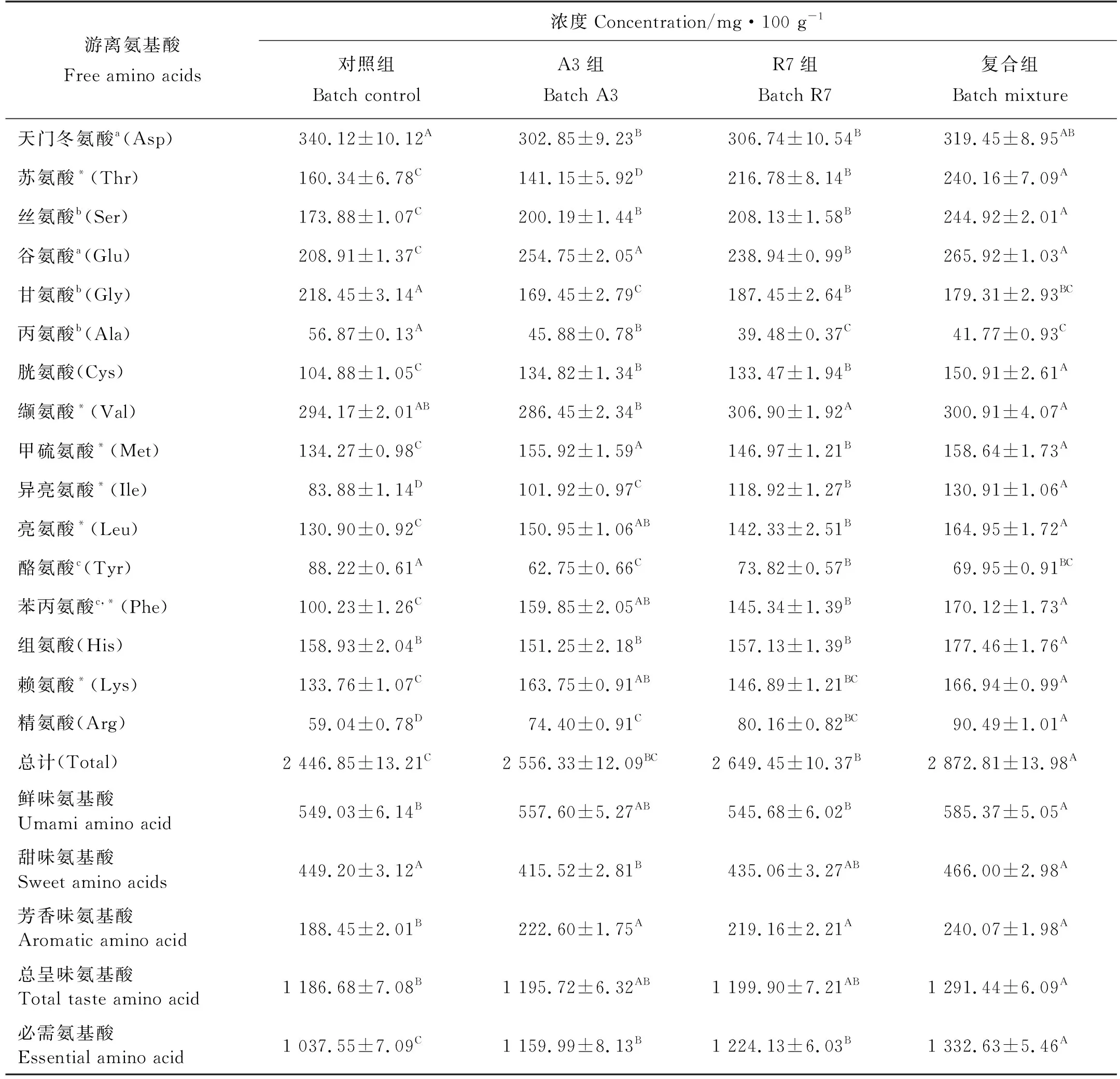
表3 鱼露游离氨基酸含量
在发酵前5 d,鱼露pH升高可能是因为鱼肉蛋白在本身含有的蛋白酶及一些腐败菌分泌的蛋白酶作用下,分解产生大量含氮的碱性化合物[22]。随后乳酸菌和一些产酸菌快速生长,代谢产生的乳酸、柠檬酸等有机酸增多,使pH下降。结合上述微生物数量分析可知,试验组pH下降快于对照组是因为接种E.faeciumR7在鱼露发酵初期就增加了乳酸菌的数量,而M.farinoseA3又能促进乳酸菌的生长,所以试验组乳酸菌生长速度快于对照组,乳酸及其他酸类物质积累更多,导致pH下降更快[20]。
挥发性盐基氮(TVB-N)是衡量水产品腐败变质程度的重要指标[23]。鱼露发酵方式为自然发酵,很容易受腐败微生物污染,鱼肉蛋白质在自身溶解酶和微生物蛋白酶作用下生成氨基酸,进而被腐败微生物利用生成TVB-N,所以TVB-N含量在0~10 d内快速升高[24]。但是随着发酵的进行,乳酸菌数量增多,代谢产生的乳酸一定程度上抑制腐败菌的生长,所以TVB-N含量在发酵20~80 d期间增长速度减缓[4]。试验组TVB-N含量显低于对照组(P<0.05),可能是接种的降胺菌能通过产生乳酸或者细菌素来抑制腐败菌的生长,从而减少TVB-N的生成[4]。本研究还发现复合菌抑制TVB-N产生的效果优于单一降胺菌,说明M.farinoseA3和E.faeciumR7在抑制腐败微生物生长和TVB-N产生方面具有协同作用。氨基酸态氮(AAN)是衡量鱼露品质的重要指标[25],是由微生物内源性酶对蛋白质分解产生的。接种了降胺菌使酵母菌和乳酸菌更快的成为发酵过程中的优势菌,它们快速生长分泌更多的蛋白水解酶,同时能形成一个更低的pH环境,有利于蛋白质的水解,所以试验组鱼露AAN含量更高。蛋白质水解产生的氨基酸在发酵后期会发生复杂的生化反应生成风味物质[26]。因此,接种M.farinoseA3和E.faeciumR7能增加发酵鱼露AAN的含量,进而可能提升鱼露风味。
结合发酵过程中微生物数量、pH和生物胺含量变化,推测试验组生物胺含量低于对照组可能原因在于:发酵过程中,一方面M.farinoseA3和E.faeciumR7能通过竞争性抑制,降低发酵环境pH等方式抑制产胺菌如肠杆菌的生长以和脱羧酶活性,从而减少生物胺的生成,Lee等[27]在研究B.polymyxaD05-1作为咸鱼发酵剂时,发现生物胺含量下降了30.00%,并证明此变化与pH下降有关;另一方面,M.farinoseA3和E.faeciumR7具有胺氧化酶活性,能降解发酵过程中产生的生物胺(我们已有研究,数据暂不提供)。接种M.farinoseA3和E.faeciumR7能抑制6种生物胺的生成,且复合菌的效果更好,表明M.farinoseA3和E.faeciumR7在发酵过程中抑制生物胺的生成方面具有协同效应。
三甲胺和庚醛产生与腐败菌有关,是鱼腥味的主体成分[28]。接种降胺菌能降低鱼露三甲胺和庚醛的含量,可能是因为降胺菌在发酵过程中能抑制腐败菌的生长。醛类化合物是脂质氧化的降解产物,通常具有青草味,麦芽香味等令人愉悦的气味,在试验组鱼露中,3-甲硫基丙醛、2-甲基丙醛、3-甲基丁醛、己醛和2-辛烯醛的含量都高于对照组,品质越好的酱油醛类化合物含量越高[18],由此可见,接种M.farinoseA3和E.faeciumR7可能有利于提升鱼露风味品质,且复合菌效果更好。乙酸乙酯是鱼露中最主要的脂类,具有令人愉悦的水果香味。接种降胺菌能促进乙酸乙酯的合成是因为,降胺菌促进乳酸菌的生长,鱼露酸类物质如乳酸、乙酸、柠檬酸等含量增加,酸类物质和醇类发生酯化反应生成酯类。总的来说,接种M.farinoseA3和E.faeciumR7能通过降低呈鱼腥味化合物的含量和增加令人愉悦化合物的含量来提高鱼露的风味品质,且复合降胺菌的效果更好。
游离氨基酸含量特别是必需氨基酸含量在一定程度上能反应发酵食品的营养价值。试验组游离氨基酸含量高于对照组,可能是接种的降胺菌尤其是复合降胺菌可能具有较高的蛋白酶活性[21]。但试验组鱼露中天门冬氨酸、甘氨酸、丙氨酸以及酪氨酸含量略低于对照组,这可能与接种的降胺菌会利用这些氨基酸进行代谢活动有关[29]。组氨酸、赖氨酸、精氨酸、色氨酸和苯丙氨酸是组胺、尸胺、腐胺、色胺和苯乙胺的前体氨基酸,然而,结合表3和图3发现,在接种发酵剂后的鱼露中,前体氨基酸浓度升高,但对应的生物胺含量并没有升高,这可能是因为相比于前体氨基酸含量,发酵过程中脱羧酶活性是生成生物胺更重要的因素[21]。发酵鱼露的滋味也是评价鱼露质量的标准之一,游离氨基酸中的天门冬氨酸和谷氨酸是鲜味特征氨基酸,酪氨酸和苯丙氨酸是芳香味特征氨基酸,甘氨酸、丙氨酸和丝氨酸是甜味特征氨基酸,食物中呈味氨基酸含量越高,味道就越鲜美。从表3可得知,接种M.farinoseA3或E.faeciumR7可以提高鱼露鲜味和芳香味氨基酸的含量,降低甜味氨基酸含量,但复合菌能促进这三类呈味氨基酸的生成,能提升鱼露的滋味[29]。氨基酸能发生多种化学反应,生成一些风味物质,如通过Strecker反应生成具有杏仁味的苯甲醛、与鱼露中的碳水化合物发生Maillard反应生成吡嗪和呋喃等物质,这可能会对鱼露的整体风味和色泽有一定的影响[29]。
5 结语
将M.farinoseA3和E.faeciumR7作为发酵剂接种在鱼露中,能促进发酵鱼露pH的降低,抑制肠杆菌的生长,减少TVB-N的生成,促进氨基酸态氮的生成,并且在发酵过程中能抑制组胺、尸胺、腐胺、酪胺、色胺以及苯乙胺的生成,提高了鱼露的食用安全性;能有效抑制呈鱼腥味的三甲胺和庚醛的生成,促进乙酸乙酯等令人愉悦的风味物质的产生,提升鱼露的风味;能促进游离氨基酸特别是必需氨基酸的生成,提升鱼露的营养和滋味;且复合菌的作用效果优于单一菌。M.farinoseA3、E.faeciumR7二者的复合菌在发酵食品中具有良好的应用潜力。
