电子射野影像系统在测量调强放疗三维剂量上的应用*
2021-03-02胡银祥王志勇金海洁苏胜发毕婷罗元强金风卢冰
胡银祥,王志勇,金海洁,苏胜发,毕婷,罗元强,金风,卢冰
550004贵阳,贵州医科大学附属医院/贵州省肿瘤医院 肿瘤科(胡银祥、金海洁、苏胜发、毕婷、金风、卢冰);550004贵阳,贵州省肿瘤医院 肿瘤科(王志勇、罗元强)
放射治疗是恶性肿瘤治疗的重要手段之一,随着肿瘤发病率的不断上升,越来越多的患者需要接受放射治疗[1]。由于肿瘤靶区复杂和不规则,远处转移存在多样性,调强放射治疗(intensity modulated radiotherapy,IMRT)已成为肿瘤放射治疗最普遍和最常用的方法之一[2]。IMRT技术依赖于先进的机电技术和计算机模拟技术有机结合[3],放射治疗剂量计算比较复杂,同时在调强放射计划实施过程中存在诸多不确定因素,如输出剂量波动、多叶准直器形状复杂是否运动到位,这些潜在的差错可能导致治疗的失败,因此需要在治疗前或治疗中进行放射治疗的剂量验证[4-5],是放射治疗质量保证(quality assurance,QA)的一个重要环节,确保执行的安全和可靠[6]。非晶硅电子射野影像系统(electronic portal imaging device,EPID)[7]获取放疗患者的治疗射野影像,将影像灰度进行准确的剂量刻度和数学拟合,可以替代传统的电离室检测和三维水箱扫描进行加速器的常规剂量学质量控制[8-12],同时EPID具有在线测量穿透剂量的能力[13]。van Zijitveld等[14]采用EPID进行IMRT治疗前的剂量验证测试,按3%/3mm进行γ分析,发现270例中有4例临床相关的差错,Wu等[15]报道了120例IMRT采用基于EPID采集治疗前射野影像重建患者的调强剂量,所有的IMRT的计划靶区(planning target volume,PTV)和整体γ通过率(3%/3 mm)>90%,表明EPID可以作为IMRT的高分辨率剂量验证工具,检查IMRT技术的相关差错,提供治疗前的剂量验证。治疗计划系统(treatment planning system,TPS)内置剂量算法大多是基于笔形束叠代卷积技术,误差满足临床应用要求[16]。本文使用DosimetryCheck(DC,MathResolutions LLC,Maryland,美国)软件,采用 EPID 进行 IMRT计划出束测量,再采用笔型束计算重建,测试基于固体水模体和 CT 图像三维剂量重建与TPS计算的系统精度,并在临床应用中探讨靶区平均剂量偏差与通过率的相关性,分析空腔对IMRT验证通过率与靶区平均剂量影响。
1 材料与方法
1.1 剂量计算模型建模
医科达Synergy 和Precise加速器iView GT EPID非晶硅探测面积为26 cm×26 cm,像素分辨率1 024 pixel×1 024 pixel(0.254 mm pixel),固定放射源和探测器的距离为160 cm。采用DC软件进行三维剂量建模。首先使用电离室校准加速器6MV_X射线、10 cm×10 cm方野100 MU的绝对剂量,再采用单爆光采集空气中9个方野和4个矩形野影像,完成EPID规则野影像数据与辐射剂量学特性刻度,将影像转换为DICOM格式导入DC软件,同时导入相应射野百分深度剂量、输出因子和离轴比剂量(深度为1.5 cm、5 cm、10 cm和20 cm),最后在DC软件中采用Pencil Beam算法反投影计算拟合三维剂量重建模型。通过固体水模体导入Pinnacle38.0 m(飞利浦治疗TPS)测试野和调强野,测试模型精度。再进行基于 CT病例测试和临床病例应用。
1.2 方法
1.2.1 规则野模体中心点和平面剂量测试 射野为:2 cm×2 cm、3 cm×3 cm、4 cm×4 cm、5 cm×5 cm、8 cm×8 cm、10 cm×10 cm、15 cm×15 cm、20 cm×20 cm、24 cm×24 cm方野和5 cm×2 cm、2 cm×5 cm、10 cm×5 cm、5 cm×10 cm矩形野,分别进行治疗前模式(EPID测量穿过空气的射野)和穿透模式(EPID测量穿过模体的射野)的剂量重建,统计DC软件在重建固体水模体中等中心点剂量与电离室测量结果,比较等中心冠状位平面剂量与MapCheck二维半导体探测器阵列相同深度冠状位平面测量结果,评估三维剂量重建系统绝对剂量偏差精度,采用γ通过率[17](3%/3 mm)分析平面剂量分布符合度,确认系统重建精度。
1.2.2 固体水模体IMRT野中心点和平面剂量重建精度测试 随机选取10例肺癌脑转移瘤临床病例作模型精度测试, 放疗均为全脑 IMRT计划,将 IMRT转换为固体水模体测量例,在TPS导入固体水模体和治疗计划进行剂量计算,在加速器下使用针点电离室测量固体水模体中的等中心点剂量;采用二维平面阵列MapCheck测量0度机架角下相同深度平面剂量;应用EPID在空气中采集各射野出束影像数据,转换导入DC软件,重建固体水模体IMRT剂量,进行空气中(治疗前模式)的剂量重建偏差比对,采用γ分析固体水模体等中心冠状位平面与TPS相应平面剂量分布,类比MapCheck 与TPS 的平面剂量γ通过率,评估确定DC重建软件应用于治疗前IMRT射野平面剂量验证的精度。
1.2.3 IMRT射野基于CT重建三维剂量测试 在DC软件中将上述10例IMRT临床病例基于计划CT进行治疗前模式测量重建,计算DC软件重建的等中心剂量与TPS比较,统计比较等中心横断面、冠状面和矢壮面二维γ通过率及大体肿瘤靶区(gross tumor volume,GTV)和PTV的三维γ通过率。
1.2.4 基于CT重建IMRT临床应用 回顾分析2014~2016年在本院治疗的80例鼻咽癌患者资料,IMRT计划采用6MV_X射线、9野均分360°(其中11例为7野)、子野数70~90个、子野的最小面积为5 cm2,经过EPID在空气中采集IMRT各射野的影像,在DC软件中基于计划CT重建治疗前剂量结果,分别统计PTV1和原发肿瘤靶区(gross tumor volume of nasopharynx,GTVnx)的三维γ通过率(3%/3 mm和5%/3 mm)和平均剂量。
1.2.5 基于CT重建IMRT三维剂量中空腔影响分析 从上述鼻咽癌病例中随机抽取12例,在TPS中勾画鼻咽部空腔,PTV1中间的空腔平均体积为(116.60±40.14) cm3(67.22~200.51 cm3),将空腔密度设置为1 g/cm3,保持各射野参数不变计算剂量,再将射野影像和计划传输至DC软件中,重建治疗前的剂量分布,比较分析3%/3 mm γ通过率变化、PTV1和GTVnx的平均剂量偏差,评价空腔对剂量重建计算的影响。
1.2.6 统计学处理 数据以均数±标准差表示。采用 SPSS 21.0软件进行分析,比较两组差异采用配对t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 规则野的中心点和平面剂量测试结果
在固体水模体中测试20个规则野空气中出束的等中心点剂量,DC软件重建的中心点剂量与电离室测量的偏差在-1.35%~1.96%之间,平均偏差为0.34%±0.81%,TPS中计算的等中心剂量和电离室测量平均偏差为-0.23%±0.50%,DC软件重建与电离室测量及TPS计算偏差<1%;在加速器下移入固体水模体采用EPID单野穿透测量,穿透重建剂量与电离室测量平均偏差3.91%±0.74%,最大偏差5.80%,穿透偏差偏大。对于相同等中心处的平面剂量分布,在DC软件重建空气中测量规则方野的冠状位平面γ (3%/3 mm)通过率为99.38%,与相同深度半导体阵列测量的平面结果相同,固体水模体PTV三维γ通过率为98.01%。
2.2 IMRT病例固体水模体中心点和平面剂量测试结果
DC软件重建10例IMRT基于固体水模体治疗前剂量,计划测量重建示意图见图1,等中心剂量比电离室测量平均偏差低1.09%±1.27%(-2.70%~1.04%),DC软件重建穿透剂量比电离室测量平均高1.48%±1.28%(0.12%~4.50%),见图2。在固体水模体中相同深度平面,MapCheck 、DC软件治疗前和穿透模式的3%/3 mm的γ通过率分别是99.30%±0.52%、98.89%±1.31%和98.02%±2.32%, 治疗前模式固体水模体中PTV通过率98.01%±0.41%高于GTV的91.71%±11.41%,PTV治疗前模式通过率高于穿透模式。重建值与电离室测量值的偏差见表1。
2.3 基于CT重建IMRT病例三维剂量初步测试结果
10例IMRT测试例基于计划CT治疗前模式重建结果,TPS计算的等中心剂量比DC治疗前测量重建剂量平均高1.91%±0.99%(0.09%~3.21%),90%的测试例误差<3%,1例等中心剂量误差为3.21%;等中心测量重建剂量与固体水模中的重建剂量的误差相一致。等中心横断面、冠状面和矢状面γ平均通过率(3%/3 mm)分别为91.57%±3.11%,96.47%±0.96%, 97.45%±0.86%;GTV和PTV的三维γ平均通过率(3%/3 mm)为90.11%±13.58%,97.51%±0.92%,与模体重建的三维γ分布一致。

图1 固体水模体计算与重建示意图
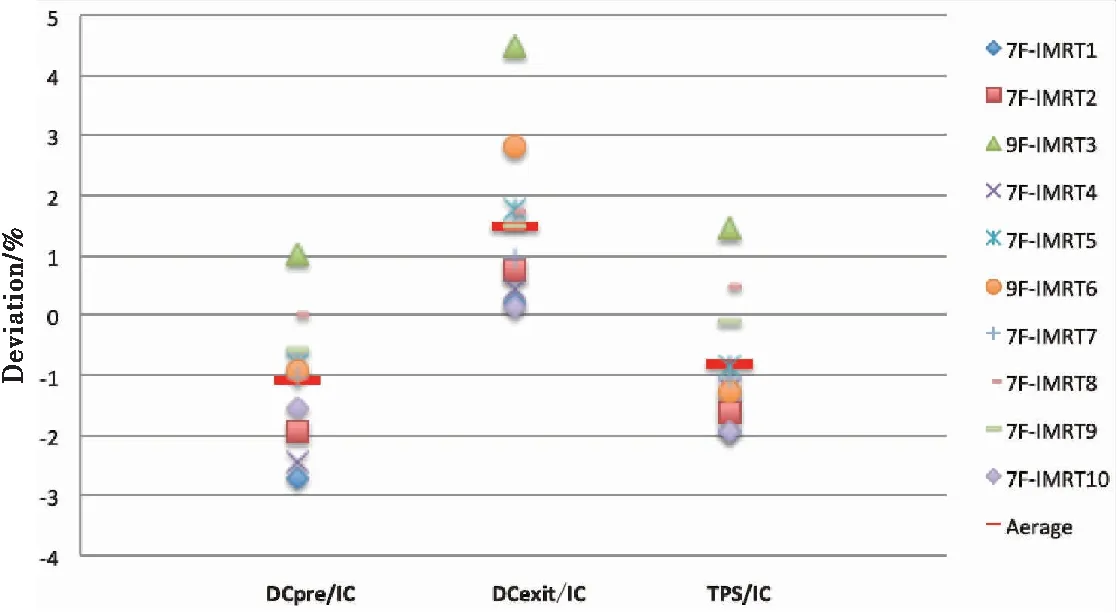
图2 固体水模中 IMRT的DC测量重建点剂量与电离室测量结果比较
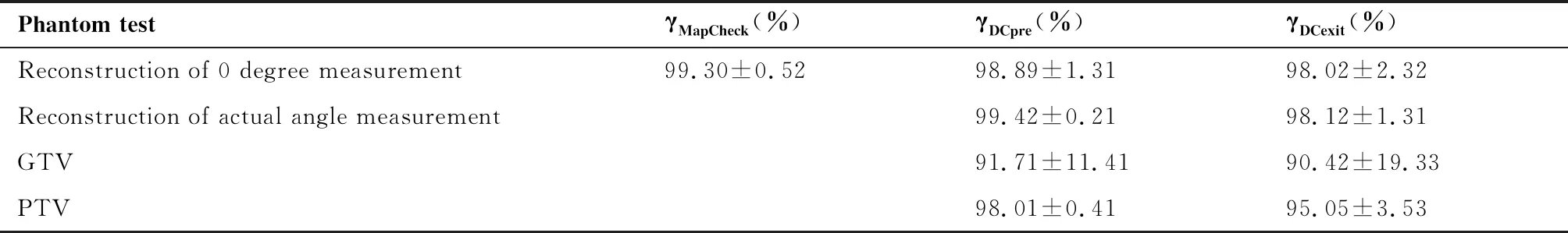
表1 10例固体水模体中IMRT平均二维γ通过率(3%/3mm)
2.4 基于CT重建IMRT三维剂量临床应用结果
基于计划,CT重建80例头颈部鼻咽癌IMRT三维剂量(图3),PTV1的γ通过率(3%/3 mm)平均为89.71%±5.71%,其中有23例小于89.00%;最小71.19%;GTVnx的三维γ通过率(3%/3 mm)平均为91.57%±8.74%,21例小于89.00%,最小值仅为44.00%。而按5%/3 mm的校准,PTV1和GTVnx的γ通过率平均分别96.36%±3.02%和99.14%±2.03%,小于89.00%分别只有2例和1例,最小值分别为85.21%和88.75%。结果见表2和图4。DC重建PTV1与 GTVnx的平均剂量与TPS的偏差分别为0.38%±1.26%和-0.18%±1.77%,PTV1和GTVnx重建的平均剂量偏差大于3%各有2例(占2.50%)和6例(占7.50%),见图5。危及器官的重建的平均剂量偏差和靶区相同,三维γ通过率相对靶区更高。
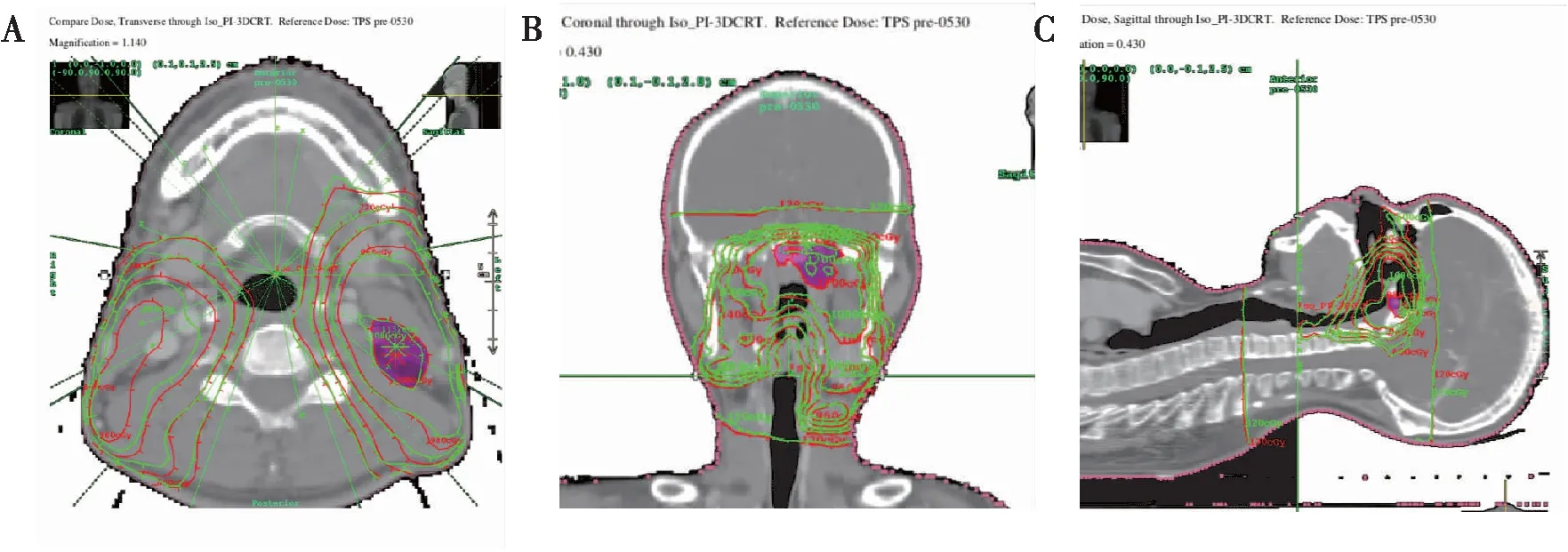
图3 基于CT重建三维剂量与TPS计算分布
表2 DC治疗前重建80例 NPC IMRT验证γ通过率
2.5 基于CT重建IMRT三维剂量中影响结果
12例患者PTV1和GTVnx的γ平均通过率(3%/3 mm)分别是96.80%±2.15%和97.90%±3.41%,高于空腔密度未修改的通过率91.20%±3.53%和87.70%±8.07%(图6)。空腔密度修改设置前后PTV1和GTVnx两组通过率配对t检验差异存在统计学意义(t=-7.214,P<0.001;t=-4.263,P=0.001)。空腔密度修正前后DC重建PTV1和GTVnx的平均剂量偏差分别是0.70%±1.30%和0.60%±2.05%,配对t检验差异无统计学意义(t=-1.910,P=0.083;t=1.083,P=0.302)。
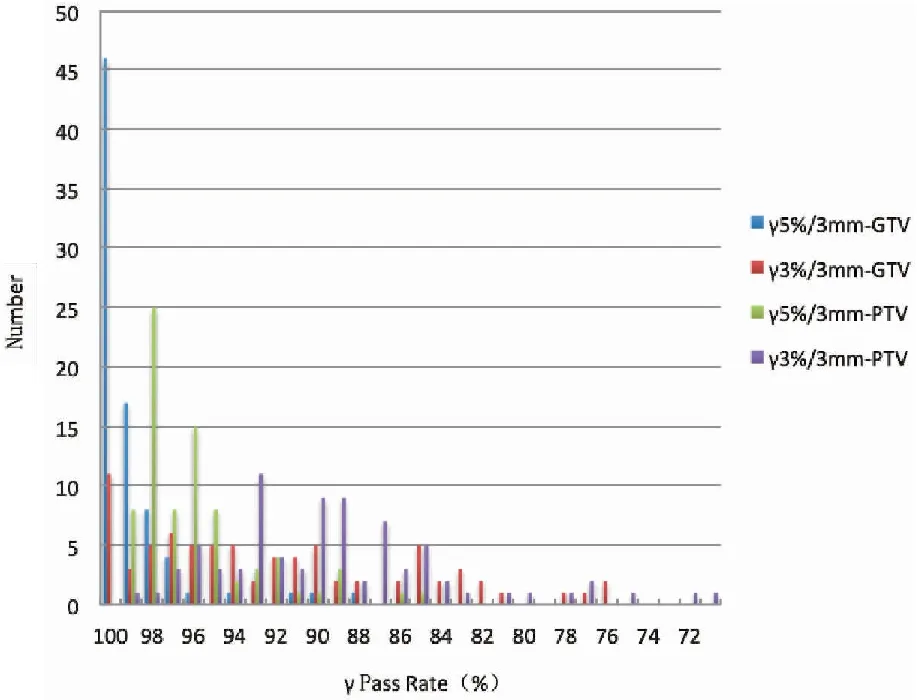
图4 80例靶区的通过率分布
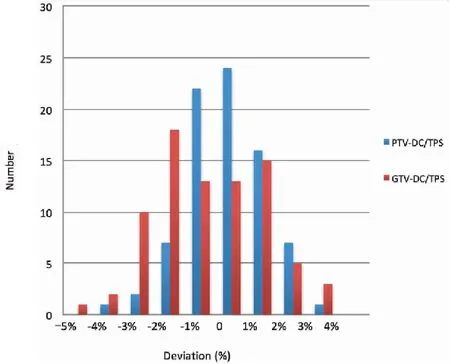
图5 DC重建鼻咽癌PTV1与GTVnx平均剂量偏差
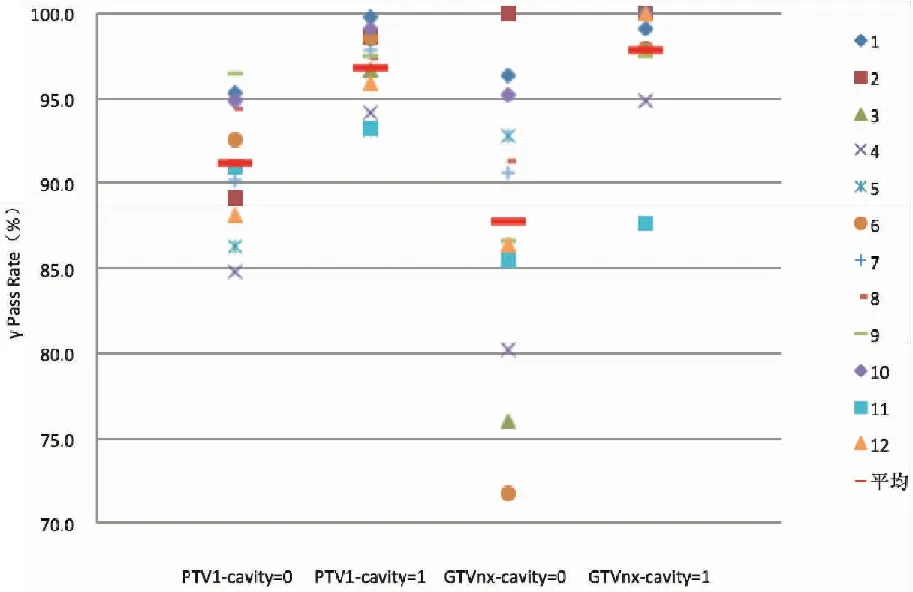
图6 12例NPC空腔密度设置与不设置的γ通过率
3 讨 论
三维剂量重建是基于CT和 EPID 测量射野的一种独立射线束测量计算模型[10-12],经过EPID校准后反投影计算。Zhang等[18]基于电离室和EPID测量固体水模体中的IMRT等中心的剂量偏差<2%,EPID剂量测量质控程序能够达到临床IMRT质控目标。在固体水模体中重建空气规则野、调强野的中心点剂量结果与指形电离室的测量结果偏差较小,重建等中心冠状位平面剂量通过率与二维平面测量通过率相同;TPS计算与电离室测量结果偏差也相同,由此可以看出DC软件的空气中三维剂量重建模型与TPS 模型偏差小,穿透模体测量射野重建三维剂量精度低于空气中测量重建。EPID在空气中测量重建三维剂量可以作为临床计划验证使用,这种治疗前三维重建剂量精度与其他三维验证设备测量结果相同[19-21],具有较高的精度和可靠性,同时增加了基于 CT 的三维剂量分布和剂量统计,具有患者解剖结构的放射治疗执行剂量的信息,是一种IMRT放射治疗剂量验证更值得推荐的工具。
AAPM TG-119号报告[22]基于众多机构IMRT质量保证调查,建议二维γ分析3%/3 mm质量保证标准,即每个野的全局通过率达到90%及合成野的通过率为88%~90%。本研究在固体水模体重建的冠状位平面及合成平面剂量的二维γ通过率符合这个质控标准,并从结果中发现,基于计划CT重建的PTV和GTVnx的三维γ通过率(3%/3 mm)平均值比固体水模体重建低,采用5%/3 mm分析通过率与固体水模体3%/3 mm接近,特别是小体积的靶区GTV通过率上升最为明显。当空腔密度进行修正后再计算与重建,重建的剂量基本保持不变,3%/3 mm 三维γ通过率提升到与固体水模体一致。在上述鼻咽癌病例中的空腔均位于GTVnx边缘附近,空腔对边缘点重建剂量影响较大从而降低靶区通过率,当设置修改空腔密度后,重建与重计算的靶区平均剂量变化相对较小,GTVnx小靶区随着体积变小三维γ通过率提高越明显,PTV1大靶区变化相对较小,增加靶区剂量比较分析对剂量验证质控分析有价值。Wu[15]认为三维γ PTV分析提供了一种简单方法去评估患者的IMRT质控结果,不建议排除其他重要结构简单报道三维γ结果,事实上,许多医生和物理师都认为除了γ分析还需要审查更多的QA结果。三维γ分析存在局限性,Zhen等[23]认为三维γ通过率与患者的剂量体积直方图(dose-volume histogram,DVH)错误存在弱相关性,三维γ通过率不能够提供治疗失败的剂量水平及具体的解剖位置信息。有报道使用DC软件作为特定患者的质量保证手段[24-25],介绍了笔型束算法快速得到的剂量分布和DVH结果,为临床患者的QA提供了更多三维解剖剂量分布信息。EPID三维剂量重建测量提供了治疗前计划执行的常规QA结果,增加靶区剂量。文中发现三维γ通过率对于大靶区结果稳定,而小体积可能存在一定不稳定因素,可以采用空腔密度修正消除对重建计算γ分析的影响。在使用三维剂量重建系统时需要根据系统的特点,修正低密度的影响,提高精度。
目前广泛使用的二维和三维模体剂量验证,基于EPID和 CT 三维剂量重建是一种值得推荐的更高级的剂量验证方法,增加了靶区及危及器官的剂量信息,进一步分析危及器官的剂量学信息与临床疗效相关性,更具有临床应用价值。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任; 并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网( CNKI) 科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
