低氧/低氧诱导因子-1α通过TGF-β1诱导人肝内胆管上皮细胞上皮间质转化
2021-03-02杨再兴梁艳刘东红张振成罗婉婉毛盼璎
杨再兴,梁艳,刘东红,张振成,罗婉婉,毛盼璎
1.台州市第一人民医院 检验科,浙江 台州 318020;2.上海长征医院 实验诊断科,上海 200003
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是一种以肝内胆管上皮细胞(intrahepatic biliary epithelial,IBEC)炎症性损伤为主要表现的慢性自身免疫性胆汁淤积性肝病,最终会缓慢进展为肝硬化、肝癌。PBC病因不 清,早期症状隐匿,患者出现症状至医院就诊时往往已出现明显肝纤维化甚至肝硬化,但PBC由炎症向纤维化发展的机制至今尚未完全阐明。本实验室和其他国内外研究均发现,PBC患者的IBEC存在上皮间质转化(epithelial-mesenchymal transition, EMT)现象,这种转化可能是PBC由炎症向纤维化过渡的一个重要机制[1-3]。
低氧是公认的各种肝纤维化疾病肝组织中广泛存在的现象,在PBC患者肝组织门管区也存在低氧情况[4],但低氧是否与IBEC发生EMT有关,国内外尚未见相关研究报道。因此,本研究拟深入探讨低氧是否可以诱导人IBEC(human IBEC,HIBEC)发生EMT,并阐释其可能分子机制。
1 材料和方法
1.1 细胞及主要试剂、耗材 HIBEC购自北京北纳创联生物技术研究院;1640培养基、胎牛血清和胰蛋白酶购自美国Gibco公司;10 cm细胞培养皿和6孔细胞培养板购自美国Fisher Scientific公司;TGF-β1 ELISA检测试剂盒购自武汉优尔生公司;高纯总RNA快速提取试剂盒购自上海捷瑞生物工程有限公司;反转录试剂盒HiScript-II Q RT SuperMix、 ChamQ SYBR Color qPCR Master Mix和Exfect®2000 转染试剂购自南京诺唯赞生物科技公司;CFX connect Real-Time PCR System定量PCR仪及其配套使用分析软件为美国Bio-Rad公司产品;polycarbonate membranes chambers为美国Corning公司产品;TGF-β1抑制剂(LY364947)购自美国Selleck公司;E-钙黏蛋白(E-cadherin)、低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、S100A4抗体购自美国Abcam公司;GAPDH抗体、羊抗兔和羊抗鼠二抗购自杭州联科生物技术公司;PVDF膜为美国Millipore 公司产品;Tris和甘氨酸购自美国Amresco公司;过硫酸铵(ammonium persulfate,AP)和四甲基乙二胺(N,N,N’,N’-Tetramethylethylenediamine,TEMED)购自美国Sigma公司;ECL Plus发光试剂盒、SDS-PAGE蛋白上样缓冲液(5×)、免疫印迹用细胞裂解液、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、BCA蛋白浓度测定试剂盒均购自上海碧云天生物技术有限公司。
1.2 主要仪器 3111型CO2培养箱为美国Thermo公司产品;倒置显微镜购自日本Olympus公司;台式高速冷冻离心机为湖南湘仪实验仪器开发有限公司产品;台式低速离心机为湖南凯达实业发展有限公司产品;Mini-Proten Tetra System电泳系统和ChemiDoc XRS+System凝胶成像仪购自美国Bio-Rad公司;Merinton SMA4000高精度分光光度计购自北京美林恒通科技有限公司;微量加样器购自德国Eppendorf公司;SpectraMax Plus 384型全波长酶标仪为美国MD公司产品。
1.3 HIF-1α siRNA设计合成 共设计合成3条HIF-1α siRNA,由广州锐博生物科技有限公司完成,靶序列分别为,1#:CATGAGGAAATGAGAGAAA;2#:GATGG AAGCACTAGACAAA;3#:CCTCAGTGTGGGTATAAGA。1.4 方法 HIBEC细胞培养在含10% FBS的RPMI- 1640培养基中,37 ℃、5% CO2、饱和湿度培养, 0.25%胰蛋白酶消化传代。取对数生长期的细胞,以每孔2×105的浓度,接种6孔板,培养过夜待细胞贴壁后,并列进行后续实验。
1.4.1 PCR实验:利用Exfect®2000 转染试剂转染HIF-1α siRNA,以转染空载体作为阴性对照(NC),24 h后,提取总RNA,行定量PCR实验。
1.4.2 细胞分组:常氧组,常氧培养72 h;低氧组,常氧培养48 h后,低氧培养24 h;NC组,转染空载体后常氧72 h;NC+低氧组,转染空载体后常氧48 h,低氧培养24 h;siRNA组:转染HIF-1α siRNA后常氧培养72 h;siRNA+低氧组,转染HIF-1α siRNA后常氧培养48 h后,低氧培养24 h;低氧+LY364947组,常氧培养48 h后,加入终浓度5 μg/mL的LY364947并低氧培养24 h。上述的低氧是指氧浓度1%。
1.4.3 划痕实验:以最后24 h的开始记为0 h,划痕后立即40倍拍照,继续培养至24 h,再次40倍拍照,测量计算各组细胞愈合率来反映细胞迁移情况,计算方法如下:细胞迁移率=(1-24 h后刮痕面积/0 h刮痕面积)×100%。
1.4.4 侵袭实验:待转染48 h收集各组细胞,用含2% FBS的RPMI1640培养基重悬,以5×104的密度接种24孔板Transwell小室的上室,下室加入500 μL 的含10% FBS的RPMI 1640培养基,再分别进行常氧或低氧培养24 h,经4%多聚甲醛室温固定后,棉签擦去小室膜上层细胞,经结晶紫染色,200倍拍照,记数穿膜细胞数。
1.4.5 TGF-β1含量检测:分别收集各组细胞和培养基上清液,参照试剂盒说明书进行ELSIA法检测。1.4.6 HIF-1α、E-cadherin、S100A4蛋白及HIF-1α mRNA检测:分别收集相应组别细胞,提取总蛋白,免疫印迹检测HIF-1α、E-cadherin、S100A4蛋白表达;提取RNA,反转录后进行定量PCR,反应条件为95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,重复40 个循环,熔解曲线70~95 ℃;2-ΔΔCt分析HIF-1α基因的mRNA变化。引物信息见表1。

表1 HIF-1α和β-actin的引物信息
1.5 统计学处理方法 所有数据采用SPSS13.0进行统计。计量资料以±s表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 HIF-1α siRNA的干扰效果 实验结果显示3条HIF-1α的siRNA对HIF-1α的mRNA和蛋白的表达水平均有明显抑制作用,且3#效果最优,故后续实验均采用3#进行HIF-1α基因沉默。见图1。
2.2 低氧通过HIF-1α诱导HIBEC发生EMT 为排除转染本身对结果的可能干扰,本实验中所有未转染HIF-1α siRNA的研究组均转染了空载体作为NC。结果显示,1%氧浓度的低氧培养24 h后,HIF-1α表达明显升高,HIF-1α siRNA可以明显抑制HIF-1α的表达;低氧可以诱导E-cadherin表达明显降低,S100A4 明显升高,应用siRNA抑制HIF-1α后,则有明显逆转(见图2)。划痕实验显示,低氧培养后,HIBEC迁移率明显增加,加入HIF-1α siRNA后,HIBEC迁移率明显下降(P<0.05,见图3、表2)。Transwell检测结果显示,低氧培养后,侵入小室底膜的细胞数明显高于常氧培养,加入HIF-1α siRNA后,侵入细胞数明显减少(P<0.05,见图4、表2)。
2.3 低氧通过HIF-1α上调HIBEC对TGF-β1的表达和分泌 与常氧培养相比,低氧培养HIBEC细胞内和培养基上清液中的TGF-β1 水平均明显增加,用siRNA抑制HIF-1α后,HIBEC细胞内和培养基上清液中TGF-β1水平均明显下降(P<0.05,见表3)。

图1 3条siRNA对HIF-1α mRNA和蛋白表达水平的抑制效果

图2 干扰HIF-1α对低氧诱导EMT相关指标变化的影响
2.4 低氧/HIF-1α对HIBEC EMT的诱导作用部分依赖于TGF-β1 应用TGF-β1抑制剂LY364947,可以明显抑制低氧/HIF-1α对HIBEC的以下作用:上调Ecadherin、下调S100A4蛋白表达,提高HIBEC迁移和侵袭能力(P<0.05,见图5-7、表4),但抑制TGF-β1对低氧诱导的HIF-1α表达增加没有明显影响。
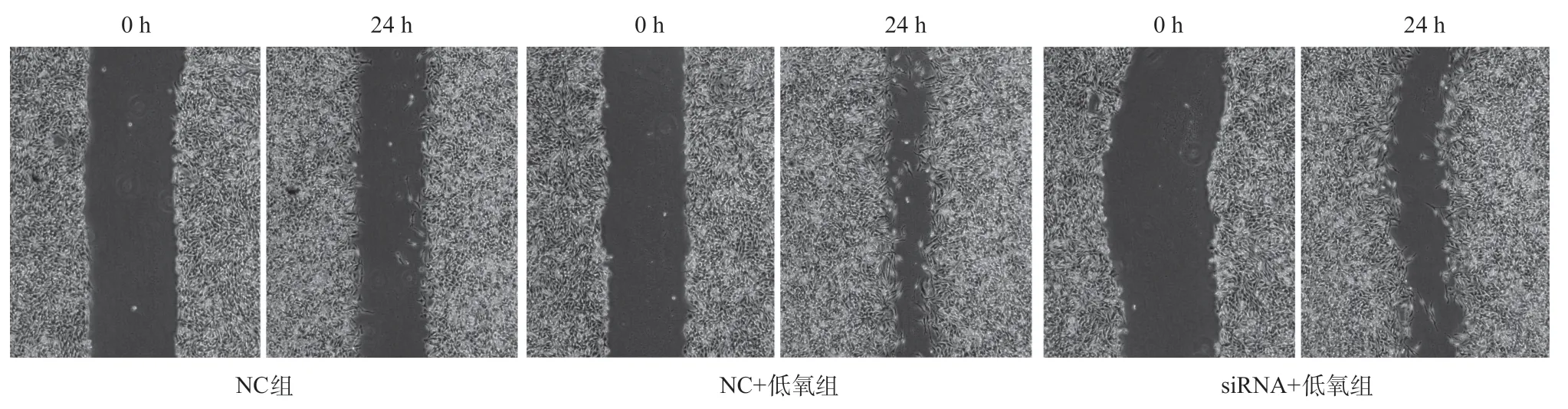
图3 干扰HIF-1α对低氧诱导HIBEC迁移率变化的影响(×40)
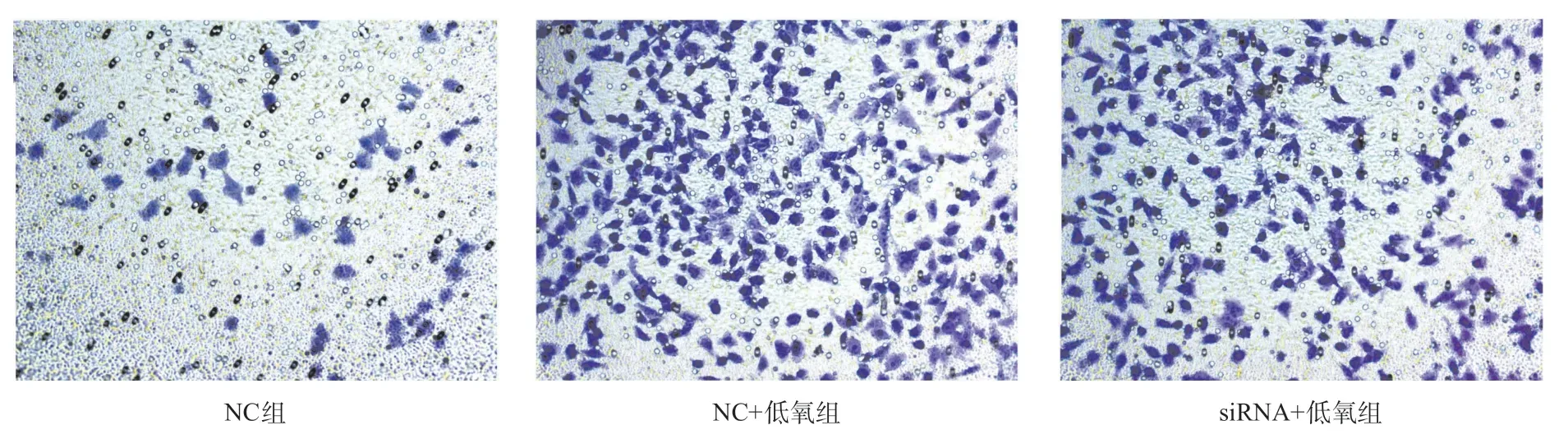
图4 干扰HIF-1α对低氧诱导HIBEC侵袭性变化的影响(结晶紫染色,×200)

表2 干扰HIF-1α对低氧诱导HIBEC迁移和侵袭的影响(每组n=3)
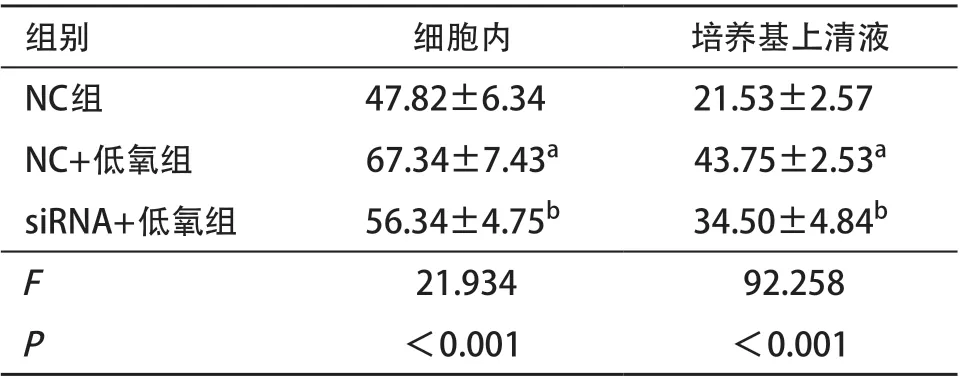
表3 干扰HIF-1α对低氧诱导HIBEC表达和分泌TGF-β1水平的影响(每组n=3,pg/mL)

图5 抑制TGF-β1对低氧诱导EMT相关标志物表达的影响
3 讨论
EMT是上皮细胞表型和生物学特性发生变化,向间质细胞转化的一种现象,上皮细胞具有紧密连接、极性、不能移动等性质,其主要标志物是Ecadherin蛋白;而间质细胞则失去紧密连接,无极性,可移动,增殖力、迁移力和侵袭性均显著增强,其主要标志物是S100A4(也称为成纤维细胞特异蛋白1)等[5-7]。EMT现象最初是在胚胎中发现的,是胚胎发育中的重要调节因素,但后来研究表明,EMT也广泛存在于肿瘤的生长或转移以及纤维化疾病的形成过程中[8-10]。近来国内外研究发现,PBC的IBEC亦会发生EMT,这一过程对于PBC门管区纤维化可能具有重要意义[1-3],但具体机制尚未明确。
本研究发现,低氧可以通过HIF-1α诱导HIBEC发 生EMT样变化,包括E-cadrherin下调、S100A4上调、细胞迁移性和侵袭性增加。低氧是PBC发生纤维化过程中门管区广泛存在的现象,据推测,低氧与PBC门管区新生血管增加以适应纤维化有关[4,11-12], 但低氧对PBC的损伤靶点IBEC的作用情况,国内外尚罕有研究。本研究阐释了低氧对IBEC发生EMT的诱导作用,从而也为低氧与PBC肝纤维化的关系提供了一个新的线索。
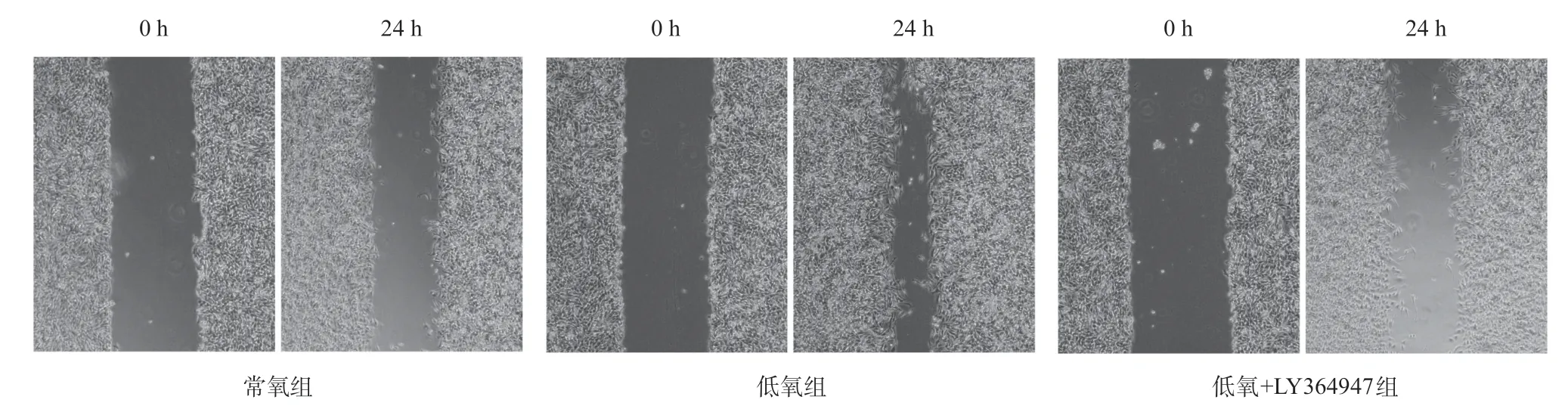
图6 抑制TGF-β1对低氧诱导HIBEC迁移的影响(×40)
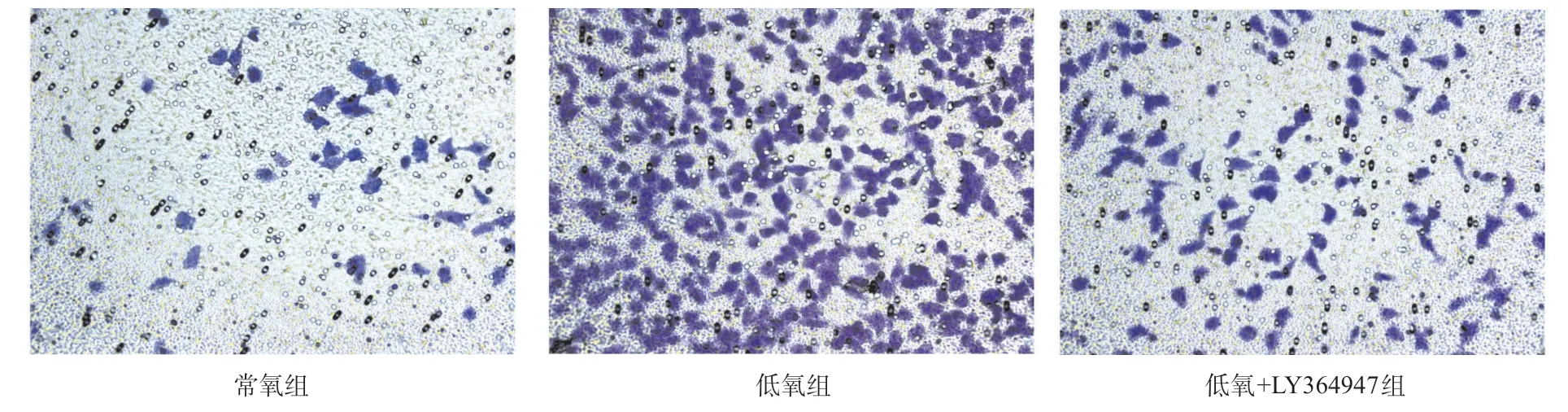
图7 抑制TGF-β1对低氧诱导HIBEC侵袭的影响(结晶紫染色,×200)

表4 抑制TGF-β1对低氧诱导HIBEC迁移性和侵袭性的影响(每组n=3)
TGF-β1 是与肝纤维化关系非常密切的一种重要细胞因子,参与了各种因素引起的肝纤维化、肝硬化过程[13-15]。ZHAO等[16]发现,脂多糖可以诱导IBEC发生EMT,TGF-β1在其中扮演了重要角色。本研究表明,在低氧诱导IBEC发生EMT的过程中,TGF-β1同样具有重要作用—低氧通过HIF-1α诱导HIBEC表达和分泌TGF-β1,而抑制TGF-β1明显阻止或逆转IBEC发生EMT,且不影响低氧对HIF-1α的活化。综上所述,本研究发现低氧可以通过HIF-1α诱导IBEC发生EMT,而这一作用主要是通过诱导IBEC分泌TGF-β1实现的。
