编码大鼠ENPP1蛋白的cDNA克隆及重组腺相关病毒构建
2021-03-02狄枫吴秀娟沈水娟郭波尧
狄枫,吴秀娟,沈水娟,郭波尧
绍兴市人民医院,浙江 绍兴 312000,1.呼吸科;2.肾内科
血管钙化是动脉粥样硬化、糖尿病血管病变、慢性肾脏病(chronic kidney dielace,CKD)等多种疾病的共同病理生理过程。在肾小球滤过率降低的CKD患者中,血管钙化发生率可达89%[1]。CKD患者的血管钙化并不是简单的钙磷被动沉积过程,而是血管平滑肌细胞(vascular smooth muscle cells,VSMC)在CKD环境中经历凋亡和囊泡形成,并向成骨样细胞表型转换,进而诱导钙化蛋白表达,基质形成并吸收钙磷沉积的主动过程[2]。在这一过程中,血管钙化是钙化促进因素和抑制因素不平衡的结果。我们的前期研究发现,维生素D3 联合尼古丁(vitamin D3 and nicotine,VDN)血管钙化模型的大鼠在停止药物干预后,血管钙化可发生自行消退,在这一过程中,外核苷酸焦磷酸酶/磷酸二酯酶1(ectonucleotide pyrophosphatase/phosphodiesterase 1,ENPP1)基因高表达[3]。为此,本研究通过采用克隆编码ENPP1蛋白cDNA并构建其重组腺相关病毒(adeno-associated virus vector,AVV),以便为后续研究其在血管钙化抑制中的作用及基因治疗提供技术条件。
1 材料和方法
1.1 试剂和仪器 主要试剂:DH5α感受态细胞(Takara,日本);高纯度质粒小量中提试剂盒(北京天根生化有限公司);DNA引物合成(上海捷瑞公司);Qiagen大规模质粒抽提试剂盒(Qiagen,德 国);DNA内切酶和T4 DNA连接酶(DNA marker,上海赛默飞);DNA凝胶回收试剂盒(Omega,美国);PCR产物纯化试剂盒(Axygen,美国);Pav-fh AAV9载体(Vigenebio,美国)。主要仪器:全波长酶标仪、超微量高精度分光光度计、落地式培养摇床(美国Thermo公司);超速离心机(日本Hitachi);pH计(德国Mettler toledo公司);倒置显微镜(日本 Olympus);实时荧光定量扩增仪(美国Bio-Rad);荧光显微镜(日本Nikon);CO2培养箱(日本Sanyo); 超净工作台、生物安全柜(苏州安泰空气技术有限公司)。
1.2 方法
1.2.1 克隆大鼠ENPP1基因大片段:提取8周龄雄性SD大鼠的血管中膜平滑肌组织。确定大鼠目的基因ENPP1,NM053535.1;序列全长2 721 bp。设计引物:正向GCGTGAATTCGCCACCATGGAGCGCGACG;反向 GCGTACGCGTGTCTTCTTGGCTGAAGATTGGT。PCR引物由上海生工生物工程股份有限公司合成。模板:大鼠血管中膜平滑肌原代细胞cDNA。收到引物后瞬时离心,将引物干粉加水稀释成100 μmol/L的母液,再转入1.5 mL离心管,稀释10倍成为PCR工作液。应用RT-PCR试剂盒反转录扩增ENPP1基因。RT-PCR反应条件为:首先42 ℃ 30 min,98 ℃变性3 min进行反转录,随后98 ℃变性20 s,64 ℃退火30 s,72 ℃延伸90 s,循环35 次,再72 ℃延伸5 min,进行PCR扩增。扩增产物经1.0%的琼脂糖凝胶电泳初步鉴定片段大小,胶回收PCR产物,利用DNA纯化试剂盒将PCR产物进行纯化。
1.2.2 构建克隆质粒:将纯化PCR产物BamH I和EcoR I酶切后定向连接到pCDH-CMV-MCS-EF1-copGFPT2A-Puro(CD513B-1)载体中,构建pCDH-ENPP1重组质粒,将连接产物转化感受态细胞E.coli DH5α构建克隆质粒。步骤如下:将连接产物与感受态细胞混匀后冰浴30 min,42 ℃热激90 s,即置冰上 5 min,加入预热至室温的400 μL LB培养基,37 ℃ 恒温摇床200 r/min培养1 h,离心弃上清液后用移液器混匀后均匀涂布于含氨苄青霉素抗性的LB平板上,37 ℃倒置恒温培养箱培养过夜。挑取单菌落于37 ℃振荡培养过夜后提取质粒,限制性内切酶鉴定后送上海生工生物工程股份有限公司进行DNA测序。
1.2.3 重组pAAV/ENPP1质粒的构建:用EcoR I/Xho I分别对腺相关病毒空载体pAAV-MCS和pCDHENPP1重组质粒进行双酶切,反应结束后用1%琼脂糖凝胶电泳检测酶切目的条带大小,胶回收目的基因酶切片段,T4 DNA连接酶将目的片段与载体片段22 ℃连接2 h,连接产物转化大肠杆菌DH5α感受态细胞。将制备好的DH5α感受态置于冰浴中,待DH5α感受态细胞融化后,取1 μL连接产物于20 μL DH5α感受态细胞中,混匀后冰浴中静置30 min。放入 42 ℃水浴锅中40 s然后快速移至冰浴中,静置 2 min。向离心管中加入200 μL无菌LB培养基混匀后置于摇床中37 ℃,200 r/min,振摇1 h。涂布到含氨苄青霉素抗性的固体培养基平皿中,37 ℃培养箱中培养过夜进行筛选。将pAAV-MCS空载体转化大肠杆菌转染VSMC作为阴性对照。
1.2.4 重组pAAV/ENPP1质粒的筛选与鉴定:经含氨苄青霉素抗性筛选,挑取单菌落于37 ℃振荡培养过夜后提取质粒,挑取单菌落培养后提取质粒通过PCR和EcoR I/Xho I酶切鉴定阳性克隆,测序验证,测序结果与Gen Bank中所报道目的基因序列进行比对分析。
1.2.5 病毒包装:构建好的病毒载体和辅助质粒用Qiagen质粒抽提试剂盒进行大量抽提,保证浓度大于1 μg/μL,A260/A280 1.7~1.8,用以包装病毒。准备HEK-293T细胞,提前1 d将HEK-293T细胞按照5.0×105细胞/孔的密度接种到孔板中,包装时细胞密度85%~90%且细胞分布均匀,状态良好。转染前1~2 h给细胞换液为无血清的DMEM培养基(1% HEPES和1% P/S)。转染:配制包装mix,转染试剂、包装质粒、载体质粒、辅助质粒的比例为15:2:2:1。室温静置30 min。将静置后的液体加到HEK-293T细胞中摇晃混匀。将细胞置于37 ℃,5% CO2培养箱中培养72 h后收集病毒。收集病毒:将细胞吹起,与培养基一并收到50 mL离心管中。离心分离细胞沉淀及上清液。将培养基上清液转移到新管中,PGE8000沉淀过夜。离心去上清液,将细胞沉淀用PBS+0.001% PF68重悬。冻融1次后加入5 mmol/L NaCl 1 mL,涡旋混匀,将重悬液振荡混匀后超声至不黏稠。将超声后的液体3 500×g离心30 min,收集上清液。纯化:配置不同浓度的碘克沙醇,密度梯度离心。超速离心纯化病毒。浓缩:收集病毒,置于超滤管中对病毒进行浓缩。吸10 μL病毒液进行滴度检测及特异性检测。吸取病毒液用96 孔板转染HEK-293T细胞24 h。病毒滴度测定:腺相关病毒用蛋白酶K(5 μg/μL)处理破除病毒外壳,q-PCR法检测病毒滴度。设立5个梯度稀释浓度的质粒标准品的拷贝数,将超纯水作为阴性对照。根据标准曲线获得样品拷贝数。病毒颗粒数(个/mL)=与标准品相对值×10 000。
1.2.6 重组腺相关病毒转染VSMC:将目的细胞VSMC接种于96孔板,加入梯度稀释病毒原液,转染VSMC观察细胞形态以摸索最佳转染复数(MOI)。取正常生长的P4代VSMC,消化接种于6孔板,每孔2×105个细胞,待细胞密度达到70%~80%时进行病毒转染,将最佳MOI病毒液加入VSMC,混匀,37 ℃小体积转染96 h。
1.2.7 Western blot检测VSMC ENPP1蛋白的表达:蛋白样品制备:使用细胞裂解液,对VSMC进行裂解。然后BCA法测定蛋白浓度。测定562 nm处的吸光度值,根据标准曲线计算样品的蛋白浓度。聚丙烯酰胺凝胶电泳制胶,电泳30 min。转膜:将PVDF膜在甲醇中浸泡约30 s,再在转移缓冲液浸泡10 min,与滤纸、凝胶一起放入缓冲液中200 mA稳流电转移。封闭:PVDF膜去离子水洗涤后浸入封闭液,置摇床上室温封闭1 h。孵育一抗:取出已封闭的PVDF膜,浸于1×TBST缓冲液中,洗涤5 min,然后移入含有一抗的孵育盒中,4 ℃孵育过夜。TBST缓冲液洗膜。 孵育二抗:将PVDF膜转移到含二抗的抗体孵育盒孵育1 h后洗膜。ECL化学发光显影:将PVDF膜置于保鲜膜上,取适量ECL试剂盒中等体积的A液和B液混合,混匀后加在膜的表面,移入凝胶成像分析仪中,化学光敏模式曝光显影。
2 结果
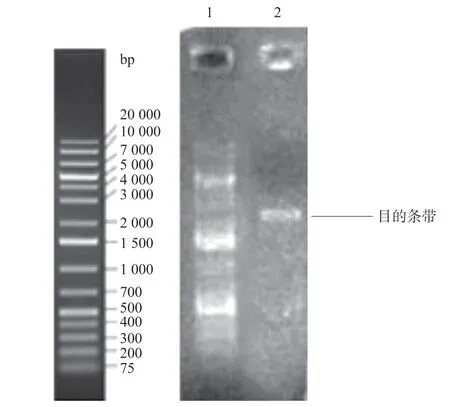
图1 目的基因ENPP1 PCR产物的纯化

图2 酶切重组质粒载体

图3 菌落PCR鉴定阳性克隆
2.1 大鼠ENPP1基因大片段的克隆与鉴定 在RTPCR反应中首先对PCR的退火温度进行梯度筛选,发现在退火温度为64 ℃时可以扩增出较特异的DNA片段,所得PCR产物大小约2 720 bp,与目的片段大小一致(见图1)。随后将该PCR产物与pCDH-CMV-MCSEF1-copGFP-T2A-Puro载体进行连接,酶切结果显示目的片段成功克隆至pCDH载体中(见图2),重组质粒载体转化大肠杆菌DH5α感受态细胞,培养后挑取单 菌落提取质粒进行菌落PCR鉴定阳性克隆(见图3)。2.2 重组pAAV/ENPP1质粒的构建与鉴定 经过EcoR I/Xho I酶切、连接、转化和氨苄青霉素抗性筛选,LB平板上有数十个可疑克隆生长,提取质粒后经EcoR I/Xho I酶切和PCR扩增鉴定,共获得3个阳性重组质粒pAAV/ENPP1。测序结果显示,3个质粒与基因库BLAST比对(见图4)为序列一致的大鼠ENPP1全长cDNA,同源性100%,E值达8×10-98,且开放读码框完全正确(见图5),表明大鼠VSMC ENPP1重组腺相关病毒载体构建成功。重组pAAV/ENPP1质粒用HEK-293T细胞包装。重组腺相关病毒滴度测定:q-PCR检测病毒滴度,质粒标准品的拷贝数,5个梯度稀释浓度分别为4.51×1011、3.73×1010、3.26× 109、5.57×108、4.31×107,得出标准曲线(见图6),根据标准曲线计算标准品相对值。最终获得ENPP1基因腺相关病毒滴度为2.79×1014v.g./mL。
2.3 rAAV/ENPP1转染VSMC后ENPP1表达情况 病毒转染组ENPP1蛋白表达较空白对照组高(见图7)。
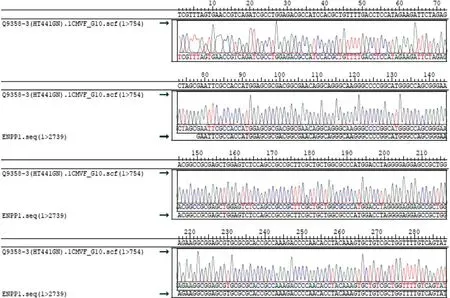
图4 目的基因序列测序图
3 讨论
ENPP1属于ENPP酶家族,是一种具有核苷酸焦磷酸酶和磷酸二酯酶活性的II型跨膜糖蛋白。ENPP1基因突变在人类可导致一种罕见的严重常染色体隐性遗传疾病——婴儿泛发性动脉钙化(generalized arterial calcification in infancy,GACI),特点是发生广泛中型肌性动脉钙化,病情进展迅速,多数患儿因心衰死于婴儿期[4]。敲除大鼠ENPP1基因可制作GACI动物模型,而给ENPP1基因敲除大鼠皮下注射ENPP1融合蛋白(小鼠ENPP1细胞外结构域融合人IgG1 Fc段)可明显减轻GACI模型小鼠的血管钙化,降低死亡率,以及心肌梗死及后遗症发生率[5],提示其在抑制血管钙化中具有非常重要的作用。
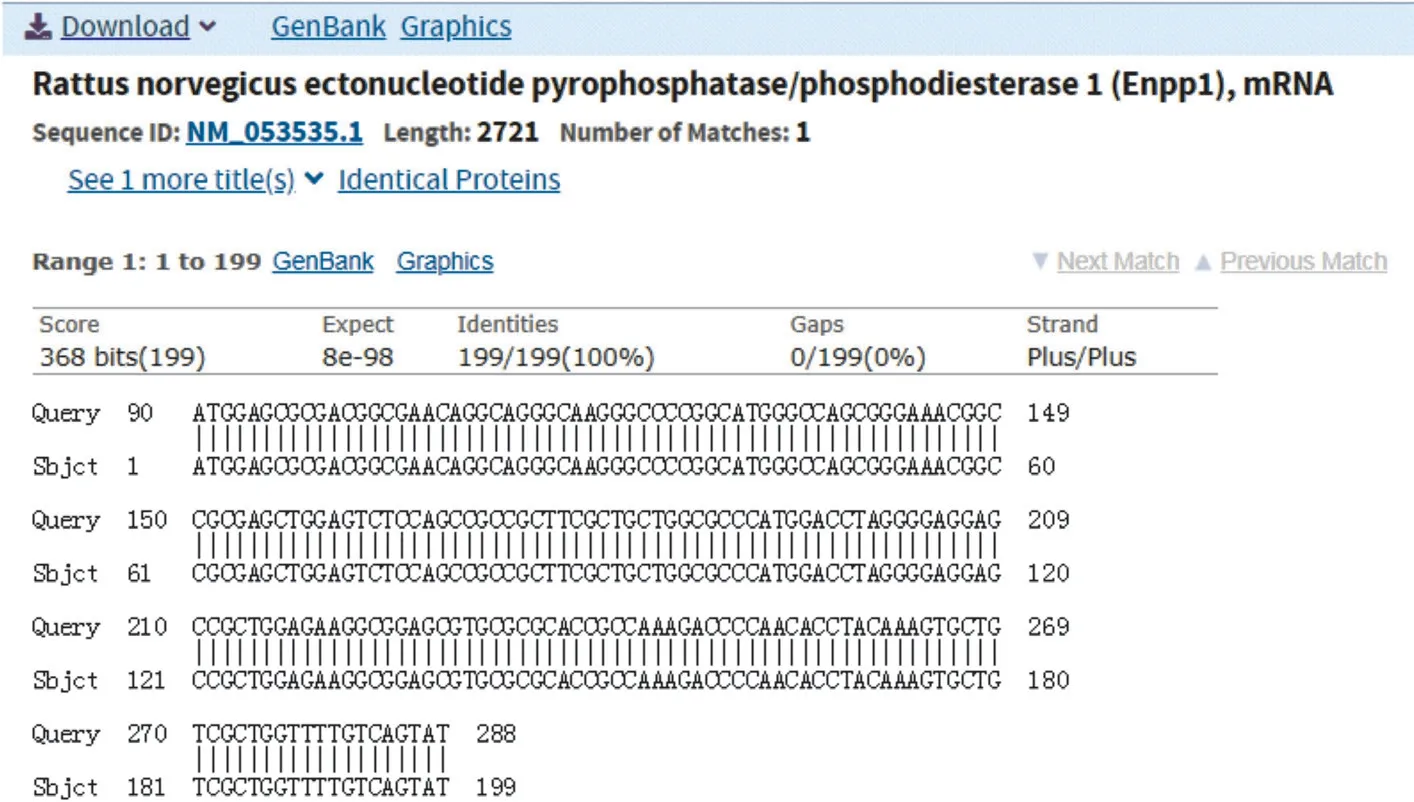
图5 基因序列BLSAT比对
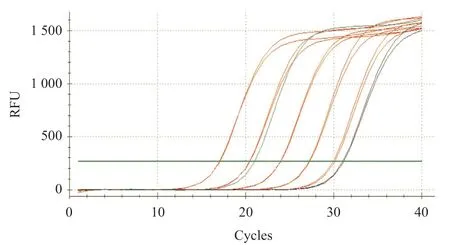
图6 ENPP1病毒液qPCR扩增曲线图

图7 ENPP1 Western blot条带图
ENPP1广泛参与核苷酸循坏、焦磷酸水平调控、磷脂信号调控、胰岛素受体调控及胞外激酶活性。ENPP1可通过水解胞外ATP中的5,磷酸二酯键生成AMP和焦磷酸(PPi),后者可防止非晶态磷酸钙的成核,还能抑制晶体向羟基磷灰石方向生长,并通过与羟基磷灰石表面结合形成不规则晶体而抑制晶体生长,有效预防病理性组织钙化。ENPP1Q等位基因与主动脉弓钙化增加有关[6]。有研究认为ENPP1可作为评价非糖尿病患者冠心病的生物学标志物[7]。因此我们认为ENPP1在慢性肾脏病、心血管病所致的血管钙化中也起着重要作用,是一个矿化调节的重要基因。目前,临床上对于血管钙化尚无特异性的治疗方法,或许可通过ENPP1基因治疗对血管钙化进行有效救治。
此外,病毒载体的选择也是基因治疗的关键。近年来,国内外对转基因治疗血管性疾病进行了深入研究。在这些实验中,常选择腺病毒载体,其优点是转染效率高,缺点是转染的基因表达时间较为短暂,不适合血管钙化这种慢性疾病的防治。与腺病毒相比,AAV携带的外源基因可以长时间稳定表达,而且它引起的免疫反应轻微。AAV属于细小病毒家族,是一类无包膜的复制缺陷病毒,可以通过基因工程技术将DNA传递给靶细胞,是一个非常稳定的载体,能够承受广泛的温度和pH变化,几乎没有丧失活性[8],已被证明是最有希望的人类基因治疗的病毒载体之一[9]。重组AAV(rAAV)是人工改造的AAV,AAV中与复制和包装相关的erp和cap基因被替换为ITRs间的基因,使rAAV具有4.1~4.9 kb的包装容量。rAAV由多个质粒组成,包括cis质粒、辅助质粒、erp/cap质粒,它们之间不具有同源性序列,故rAAV不具有复制能力,复制过程依赖于宿主细胞的聚合酶,因此避免通过重组而恢复出野生型病毒,宿主的免疫源性被降到最低。rAAV进入细胞后,作为附加的DNA能稳定存在,因此能长期表达外源基因,基因表达可持续数周至数月。rAAV是基因传递和表达的一个重要工具,本研究应用rAAV成功包装出具有2 721 bp的ENPP1大容量基因片段。目前AAV有12种血清型,不同的血清型有不同的衣壳蛋白结构、序列和组织特异性,因而其识别与结合细胞表面受体也相应有很大的差别。根据不同血清型转染细胞类型和转染效率,AAV-9转染原代细胞具有独特的能力,AAV-1和AAV-9在向骨骼肌和心肌传递基因方面表现得非常有效[9],AAV-2/9作为载体可在不引起炎症的情况下有效地传递冠状动脉和外周动脉平滑肌细胞中的基因[10]。本实验选用AAV-9血清型作为载体转染VSMC,Western blot显示转染目的基因后目的蛋白ENPP1高表达,提示AAV-9血清型可作为研究VSMC基因表达的载体。
总之,本研究选用AAV载体AAV-9 作为研究ENPP1的载体,在获得编码大鼠VSMC ENPP1的全长cDNA后,通过分子生物学技术将其装载至AAV载体rAAV-MCS中,最终通过酶切鉴定和DNA测序证实成功构建了序列信息完全正确的ENPP1重组AAV表达载体。
