2种镁基材料的体内外生物相容性研究
2021-03-01隋佰延
陆 华 隋佰延 刘 昕 孙 皎
(上海交通大学医学院附属第九人民医院·口腔医学院口腔材料室,上海生物材料研究测试中心,国家口腔疾病临床医学研究中心,上海市口腔医学重点实验室,上海 200011)
近年来,医用纯镁及镁合金作为一类新型可降解医用金属材料受到了极大的关注。对于预期应用于口腔、心血管领域和骨科的可降解类生物材料[1-3],必须具备良好的生物相容性。其中细胞毒性试验是首要考虑内容,因为它能在短期内检出材料对细胞新陈代谢功能的影响。基于医用镁及镁合金类材料目前仍然存在一些问题,如植入物释放出来的金属离子诱导炎症或引起过敏等[4-5]、金属腐蚀和磨损等造成的直接或间接的影响[6],镁离子及合金元素离子溶出,其一旦进入组织液会引发机体的组织反应、免疫反应、局部和全身反应等[7]。因此,为了预测医用镁及镁合金在与人体接触使用过程中的潜在危害性,将可能出现的不安全风险减少到最低程度,有必要对其进行一系列的生物学性能评价研究。本研究拟通过细胞毒性试验、遗传毒性试验、急性全身毒性试验、皮内刺激、致敏试验及肌肉植入试验来评价高纯镁(high purity Magnesium,HP-Mg)和镁-1钙(Mg-1Ca)合金的体内外生物相容性。
1 材料和方法
1.1 试样制备
1.1.1 高纯镁 由上海交通大学材料科学与工程学院提供,镁纯度99.99 wt%(0.002 wt%的Si;0.0015 wt % 的 Fe;0.0008 wt % 的 Al;0.0008 wt%的Mn),肌肉植入试样为直径1 mm、长度为10 mm的小棒;浸提液的制备均采用厚度为0.5 mm的小圆片。
1.1.2 镁-1钙合金 由北京大学工学院提供,镁纯度 98.8 wt%(0.003 8 wt % Si,0.027 wt % Fe),添加1.14 wt %Ca的挤压态Mg-1Ca合金,植入和浸提液的制备试样大小同高纯镁。
1.2 主要仪器设备
CO2细胞培养箱(MCO-17AIC,三洋,日本);多功能显微成像系统(DM6000B; Leica;):精密恒温恒湿箱(JHS-080,上海精宏设备有限公司);倒置显微镜(Olympus,日本);酶标仪(Multiskan FC型,美国热电);电感耦合等离子光谱仪(ICPOES,VISTAPRO,安捷伦,美国);pH计(Seven Compact S220,Inlab Solid, METTLER TOLEDO,瑞士)。
1.3 试验方法
本研究中实验动物的使用经上海交通大学医学院附属第九人民医院动物伦理委员会批准。
1.3.1 体外细胞毒性试验
1.3.1.1 MTT试验 根据ISO10993.12-2012[8]方法,无菌操作下以含10%胎牛血清的MEM培养基为浸提介质,按照3 cm2/mL 比例,37 ℃、24 h分别制备高纯镁及Mg-1Ca合金的浸提液。试验组选择100%浸提液作为浸提原液,下设75%、50%、25%的稀释浸提液组。采用同批浸提介质作为空白对照组。参照ISO 10993.5-2009[9]方法,选用L929 细胞,分别以不同浓度的试样浸提液接触细胞24 h,通过MTT方法来评估细胞的活力,如细胞存活率小于空白对照的70%,则视为材料具有潜在的细胞毒性。
1.3.1.2 镁离子浓度和pH值测定 采用ICP分别测定2种材料浸提原液和对照液中的Mg2+浓度。用pH计测定2种材料浸提原液及对照液的pH值。
1.3.1.3 pH值对细胞活力的影响 取2种材料的同批浸提原液,用1M的HCl调整pH值到7.4。同法接触细胞24 h,通过MTT方法评估细胞活力,研究pH值对细胞活力的影响。
1.3.2 遗传毒性研究
1.3.2.1 鼠伤寒沙门氏菌回复突变试验(Ames试验) 以0.9%氯化钠注射液(SC)为浸提介质,按照3 cm2/mL的浸提比例、37℃、72 h制备材料浸提液。选择100%浸提液作为浸提原液,下设3个稀释浓度组(50%、25%、12.5%)。阴性对照组采用同批浸提介质同条件制备。参照ISO 10993.3-2014[6]方法选用TA97、TA98、TA100、TA102的菌株组合采用平板掺入法进行Ames试验。
1.3.2.2 体外哺乳细胞基因突变试验(MLA试验) 采用含10%马血清的RPMI-1640培养液为浸提介质,按照3 cm2/mL的浸提比例,37℃、72 h制备浸提液。选择100%浸提液作为浸提原液,下设2个倍比稀释浓度组(50%、25%)。阴性对照组采用同批浸提介质同条件制备。参照ISO 10993.3-2014[10]的方法采用小鼠淋巴瘤细胞(L5178Y TK+/-)进行96孔平板法试验。
1.3.3 急性全身毒性 选择雄性ICR小鼠30只,重量18~22 g,随机分为6组,每组5只小鼠。分别以0.9%氯化钠注射液(SC)和棉籽油(CSO)为浸提介质,按照3 cm2/mL的浸提比例,在37℃、72 h条件下制备2种材料的SC浸提液和CSO浸提液,对照组分别采用同批浸提介质(同条件制备)。参照ISO 10993.11-2017方法,分别将各组SC浸提液直接注入ICR小鼠的尾静脉;各组CSO浸提液注入小鼠的腹腔内,观察注射后即刻、4 h、24 h、48 h 及72 h 内发生的不良反应,根据毒性表现和死亡动物数,评价2种材料对生物体潜在的急性危害。
1.3.4 皮内刺激试验 参照ISO 10993.10-2010[11]的方法,使用健康、初成年雄性的白化兔6只,2.5~3.0 kg,分别在兔的脊柱两侧皮内注射SC浸提液或CSO浸提液,设同批浸提介质(SC和CSO)为同体对照。注射后即刻、 24 h、48 h 和72 h 观察各注射部位皮肤组织的红斑和水肿反应,并分别计算2种材料组和对照组的综合平均记分。
1.3.5 致敏试验 选择豚鼠55只,体重300~350 g,雄性。参照ISO 10993.10-2010[11]的方法,采用最大剂量法,观察去除豚鼠腹部斑贴后24 h、48 h的红斑、水肿情况,评价2种材料浸提液引起的皮肤的病理性免疫反应(Ⅳ型免疫变态反应)。
1.3.6 肌肉植入试验 参照ISO 10993.6-2016[12]标准,选用新西兰兔,体重2.2~2.5 kg,每只兔子的左侧背部分别植入4个试验样品,右侧背部分别植入不锈钢试样作为同体对照。分别于术后4 w,12 w,26 w 临床观察实验动物一般状况,肉眼观察植入部位材料情况和组织反应的特性和程度。运用组织病理学技术,对局部肌肉组织的炎症反应、细胞类型、新血管形成及纤维囊腔形成等反应进行分级评价。
1.4 统计学分析
采用SPSS 16.0软件进行统计学分析,当P<0.05 时表示差异有统计学意义。
2 结果
2.1 体外细胞毒性
2.1.1 细胞存活率变化 2种材料浸提原液经梯度稀释后的细胞存活率结果见图1。由图1可见: 除Mg-1Ca合金100%浓度组的细胞存活率为(54.1±3.8)%之外,其余各组均大于70%,无细胞毒性;且细胞活力均随着浸提液稀释浓度的增大而递增;在100%和75%浓度下,高纯镁的细胞存活率优于镁-1钙合金(P<0.05)。
2.1.2 镁离子浓度及pH分析 MTT试验中2种材料浸提原液中的镁离子浓度和pH值的测定结果见表1。Mg-1Ca合金组的镁离子浓度及pH值均大于高纯镁组,且前者细胞活力略低于后者,提示镁离子浓度和pH值都有可能影响细胞活力。

图1 不同浓度浸提液接触24 h后的细胞存活率
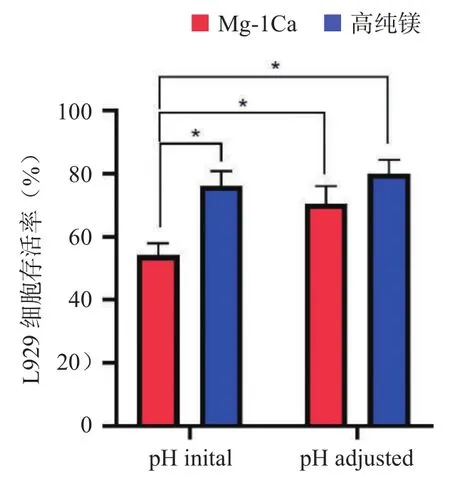
图2 pH值调整前后的细胞存活率

表1 浸提原液中的Mg2+浓度、pH值和细胞存活率
2.1.3 不同pH值对细胞活力的影响 浸提原液在调与不调pH的条件下细胞活力比较见图2。结果显示:未调整pH值时Mg-1Ca合金组细胞活力小于高纯镁组(P<0.05)。当调整材料浸提原液的pH值为7.4之后,细胞活力均上升至70%以上,且差异无统计学意义(P>0.05)。提示在镁离子浓度不变的情况下,pH值是引起细胞活力下降的主要原因。
2.2 遗传毒性
2.2.1 Ames试验 结果显示,2种材料浸提液在有或无代谢活化条件下,各试验菌株的自发回变数均在范围内,2组材料浸提液的各剂量组回变菌落数均未超过阴性对照组的2倍以上,且无剂量相关性趋势,结果为阴性(见表2~3)。提示2种材料对鼠伤寒沙门氏菌均无致突变性。
2.2.2 MLA试验 在无代谢活化条件下,2种材料的浸提原液与悬浮生长的小鼠淋巴瘤细胞交换24 h后的结果显示:100%浸提液组的细胞不成簇,活细胞数量明显减少,有一定的细胞毒性,导致细胞相对存活率低于10%而无法铺板。其余各浓度组在有或无代谢活化条件下,高纯镁组的突变频率在(96.5~169.4) ×10-6之间 ;Mg-1Ca合金组的突变频率在(93.3~152.0) ×10-6之间。与阴性对照组相比,2种材料浸提液各浓度组的突变频率未见明显增高,结果为阴性,提示2种材料浸提液均未引起体外哺乳动物细胞基因突变。
2.3 急性全身毒性
在注射各组浸提液后的72 h观察期内,试验组动物均未出现死亡;小鼠体重增长正常;呼吸系统、心血管系统、神经肌肉运动等临床症状均未见异常;生物学反应均不大于介质对照组。提示2种材料浸提液未引起急性的全身毒性反应。
表2 纯镁浸提液的Ames结果()
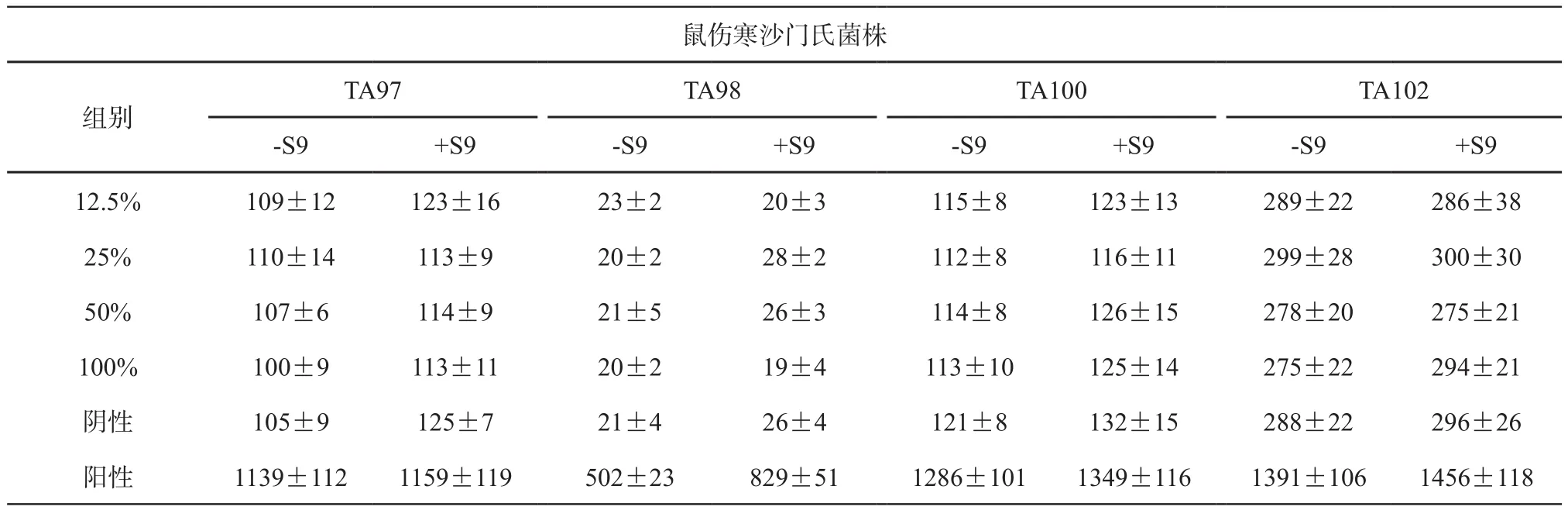
表2 纯镁浸提液的Ames结果()
鼠伤寒沙门氏菌株组别TA97 TA98 TA100 TA102-S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 12.5% 109±12 123±16 23±2 20±3 115±8 123±13 289±22 286±38 25% 110±14 113±9 20±2 28±2 112±8 116±11 299±28 300±30 50% 107±6 114±9 21±5 26±3 114±8 126±15 278±20 275±21 100% 100±9 113±11 20±2 19±4 113±10 125±14 275±22 294±21阴性 105±9 125±7 21±4 26±4 121±8 132±15 288±22 296±26阳性 1139±112 1159±119 502±23 829±51 1286±101 1349±116 1391±106 1456±118
表3 Mg-1Ca合金浸提液的Ames结果()
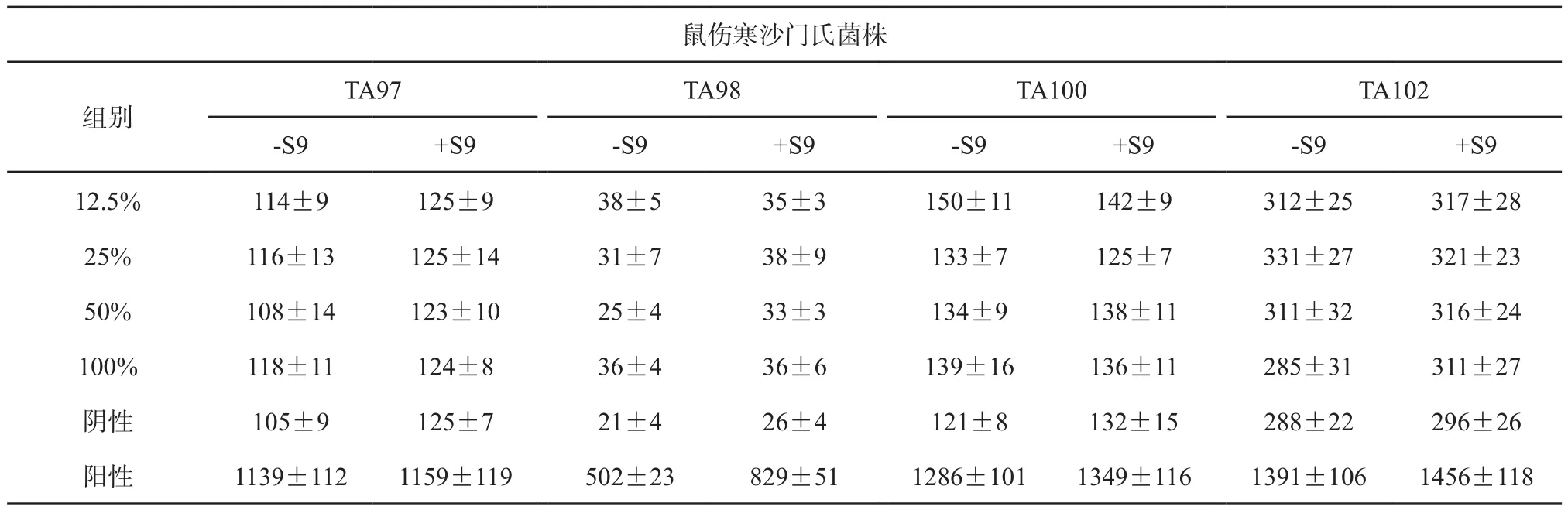
表3 Mg-1Ca合金浸提液的Ames结果()
鼠伤寒沙门氏菌株TA97 TA98 TA100 TA102-S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 12.5% 114±9 125±9 38±5 35±3 150±11 142±9 312±25 317±28 25% 116±13 125±14 31±7 38±9 133±7 125±7 331±27 321±23 50% 108±14 123±10 25±4 33±3 134±9 138±11 311±32 316±24 100% 118±11 124±8 36±4 36±6 139±16 136±11 285±31 311±27阴性 105±9 125±7 21±4 26±4 121±8 132±15 288±22 296±26阳性 1139±112 1159±119 502±23 829±51 1286±101 1349±116 1391±106 1456±118组别
2.4 皮内刺激试验
在 72 h 观察期内,所有动物浸提液注射区域的红斑、水肿反应记分均为0,材料组和对照组的平均记分之差均为0(不大于1.0),提示2种材料的浸提液不会产生皮内刺激反应。
2.5 致敏试验
在去除浸提液贴敷片后的48 h观察期内,试验组和对照组所有动物的腹部皮肤均未见红斑、水肿等明显改变, Magnusson 和Kligman分级记分均为0,皮肤致敏反应不大于对照组。研究表明在本实验条件下,2种材料浸提液未引起豚鼠病理性免疫反应(Ⅳ型免疫变态反应),无致敏性。
2.6 肌肉植入试验
大体解剖观察显示:4 w、12 w的局部肌肉组织中明显包裹着透明空腔,26 w时仍可见局部气腔。固定后切开肌肉组织横截面发现内部有大小不一、不规则的蜂窝状气孔存在。4 w时2组植入物的大小、形状基本未见异常改变,12 w时2组植入物变细,表面有缺损、形状不规则,且植入物表面出现白色粉末状物质。26 w时高纯镁组多数植入物变细变短,局部缺损或断裂;Mg-1Ca合金组多数残余植入物出现明显断裂或消失。
光学显微镜观察结果显示:阴性对照组26 w时材料植入处未见炎性浸润。纤维囊壁薄,由纤维细胞和胶原蛋白构成(见图3A)。高纯镁组4 w时的材料植入处见少量中性粒细胞及淋巴细胞浸润,可见异物巨细胞;纤维囊大小不一,膨胀成不规则形状,周围肌纤维部分断裂;12 w时纤维囊大小、形状不一,囊壁变薄;26 w时材料植入处基本未见炎症反应;囊壁极薄,可见较多的脂肪组织增生(见图3B)。Mg-1Ca合金组各期的组织学表现与高纯镁组基本相似(见图3C)。高纯镁及Mg-1Ca合金与阴性对照组相比的组织学平均记分之差均为0,可判定为无刺激性。
3 讨论
MTT试验是一种检测细胞活性的有效方法,它具有灵敏度高、重复性好的特点,目前已广泛应用于细胞活性、细胞毒性的检测评价。在本研究中,由于镁基材料的降解行为导致细胞活力发生一定程度的下降,这可能是细胞受到降解产物镁离子和培养液pH值变化两方面的影响所致。为了进一步解释这一问题,我们一方面通过调节培养液的pH值,另一方面测定浸提液中的镁离子浓度,结果显示:与Mg-1Ca合金相比,高纯镁由于所含镁的纯度高而腐蚀速度较慢,产生Mg2+相对较少,因此高纯镁浸提液接触细胞后的细胞存活率明显高于Mg-1Ca合金组,2组浸提液的pH值均为碱性(9.0~9.1)。调整浸提液pH值为7.4后的MTT试验结果表明:在保持Mg2+浓度不变的情况下,Mg-1Ca的细胞活力大大提高,2组的细胞活力均接近80%,揭示细胞活力可能更依赖于酸碱环境。因此,我们推测,Mg2+的释放不是影响其细胞活力的单一因素,调整pH值到7.4可能更能模拟体内真实环境。
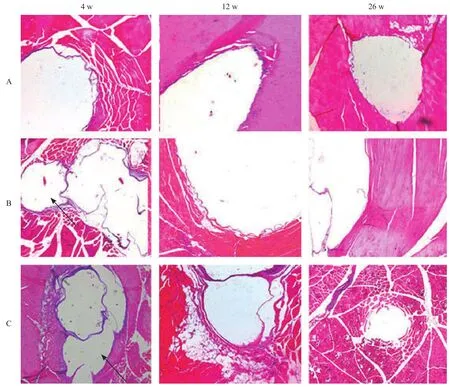
图3 肌肉植入后4 w,12 w,26 w组织病理学表现(×50)
一般体外细胞活性的评价是在非生理条件下或不受控制的pH值下进行的[13-14],由于镁金属的快速降解已明确地会导致细胞培养基的pH升高,及其降解产物浓度升高可能会改变体外试验系统的pH值和/或渗透压。考虑到体内生理条件下机体有一定的缓冲能力,即体内存在循环系统和碳酸盐平衡的生理性调节功能,因此,在本实验中适当地调整浸提液的pH值到7.4作为体外试验系统的一种缓冲补偿后进行细胞活力评价。
细胞DNA损伤和基因突变是引起癌症的一个重要因素,因此对于长期应用于人体的高纯镁和镁合金类可降解材料,有必要进行遗传毒性试验来检测是否存在材料导致的DNA损伤。本研究采用ISO10993-3推荐的Ames试验和MLA试验的组合来评价高纯镁和Mg-1Ca合金潜在的致突变性。Ames试验能检测出大多数致癌物质所产生的相关基因改变;MLA试验的遗传学终点是胸苷激酶(thymidinek inase,TK)基因的突变,且常染色体上TK基因位点的突变试验可用于评价染色体畸变。实验结果显示:2种材料均未引起鼠伤寒沙门氏菌回复突变和小鼠淋巴瘤基因突变,提示无潜在的致突变性。在本实验条件下,除了100%浸提液24 h组显示有一定的细胞毒性之外,其余稀释浓度组的突变频率均在正常范围之内。
全身毒性反应是生物材料临床应用前必须研究的项目之一。高纯镁及Mg-1Ca合金作为可降解的植入材料,当其降解成分被释放进入体内后,有可能会引起全身毒性反应。因此,本研究首先对这2种材料进行了急性全身毒性试验,结果显示它们均未引起小鼠急性全身毒性反应。同时也未引起局部皮内反应以及诱发豚鼠皮肤超敏反应,这与王飞等的动物试验的结果一致[15]。
本研究的肌肉植入实验结果表明,2种镁基材料均具有良好的组织相容性,尽管植入早期(4 w)的组织学上显示有轻微的炎症反应,但12 w和26 w时均未见局部肌肉组织的炎症反应,材料植入点的囊壁纤维化反应与对照组之间没有明显差异,说明镁基可降解材料在试验期间可以被机体所耐受[16]。然而,研究也发现:在4 w、12 w的局部肌肉组织中均存在明显的气体腔隙,且到26 w时气腔仍存在,俞懿强等[17]的长期骨植入试验发现了局部产气现象也未见明显的炎性反应。有报道认为氢气在血液、肌肉中都有一定的溶解度和扩散系数[18],能够依靠溶解、扩散被周围组织吸收,但是氢气在肌肉和骨组织中的扩散、吸收的机理尚不清楚。因此,本文提示未来临床研究中有必要关注局部的产气问题,该气体的持续存留是否会影响局部组织的长期愈合以及对局部肌肉运动有无影响等尚需进一步深入研究。
4 结论
在本试验条件下,高纯镁的细胞存活率优于镁-1钙合金,Mg2+的释放不是影响其细胞活力的单一因素,在一定的Mg2+浓度范围内,细胞活力可能更依赖于其酸碱环境;2种镁基材料无遗传毒性、无急性全身毒性、无刺激性和致敏性,具有良好的组织相容性。
