1株分离自云南省师宗县库蠓的新型西藏环状病毒
2021-03-01杨振兴谢佳芮李占鸿李卓然廖德芳牛保生姚萍芬
杨振兴,谢佳芮,李占鸿,李卓然,廖德芳,牛保生,姚萍芬,李 乐*,杨 恒*
(1.云南省畜牧兽医科学院云南省热带亚热带动物病毒病重点实验室,昆明 650224;2.云南省师宗县动物疫病预防控制中心,曲靖 655700)
环状病毒属(Orbivirus)病毒广泛分布于热带、亚热带与温带地区,病毒主要通过库蠓、蜱、蚊、白蛉等吸血昆虫对动物的叮咬传播,可感染人、反刍动物、马属动物、有袋目哺乳动物、蝙蝠以及鸟类等多种动物并引发相关疾病,给家畜的养殖以及人类的公共卫生安全带来严重的威胁[1-2]。库蠓(Culicoidesspp.)作为环状病毒属病毒重要的传播媒介之一,可传播包括蓝舌病病毒(bluetongue virus, BTV)[3]、非洲马瘟病毒(African horse sickness virus, AHSV)[4]和流行性出血病病毒(epizootic hemorrhagic disease virus, EHDV)[5]在内的多种环状病毒属病毒,引起动物的急性出血性疾病,给养殖业带来严重的经济损失。以BTV为例,2006年,北非来源的BTV血清8型毒株侵入荷兰,随后迅速蔓延至欧洲大部分国家,导致大量绵羊感染发病死亡,给欧洲各国带来了严重经济损失[6]。近年来,EHDV血清6型与血清7型毒株相关疫病在以色列、土耳其、日本等地的牛群中暴发,引起了世界动物卫生组织的高度重视[7-8]。
环状病毒属隶属呼肠孤病毒科(Reoviridae),病毒的基因组大小约21 kb,含有10个基因节段的双链RNA(dsRNA),依基因节段的大小分别命名为Seg-1(约3.9 kb)至Seg-10(约0.8 kb)。病毒粒子呈现二十面体对称结构,大小在60~80 nm[9],结构上分为外层衣壳、内层衣壳与内部核心3部分[10]。病毒内层衣壳上的T2蛋白在环状病毒属的不同种病毒之间高度保守,对T2蛋白氨基酸的分析是鉴定环状病毒属不同种病毒的重要依据之一[11]。环状病毒属病毒的外层衣壳蛋白OC1具有高度变异性,是诱导机体产生特异性中和抗体的主要蛋白,决定着病毒的血清型[12]。由于OC1蛋白高度变异的特性,导致环状病毒属病毒往往具有多种血清型,例如BTV已确认了28种不同血清型[13],EHDV已发现了10种血清型[14],ASHV已分离出9种血清型[15]。
2012年,国际病毒分类委员会(International Committee on the Taxonomy of Virues, ICTV)对已发现的22种环状病毒属病毒进行了认定[16]。近年来,随着人们对环状病毒属病毒的深入研究,不断有新型环状病毒被从媒介昆虫与感染动物上分离发现,例如:Bukakata orbivirus[17]、Mobuck orbivirus[18]、Skunk River virus、Kundal virus[19]、云南环状病毒(Yunnan orbivirus)[20]、广西环状病毒(Guangxi orbivirus)[21]、西藏环状病毒(Tibet orbivirus)[22]等。这些发现拓展了人们对环状病毒属病毒多样性的认识,为研究环状病毒属病毒的起源提供了基础,因此掌握新的环状病毒流行特征、致病性与感染宿主范围在动物疫病防控与保障公共卫生安全等方面具有重要的意义。
2009年,从我国西藏的墨脱县采集的蚊子标本中首次发现一种新型环状病毒(XZ0906),将其命名为西藏环状病毒(TIBOV)[22]。随后在广东省丰开县采集的致倦库蚊和湖南采集的三带喙库蚊分别分离到TIBOV毒株(D181/2008和HN11121)[23],2012和2013年,在云南省芒市与西双版纳采集的库蠓样本中分离到2株TIBOV(DH13C12和YN12246)[24-25]。通过分析决定TIBOV血清型的OC1蛋白的氨基酸序列,将发现的TIBOV分为两种不同的血清型。在采集的牛、羊与猪等动物的血清样本中检测到TIBOV的中和抗体,提示TIBOV可感染多种家畜,是一种潜在致病性病原[24]。2019年,作者在云南省师宗县进行库蠓采集与虫媒病毒分离,结果显示在库蠓上分离到1株新血清型TIBOV,本研究对病毒的分离、鉴定与初步的流行病学调查进行报道。
1 材料与方法
1.1 主要试剂、细胞株和毒株
一步法RT-PCR试剂盒、RNA提取试剂RNAiso-Plus、逆转录酶PrimeScript Ⅱ Reverse Transcriptase、DNA胶回收试剂盒、pMD19-T载体、E.coliDH5α感受态细胞、高分辨率琼脂糖等购自大连宝生物公司;Q5超保真DNA聚合酶与T4 RNA连接酶购自NEB公司;RNA纯化试剂盒MicroElute RNA Clean Up购自OMEGA公司;磁珠法病毒RNA抽提试剂盒、新生牛血清、MEM培养基购自Thermo公司;白伊蚊细胞(Aedesalbopictus, C6/36)和仓鼠肾细胞(Baby Hamster Syrian Kidney, BHK-21),BTV-1型毒株(Y863)、EHDV-1型毒株(V128/2014)与CHUV毒株(SZ187)由本实验室保存。
1.2 库蠓的采集
2019年8月,用光催化诱虫灯在云南省师宗县五龙壮族乡(E104°29′, N24°63′)的牛舍和羊舍等环境中采集吸血昆虫标本。采集的标本-20 ℃冰箱冻存处理30 min后,用筛孔尺寸为4 ~5 mm的金属筛网进行昆虫的初步筛选,收集过筛的昆虫,放入0 ℃的冰盒中当日送往实验室,在体视显微镜下对库蠓进行筛选,并按照采集地点分装于2.0 mL 的EP管中(200只·批-1),并置于液氮灌中保存。
1.3 病毒分离
取冻存的库蠓样本,加入1 mL含双抗(青霉素:100 U·mL-1,链霉素:0.1 mg·mL-1)的PBS洗涤虫体 1 次,离心弃上清,加入1 mL含双抗的MEM,放入多功能样品均质器TissueLyser II(Qiagen公司)中,选择频率30 次·s-1,研磨15 s,间隔5 s程序进行匀浆。将匀浆后的样本于4 ℃ 12 000 g·min-1离心20 min,吸取400 μL上清液分别接种于长成单层的C6/36和BHK-21细胞,置28和37 ℃的5%CO2培养箱中,感作1 h。孵育结束后,加入含2%牛血清和1%双抗的MEM培养7 d,并分别在两种细胞上连续盲传3~4代。若接种细胞出现规律的CPE,冻融细胞2次,离心收集上清,对病毒分离物进行编号,-80 ℃ 保存。
1.4 核酸提取及病毒核酸检测
使用磁珠法病毒RNA抽提试剂盒,按说明书提取病毒分离物的核酸。将提取的核酸95 ℃加热3 min,并迅速置冰上进行冷却。使用本实验室设计的BTV、EHDV、AHSV、阿卡斑病毒(AKAV)和帕利亚姆血清群病毒(PALV)等病毒群特异性引物(表1)进行RT-PCR鉴定,同时设立阴性和阳性对照。

表1 用于鉴定本研究分离病毒的引物Table 1 Primers used to identify the viruses isolated in this study
1.5 病毒基因组dsRNA的提取与电泳观察
与我国分离的BTV-1(Y863)、EHDV-1(V128/2014)和CHUV(SZ187)做对照,将病毒分别接种BHK-21细胞(75 cm2细胞瓶培养),待细胞出现完全CPE后,离心收集细胞,RNAiso-Plus方法提取总RNA。按Attoui等[26]报道的方法,在提取的总RNA中加入等体积4 mol LiCl对宿主ssRNA进行离心去沉淀,在上清中加入无水乙醇沉淀病毒的基因组dsRNA。以高分辨率琼脂糖配制2%浓度的凝胶,取10 μL纯化后的病毒基因组dsRNA于4 ℃以90 V 电压电泳2~3 h, 比较分析待测病毒同BTV、EHDV和CHUV等3种病毒基因组dsRNA在琼脂糖凝胶上的电泳带型。
1.6 病毒粒子观察
将病毒接种BHK-21细胞进行扩大培养,出现60%~70% CPE后刮下细胞,8 ℃ 3 500 r·min-1离心30 min,弃上清,沉淀用PBS悬浮后,超声波处理3次,12 000 r·min-1离心2 min,取上清液滴加在覆有Formver膜的铜网上,约3 min用滤纸从铜网边缘吸去多余的液体,将铜网放入2%磷钨酸(pH 7.2)中负染5 min,用滤纸吸去多余的染色液,室温风干后进行透射电镜拍照分析,观察病毒粒子结构特征。
1.7 Seg-2与Seg-3克隆测序
取纯化后的病毒基因组dsRNA参照Maan等[27]报道的全长cDNA扩增技术(full-length amplification of cDNAs, FLAC)进行病毒的全基因组cDNA合成。使用Q5超保真Taq酶进行PCR扩增,扩增程序:94 ℃预变性3 min,94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸3 min,30个循环。电泳检测病毒基因组PCR扩增情况,胶回收Seg-2和Seg-3片段,并与pMD19-T载体连接,将连接产物转化E.coliDH5α感受态细胞,涂布含Amp的LB平板,挑取白色菌落进行菌落PCR鉴定,将阳性菌落送测序。
1.8 病毒序列分析与系统发育树的构建
使用序列拼接软件CExpress对测序结果进行拼接后,使用NCBI网站中的在线ORF分析软件进行Seg-2与Seg-3基因节段的ORF区分析。通过Mafft-win软件[28]比对从GenBank中下载的其他环状病毒属代表毒株序列与本研究中毒株基因组序列后,用BioEdit软件进行核酸和氨基酸序列相似度计算。使用MEGA 6.0软件[29]对对比后的氨基酸序列进行模型选择及最大似然树(maximum-likelihood, ML)系统发育树的构建,系统发生树中的其他国家分离的毒株序列以“GenBank序列号_病毒”表示,本研究中获取的毒株以黑色三角表示。
1.9 当地家畜的TIBOV抗体检测
2019年8月,在师宗县五龙壮族乡分别采集黄牛和山羊全血40和68份,分离血清后,使用中和试验进行TIBOV抗体检测。采用Karber法测定分离毒株的TCID50,将病毒液稀释至100 TCID50备用。将待测血清进行倍比梯度稀释(1∶10~1∶1 280), 加入96孔细胞培养板(50 μL·孔-1),加入100 TICD50的病毒悬液(50 μL·孔-1),充分混匀后37 ℃ 5% CO2条件下孵育1 h。在细胞板中加入BHK-21细胞悬液(100 μL·孔-1),37 ℃ 5% CO2条件下培养7 d,逐日观察细胞病变,并计算抗体效价(抗体效价<1∶10判定为阴性,抗体效价≥1∶10判定为阳性)。
2 结 果
2.1 库蠓的采集与鉴定
2019年8月,在云南省师宗县五龙壮族乡的牛舍中采集库蠓约1 600只,羊舍中采集库蠓约1 200只,按照采集地点200只·批-1分装于2.0 mL的管中,置液氮灌中保存,直至分离病毒时取出。
2.2 病毒分离
将研磨处理后的库蠓样本分别接种C6/36和BHK-21细胞后连续盲传3代,最终获得3株能引起细胞规律病变的分离物,其中,2株病毒分离物(YNSZ/V291/2019和YNSZ/V292/2019)接种C6/36细胞病变不明显,接种BHK-21细胞72~96 h后,细胞出现圆缩和脱落。1株病毒分离物(YNSZ/V290/2019)接种C6/36和BHK-21后均可引起明显的细胞病变(图1),接种BHK-21细胞24 h后细胞出现明显的圆缩,48 h后开始大量脱落;接种C6/36细胞48 h后细胞开始出现部分圆缩,72 h后细胞才开始大量出现圆缩和脱离。

A、B、C和D分别表示YNSZ/V290/2019接种BHK-21细胞24、48、72和96 h后的细胞状态;F、G、H和I分别表示YNSZ/V290/2019接种C6/36细胞24、48、72和96 h后的细胞状态;E、J分别表示96 h后的BHK-21和C6/36细胞对照A, B, C and D indicate the cell state of BHK-21 cells after YNSZ/V290/2019 strain-infected 24, 48, 72 and 96 h,respectively; F, G, H and I indicate the cell state of C6/36 cells after YNSZ/V290/2019 strain-infected 24, 48, 72 and 96 h, respectively; E, J indicate uninfected BHK-21 and C6/36 control cells at 96 h, respectively图1 YNSZ/V290/2019接种BHK-21和C6/36细胞后能引起CPE(100×)Fig.1 Cytopathic effect of YNSZ/V290/2019 isolates on BHK-21 and C6/36 cells (100×)
2.3 病毒的RT-PCR鉴定结果
提取3株病毒分离物的核酸,分别使用EHDV、BTV、PALV、AKAV和AHSV鉴定引物进行RT-PCR检测。YNSZ/V291/2019和YNSZ/V292/2019毒株鉴定为EHDV,而YNSZ/V290/2019毒株的检测结果均为阴性。
2.4 高分辨率琼脂糖凝胶电泳分析
提取并纯化待鉴定的YNSZ/V290/2019、BTV-1(Y863)、EHDV-1(V128/2014)和CHUV(SZ187)毒株的基因组dsRNA,以2%的高分辨率琼脂糖凝胶进行电泳。结果如图2显示,YNSZ/V290/2019的dsRNA电泳带型与BTV和EHDV的较相似,呈现出“3-3-3-1”电泳带型,而CHUV的电泳带型显“3-3-4”的带型特征。基因组电泳结果表明YNSZ/V290/2019为基因组分节段dsRNA病毒,且各基因节段大小与BTV和EHDV比较接近。

1.YNSZ/V290/2019;2.蓝舌病病毒;3.流行性出血病病毒;4.中山病病毒1. YNSZ/V290/2019; 2. BTV; 3. EHDV; 4. CHUV图2 dsRNA高分辨率琼脂糖凝胶电泳结果Fig.2 The high-resolution agarose gel electrophoresis result of genomic dsRNA
2.5 病毒粒子观察
在电镜下观察YNSZ/V290/2019的病毒粒子形态特征,结果如图3显示:病毒形态呈球形,无囊膜,直径55~75 nm,在病毒粒子表面可看见纤维状突起,与文献报道的环状病毒属病毒形态特征较接近[24]。结合病毒基因组dsRNA电泳结果,提示分离的病毒很可能为环状病毒属病毒。

图3 YNSZ/V290/2019的负染电镜观察(110 000×)Fig.3 Negative staining electron microscopy observation of YNSZ/V290/2019 virions (110 000× magnification)
2.6 病毒Seg-2与Seg-3的克隆测序
采用FLAC技术,通过克隆的方式获取YNSZ/V290/2019毒株Seg-2与Seg-3基因片段,电泳显示该毒株Seg-2与Seg-3的片段约为3 kb(图4)。测序结果显示,克隆的Seg-2、Seg-3 DNA长度分别为2 820 和2 770 bp,G+C含量分别为40.03%和44.67%,均具有Kozak序列特征,编码的OC1与T2蛋白氨基酸残基数分别为922和899 aa。
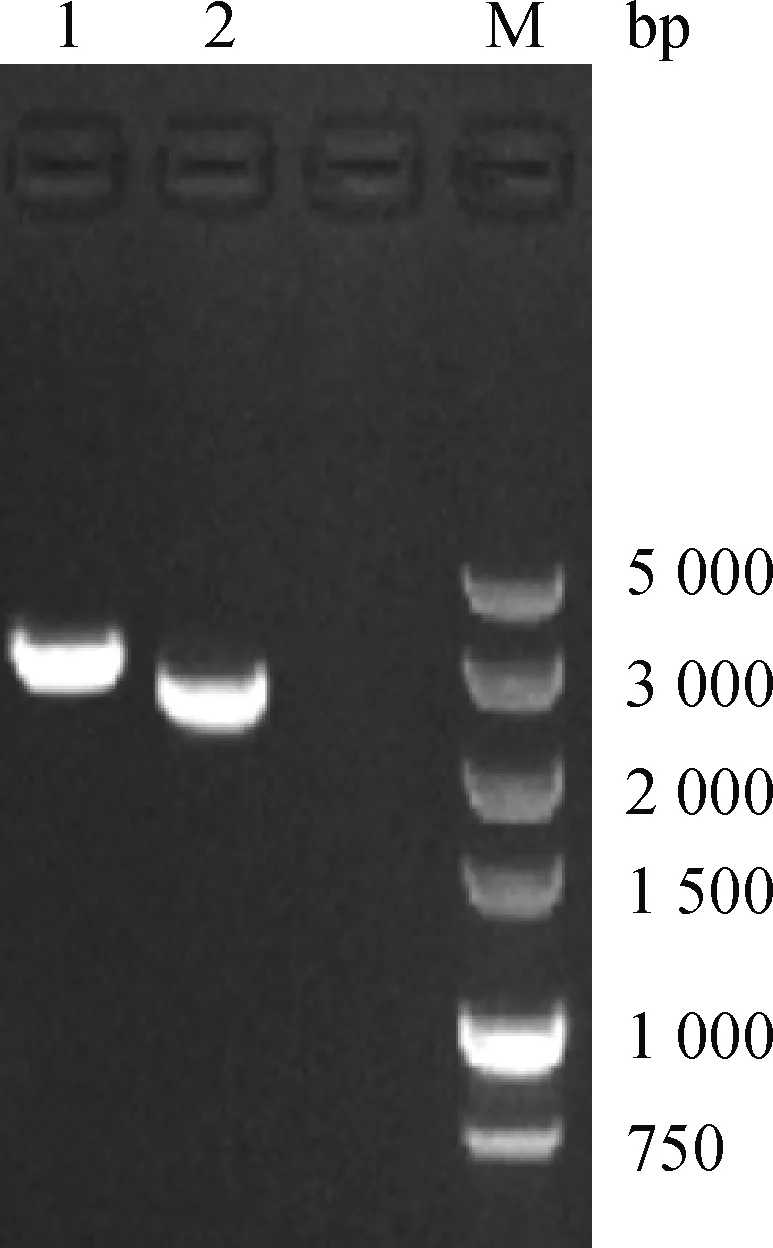
1. Seg-2;2. Seg-3;M. DL5000 DNA相对分子质量标准1. Seg-2; 2. Seg-3; M. DL5000 DNA marker图4 YNSZ/V290/2019毒株Seg-2和Seg-3电泳图Fig.4 Seg-2 and Seg-3 electrophoresis of YNSZ/V290/2019 strain
2.7 YNSZ/V290/2019毒株的鉴定
环状病毒属的T2蛋白具有高度保守性,同种病毒间氨基酸序列相似度>82%,因此,对该蛋白的氨基酸序列分析是鉴定环状病毒属不同种病毒最为重要的手段[19-22]。序列比对显示(表2),YNSZ/V290/2019的Seg-3/T2序列与TIBOV的序列相似度最高,核酸序列相似度为80.90%~81.70%,氨基酸序列相似度为97.20%~97.30%;与BTV、EHDV和Pata virus相似度较低,核酸和氨基酸序列相似度分别为68.90%~70.90%与75.80%~77.80%,表明分离的YNSZ/V290/2019毒株为TIBOV的一个成员。
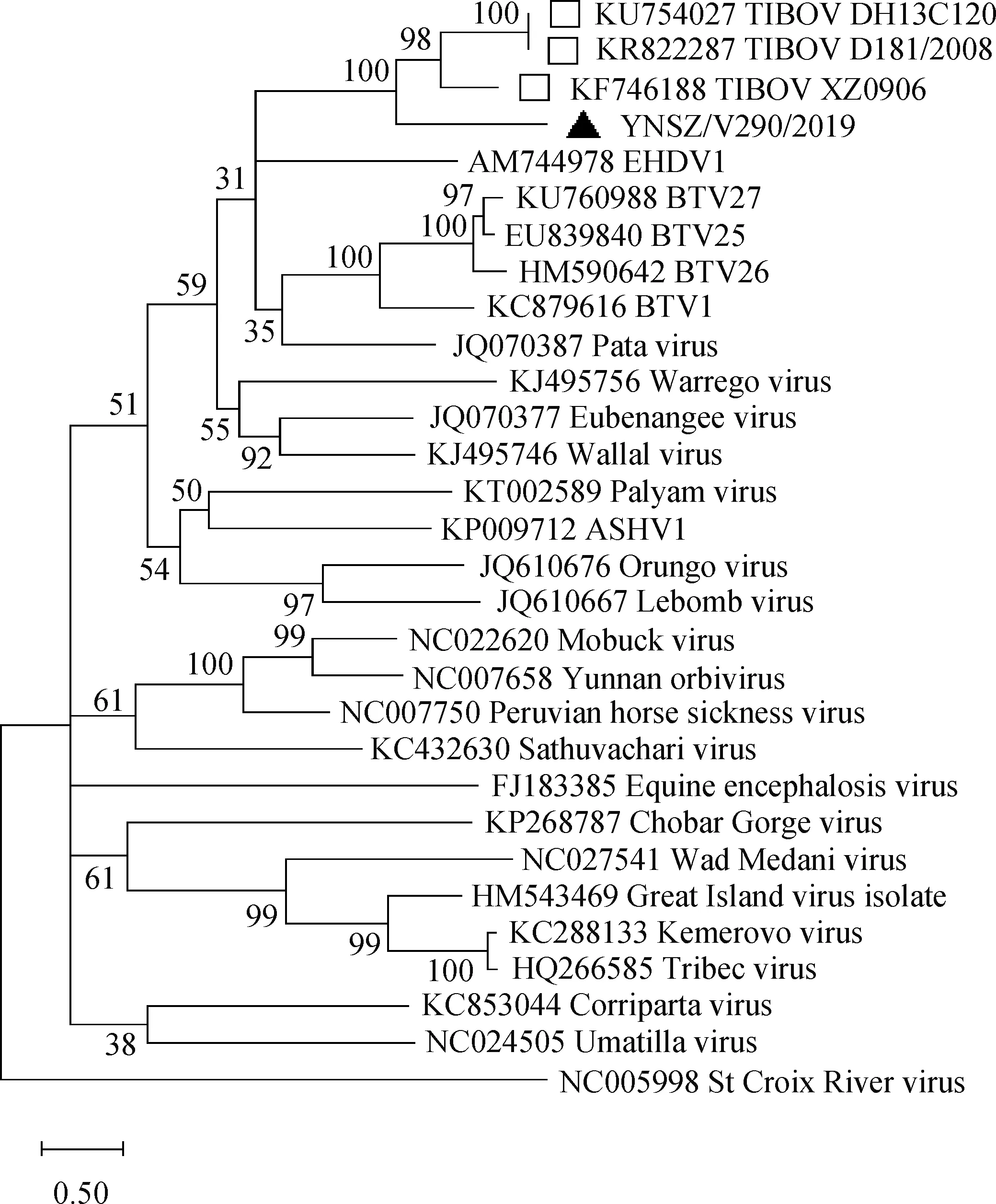
为明确YNSZ/V290/2019与其他环状病毒之间的进化关系,笔者选择已知的22种环状病毒属病毒T2蛋白的氨基酸序列进行ML树的构建,选择的最优进化模型为LG+G+F。构建的系统发生树显示(图5),环状病毒属病毒的T2聚为三簇,分别为库蠓传播环状病毒(CBOs),蜱传播环状病毒(TOBs)与蚊传播环状病毒(MOBs)。分离的YNSZ/V290/2019位于CBOs进化分支,与已报道的TIBOV聚为一簇,与BTV、EHDV和Pata virus具有最近的亲缘关系,这提示库蠓很可能是TIBOV的主要传播媒介。
2.8 YNSZ/V290/2019毒株OC1蛋白的系统发育分析
环状病毒属的外层衣壳蛋白OC1决定着病毒的血清型,由于该蛋白的高度变异特性,导致同一种环状病毒往往存在众多的血清型,当决定同种环状病毒血清型的OC1蛋白的氨基酸序列相似度<64%时,可判定为同种病毒的不同血清型[14]。目前,已知的TIBOV中存在两种不同的血清型,分别以DH13C120毒株和XZ0906毒株为代表[22,24],两种血清型毒株Seg-2/OC1相似度最高分别为30.7%与42%。YNSZ/V290/2019的出现进一步降低了不同血清型TIBOV毒株之间Seg-2/OC1的序列相似度,YNSZ/V290/2019与已知毒株的Seg-2核酸序列相似度在26.90%~30.60%,OC1蛋白氨基酸序列相似度在28.50%~33.20%,明显<64%(表2)。同时在系统发生树上(图6),YNSZ/V290/2019形成了一个独立于其他已知TIBOV的进化分支,进一步证实该毒株可能为一种新血清型的TIBOV。

表2 YNSZ/V290/2019毒株与环状病毒属病毒的核酸及氨基酸序列相似度Table 2 Nucleotide sequence and amino acid sequence similarity of YNSZ/V290/2019 with virus species of genus Orbivirus %
2.9 TIBOV中和抗体的检测
为分析新血清型TIBOV(YNSZ/V290/2019)在动物上的感染情况,笔者通过血清中和试验,对师宗县采集的牛、羊血清进行了初步调查。试验结果显示,40份黄牛血清检测9份为阳性,阳性率为22.50%,68份山羊血清检测3份为阳性,阳性率为4.41%。上述结果说明TIBOV(YNSZ/V290/2019)可感染牛、羊,且在牛上有着较高的感染率。

YNSZ/V290/2019 毒株以黑色三角表示,TIBOV毒株以方框显示,树图节点的数值表示重复500次的自举检验可信值。感染蜱的环状病毒St Croix River virus作为系统发育树的外类群。树图中不同种类的环状病毒以“GenBank序列号_病毒名表示”。CBOs.库蠓传播环状病毒;MBOs.蚊传播环状病毒;TBOs.蜱传播环状病毒YNSZ/V290/2019 was represented as black triangle, TIBOV was represented as black boxes, the number at nodes indicate bootstrap confidence 500 bootstrap replicates. St Croix River virus from infected tick was as out group. Different Orbivirus species were indicated as "GenBank accession number plus virus name", Culicoides-borne orbiviruses (CBOs), Mosquito-borne Orbiviruses (MBOs), and Tick-borneorbiviruses respectively (TBOs)图5 YNSZ/V290/2019毒株T2蛋白ML系统发育树图Fig.5 Maximum likelihood (ML) tree showing phylogenetic relationship of T2 proteins of YNSZ/V290/2019
3 讨 论
云南省师宗县平均海拔1 800~1 900 m,域内河流众多,森林覆盖率47.11%,有亚热带与温带共存的气候特征,终年温和(年平均气温13.9 ℃),无霜期达273 d,非常适宜媒介昆虫的生存繁衍,虫媒病毒种类众多。1979年,张念祖等[30]在云南省师宗县暴发蓝舌病的绵羊中首次分离到BTV,确定了BTV在我国的存在。2012年至今,本实验室在师宗县设立的哨兵动物中先后分离到12种血清型的BTV(BTV-1、-2、-3、-4、-5、-7、-9、-12、-15、-16、-21、-24)[31]、5种血清型的EHDV(EHDV-1、-5、-6、-7、-10)、 3种帕利亚血清群病毒(Palyam serogroup virus, PALV)[32]及多株阿卡斑病毒(Akabanevirus, AKAV)[33]。新血清型TIBOV(YNSZ/V290/2019)在师宗县采集库蠓上的分离,再次表明师宗县虫媒病毒的高度多样性。笔者认为该地区作为了解云南虫媒病毒的一个窗口,值得进一步进行虫媒病毒的长期跟踪调查。
YNSZ/V290/2019 毒株以黑色三角表示,TIBOV毒株以方框显示,树图节点的数值表示重复500次的自举检验可信值。感染蜱的环状病毒St Croix River virus作为系统发育树的外类群YNSZ/V290/2019 was represented as black triangle, TIBOV was represented as black boxes, and the number at nodes indicate bootstrap confidence 500 bootstrap replicates. St Croix River virus from infected tick was as out group图6 YNSZ/V290/2019毒株OC1蛋白ML系统发育树图Fig.6 Maximum likelihood (ML) tree showing phylogenetic relationship of OC1 proteins of YNSZ/V290/2019
2019年8月,从师宗县的库蠓上分离到1株分离物YNSZ/V290/2019,经BTV、EHDV、PLAV、AKAV和AHSV的群特异性检测,鉴定结果均为阴性,使对病毒的鉴定陷入困境。病毒基因组的琼脂糖凝胶电泳、病毒粒子的电镜观察均为国际病毒分类委员会用于环状病毒属鉴定的重要参数之一。因此笔者提取YNSZ/V290/2019毒株的基因组进行凝胶电泳,结果显示其基因组为双链RNA,且电泳带型特征与BTV和EHDV接近,因此,认为YNSZ/V290/2019很可能为环状病毒属病毒。在电镜下观察,YNSZ/V290/2019的病毒粒子呈球形,无囊膜,病毒粒子表面分布大量纤维状突起,形态与文献报道的环状病毒属病毒特征较接近[25],进一步明确了分离病毒的分类。
虽然病毒基因组电泳和电镜观察为锁定YNSZ/V290/2019毒株为环状病毒属病毒提供了线索,但该毒株在环状病毒属病毒中的分类地位尚不明确。T2蛋白在环状病毒属病毒的同种病毒之间高度保守,因此对该蛋白的氨基酸序列分析是环状病毒属不同种病毒鉴定最为重要的参数,当两种环状病毒属病毒的T2蛋白氨基酸序列相似度>82%可判定为同一种环状病毒[17-20]。YNSZ/V290/2019毒株和已知TIBOV的T2蛋白的氨基酸序列相似度>97%,在系统发生树上与中国分离的TIBOV聚为一簇,独立于其他环状病毒属病毒,证实了本研究分离的YNSZ/V290/2019为TIBOV的一员。
环状病毒属病毒可在其媒介体内进行增殖,因此环状病毒属病毒与媒介之间存在共进化关系。在系统发生树上,环状病毒属病毒高度保守的T2蛋白分为库蠓传播环状病毒(CBOs)、蚊传播环状病毒(MBOs)与蜱传播环状病毒(TBOs),这与病毒的天然传播媒介完全吻合,从另一个侧面也证实环状病毒属病毒对其传播媒介的依存。在系统发生树上,YNSZ/V290/2019与库蠓传播的BTV、EHDV、PALV等聚为一簇,表明了库蠓是TIBOV的主要传播媒介。文献报道显示,TIBOV-1型XZ0906毒株与TIBOV-2型D181/2008毒株分离自蚊子,我们认为很可能是蚊子叮咬了感染TIBOV动物的血液,分离的病毒很可能是来自蚊子消化道中血液。TIBOV是否能在蚊子体内增殖,仍需要调查研究。
环状病毒属的Seg-2/OC1决定病毒的血清型,通过Seg-2/OC1的序列分析,已发现我国流行的TIBOV存在两种不同的血清型[24-25]。在我国西藏分离的TIBOV(XZ0906毒株)代表一种血清型,将其命名为TIBOV-1型;在我国云南与广东省分离的TIBOV(DH13C120毒株与D181/2008毒株)代表着另一种血清型,将其命名为TIBOV-2型,TIBOV-1与TIOBV-2型之间OC1的序列相似度为42%。本试验分离的YNSZ/V290/2019与TIBOV-1和TIBOV-2血清型毒株的OC1最大相似度分别为33.20%与28.50%,在OC1的系统发生树上YNSZ/V290/2019形成了独立于TIBOV-1与TIBOV-2的独立进化分支,以上结果均表明该毒株代表着一种新血清型的TIBOV,将其命名为TIBOV-3。由于缺乏TIBOV-1至TIBOV-3等3种血清型标准阳性血清,不同血清型TIBOV之间是否存在交叉反应尚难以进行判定,该工作有待于后续研究中逐步完善。
对YNSZ/V290/2019感染范围的初步调查结果显示,黄牛和山羊血清中均存在TIBOV抗体,抗体阳性率分别为22.50%和4.41%,表明牛和山羊均能被TIBOV感染,但在牛的病毒感染率更高。目前尚未见在动物中分离TIBOV的报道,但笔者和他人的研究结果均显示TIBOV在我国云南省的牛羊中有着较高的感染率,同时,在我国的云南、广西、湖南与西藏采集的媒介中均分离出TIBOV[22-25],表明TIBOV在我国很可能有着广泛的分布,因此,该病毒的感染宿主范围、感染率与致病性等方面的工作仍值得进一步调查。在下一步工作中,将完成YNSZ/V290/2019毒株的全基因组测序工作,开发TIBOV的群特异性和血清型特异性qRT-PCR检测技术,开展TIBOV的分离、致病性与流行病学调查等方面的研究。
4 结 论
2019年,在师宗采集的库蠓上分离到1株新型TIBOV(YNSZ/V290/2019),Seg-3/T2序列与已知TIBOV的序列相似度最高(80.90%~81.70%/97.20%~97.30%);Seg-2/OC1序列与已知TIBOV的序列相似度最低(26.90%~30.60%/28.50%~33.20%),并且在OC1氨基酸ML树上,YNSZ/V290/2019形成了一个独立于其他已知TIBOV的进化分支。中和试验显示,师宗的黄牛和山羊血清中均存在TIBOV抗体,表明牛和山羊均能被TIBOV感染,但在牛的感染率更高。
