基于H蛋白表位合成肽的小反刍兽疫病毒抗体间接ELISA检测方法的建立
2021-03-01李彦敏朱学亮张学燕NiyokwishimiraAlfred窦永喜张志东
钱 榜,李彦敏,2,朱学亮,张学燕,Niyokwishimira Alfred,窦永喜*,张志东,2
(1.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,兰州 730046;2.西南民族大学畜牧兽医学院,成都 610041)
小反刍兽疫(peste des petits ruminants,PPR)是由副黏病毒科麻疹病毒属小反刍兽疫病毒(peste des petits ruminants virus, PPRV)所引起的一种对小反刍类动物具有高度致死性的病毒病[1-2],主要通过直接接触经呼吸系统传播,亦可通过精液、胚胎和乳汁等途径传播,是一种高度接触性传染病。PPRV主要宿主为山羊和绵羊等小反刍类动物,报道表明骆驼[3-4]、牛和水牛等大型反刍动物也可被感染[5-6],但通常为亚临床症状。此外,狮子、犬[7]、瞪羚、大羚羊、蓝羚羊[8]以及野猪[9]也可感染PPRV。PPRV感染后临床症状主要表现为发热、肺炎、腹泻,呼吸道和消化道黏膜炎症等[10]。PPR被世界动物卫生组织(OIE)列为法定报告的动物疫病,我国将其列为一类动物疫病[2,11-12]。自2007年在我国首次报道以来,该病在我国西藏、山东、内蒙古等省(区)蔓延传播[13-15],对我国畜牧业的健康、有序发展造成严重挑战[16]。
PPRV只有1个血清型,根据 F蛋白及N蛋白基因序列将PPRV分为4个谱系(Ⅰ、Ⅱ、Ⅲ和Ⅳ)[17-19],其中,我国流行的主要为Ⅳ系。该病毒为单股负链RNA病毒,共编码8个蛋白,分别为融合蛋白(F)、血凝集素蛋白(H)、基质蛋白(M)、核衣壳蛋白(N)、磷蛋白(P)和大蛋白(L)6个结构蛋白以及2个非结构蛋白(C、V)[20-21]。N蛋白是病毒中含量最为丰富且免疫原性最强的蛋白,基于N蛋白的PPRV诊断技术已被广泛开发应用。H蛋白为病毒囊膜蛋白,分为膜内区和膜外区,是麻疹病毒属保守性最差的蛋白之一,该蛋白通过与宿主细胞受体结合从而决定病毒的细胞嗜性[22],其为诱导宿主保护性免疫反应的主要蛋白[23-24]。目前,针对PPRV的血清学检测大部分以N和H蛋白产生的抗体为基础。由于N蛋白不能诱导机体产生针对病毒的免疫保护且在麻疹病毒属病毒中具有高度保守性,以N蛋白为基础建立的检测方法会产生一定的交叉反应[25];H蛋白在麻疹病毒属所有成员中最为多样化,种属特异性强,且可诱导保护性免疫反应,因此该蛋白在DIVA(区分疫苗免疫和自然感染动物)和免疫保护率检测上具有一定的优势。
准确地对PPR进行诊断和疫苗免疫效果检测有利于该病的预防控制,因此,本研究在PPRV H蛋白B细胞抗原表位筛选鉴定的基础上,选择与PPRV特异性抗体具有较好反应原性的B细胞抗原表位片段,然后将其串联后进行合成,以合成的多肽作为包被抗原,建立PPRV H蛋白抗体iELISA检测方法,对现有PPR检测方法进行补充,为该病的控制和消除提供技术手段。
1 材料与方法
1.1 病毒株、血清及主要试剂
PPRV Nigeria 75/1疫苗毒株、PPRV标准阴性和阳性血清、O型口蹄疫病毒(FMDV)标准阳性血清、羊痘病毒(GPV)阳性血清、羊临床血清样品由中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室制备保存;蓝舌病病毒(BTV)阳性血清由中国农业科学院兰州兽医研究所独军政博士惠赠。PPRV cELISA检测试剂盒购自法国ID-Vet公司;辣根过氧化物酶标记的兔抗羊IgG二抗购自SIGMA公司;TMB底物溶液购自Sumodics公司;BSA购自ExCell Bio公司;Silk-milk购自BD公司,酪蛋白(Casin)购自SIGMA公司。
1.2 H蛋白B细胞抗原表位多肽的设计合成
本实验室用IEDB、Immunomedicine Group以及BepiPred 3种生物信息学软件对H蛋白的B细胞抗原表位进行预测,共得到27条抗原表位肽并合成这些多肽,然后通过iELISA方法筛选鉴定,鉴定出了8个H蛋白具有反应原性的B细胞表位,具体见表1[26]。然后,选择其中反应原性最好的4个表位H123、H185、H362、H487,以GS作为接头进行串联,送上海强耀生物有限公司合成该肽段。

表1 PPRV H蛋白具反应原性的B细胞表位Table 1 B cell epitopes with reactionogenicity
1.3 PPRV H蛋白抗体检测iELISA方法的建立
1.3.1 iELISA方法 将合成的表位肽用包被液稀释后包被96孔酶标板,放于4 ℃过夜孵育;取出PBST洗板3~5次后甩干,加入含2%BSA的PBST于37 ℃封闭1 h;洗板后加入经稀释后的血清,置于37 ℃温箱中孵育1 h;PBST洗板3~5次后甩干,加入经稀释后的酶标二抗,置于37 ℃温箱中孵育1 h;PBST洗板3~5次后甩干,加入底物TMB,每孔100 μL, 置于37 ℃温箱中孵育15 min;取出酶标板,每孔加入100 μL 2 mol·L-1H2SO4终止反应;酶标仪读取OD450 nm值。每个做2个重复孔。
1.3.2 表位肽抗原最适包被量和血清稀释度的优化 将表位肽抗原按照3×10-5、2.5×10-5、2.0×10-5、1.5×10-5、1.0×10-5、0.5×10-5μg·mL-1的浓度以pH9.6的碳酸氢盐缓冲溶液为包被液包被96孔酶标板,每孔100 μL, 4 ℃过夜孵育。PPRV标准阴、阳性血清分别用PBST按照1∶25、1∶50、1∶100、1∶200稀释,每孔100 μL,酶标二抗用PBST按照说明书推荐稀释度1∶40 000稀释,底物为100 μL TMB溶液,终止液为100 μL 2 mol·L-1的H2SO4溶液,按照iELISA操作方法进行试验,读取OD450 nm值,选取P/N值较大的组合对应的抗原包被量及血清稀释度作为最佳抗原包被量和最佳血清稀释度。
1.3.3 酶标二抗稀释度及其稀释液的筛选和确定 在确定表位肽包被量及血清稀释度的基础上,保持底物及终止液不变,将酶标二抗按1∶40 000及1∶80 000进行稀释,稀释液分别用5% Silk-Milk-PBS、0.5%BSA-PBS、PBST进行稀释,按照iELISA操作方法进行试验,读取OD450 nm值,选择P/N值最大的数值对应的酶标二抗稀释度和稀释液种类作为最适稀释度及其稀释液。
1.3.4 包被液的筛选 在确定表位肽包被量、血清稀释度、酶标二抗稀释度及其稀释液的基础上,以pH7.3的PBS溶液、pH7.6的碳酸盐缓冲液以及pH9.6的碳酸氢盐缓冲液分别作为包被液包被表位肽抗原,保持其他条件不变,按照iELISA操作方法进行试验,读取OD450 nm值,选取P/N值最大的数值对应的包被液作为最佳包被液。
1.3.5 封闭液的筛选 在确定表位肽包被量、包被液、血清稀释度、酶标二抗稀释度及其稀释液的基础上,保持其他条件不变,以10%的酪蛋白(Casin)-PBS、5%Silk-Milk-PBS、2%BSA-PBS分别作为封闭液,其他条件不变,按照iELISA操作方法进行试验,读取OD450 nm值,选取P/N值最大的数值对应的封闭液作为最佳封闭液。
1.3.6 血清稀释液的筛选 在确定表位肽包被量、包被液、封闭液、血清稀释度、酶标二抗稀释度及其稀释液的基础上,以5%Milk-PBS、2%BSA-PBS及PBST作为血清稀释液,保持其他条件不变,按照iELISA操作方法进行试验,读取OD450 nm值,选取P/N值最大的数值对应的血清稀释液作为最佳血清稀释液。

1.4 重复性及特异性的测定

1.4.2 特异性试验 按照优化的iELISA操作方法,分别对PPRV标准阴、阳性血清、O型口蹄疫病毒标准阳性血清、羊痘病毒阳性血清及蓝舌病病毒阳性血清样品各3份进行检测,以此判断此方法的特异性。
1.5 灵敏度分析
用该方法对稀释后的血清进行检测,根据检测结果判定阳性血清最大稀释倍数,从而评价所建立的iELISA检测方法的灵敏度。
1.6 临床血清样本符合率检测
分别用建立的iELISA方法和ID-Vet公司PPRV cELISA检测试剂盒同时检测临床采集的306份羊血清样本,统计计算两种方法检测结果的符合率。
2 结 果
2.1 多表位肽抗原串联及合成
表位肽串联结果如表2所示,串联后送上海强耀生物有限公司进行合成,总量10 mg。合成肽产物经HPLC及MS分析,结果如图1A、B所示,显示串联后的表位肽成功合成,纯度为90.57%。
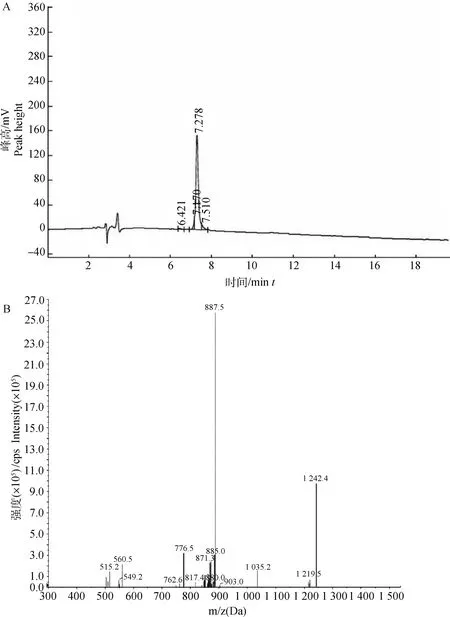
A. HPLC分析;B. MS分析A. HPLC analysis; B. MS analysis图1 合成多肽的HPLC、MS分析结果Fig.1 A HPLC and MS analysis report of synthetic multi-peptide

表2 H蛋白部分B细胞表位串联的表位肽序列Table 2 A part of Series connection B cell epitopes sequence of H protein
2.2 表位肽抗原最适包被量及血清稀释度的优化
以不同量表位肽抗原包被96孔酶标板,阴、阳性血清做1∶25、1∶50、1∶100、1∶200稀释,按iELISA操作方法进行多次方阵滴定试验,结果如图2,通过比较可知在表位肽包被量为1.5×10-6μg·孔-1、血清1∶100稀释时P/N值最高,因此确定1.5×10-6μg·孔-1为表位肽抗原最适包被量,1∶100为血清最佳工作浓度。

图2 最适抗原包被量和血清最佳稀释度的确定Fig.2 Determination of optimal amount of antigen coating and kind of serum dilution
2.3 酶标二抗稀释度及稀释液的筛选和确定
固定包被抗原量和血清稀释度,辣根过氧化物酶标记的兔抗羊IgG二抗筛选结果如图3A所示,表明1∶80 000为该酶标二抗的最佳稀释度;对酶标二抗稀释液筛选结果如图3B,则PBST为最佳酶标二抗稀释液。

A. 稀释浓度的确定;B. 稀释液的筛选A. Determination of antibody concentration; B. Determination of antibody diluent图3 酶标二抗稀释浓度、稀释液的筛选Fig.3 Determination of antibody concentration and antibody diluent of enzyme labeled secondary antibody
2.4 包被液、封闭液、血清稀释液的筛选
对3种包被液、3种封闭液和3种血清稀释液的筛选结果分别见图4~6,通过筛选可知:碳酸氢盐缓冲液为此方法最适包被液,2%BSA-PBS为最适封闭液,PBST溶液为最适血清稀释液。
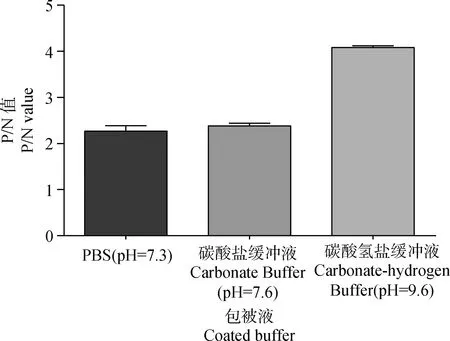
图4 包被液的筛选Fig.4 Determination of coated buffer

图5 封闭液的筛选Fig.5 Determination of blocking buffer

图6 血清稀释液的筛选Fig.6 Determination of serum dilution buffer
2.5 判定标准的确定


表3 237份PPRV阴性血清样本检测OD450 nm值统计结果Table 3 Detection results of 237 serum samples of PPRV negative
2.6 重复性分析结果
批内重复性试验如表4所示,结果显示所检测的4份血清同批次不同酶标板之间变异系数最大的为8.3%,最小的为3.47%,均小于10%,说明该方法具有良好的批内重复性;不同批次间重复性结果如表5所示,不同批次包被抗原检测的4份血清各批次之间的变异系数均小于10%,说明该方法不同批次之间具有良好的重复性。

表4 批内重复性检测结果Table 4 Results of batch repeatability detection
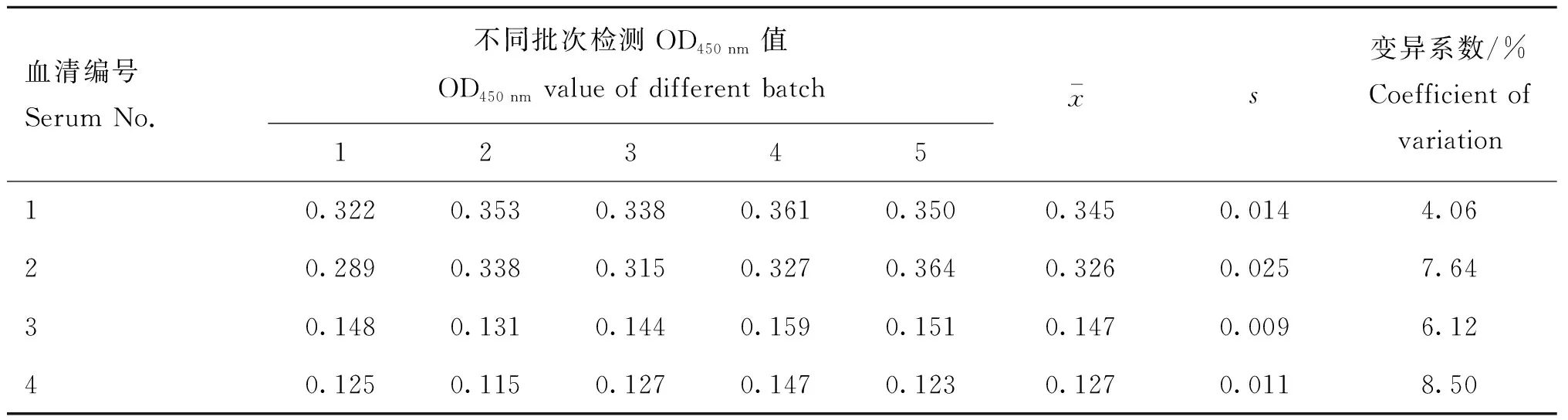
表5 批间重复性检测结果Table 5 Results of different batch repeatability detection
2.7 特异性分析
通过对PPRV标准阴性和阳性血清、O型口蹄疫病毒标准阳性血清、羊痘病毒阳性血清以及蓝舌病病毒阳性血清各3份进行检测,各种血清的OD450 nm平均值结果如图7所示,除3份PPRV阳性血清平均值为阳性外,其他血清平均值均为阴性,说明建立的iELISA检测方法与O型口蹄疫病毒、羊痘病毒和蓝舌病病毒的阳性血清均无交叉反应,具有良好的特异性。
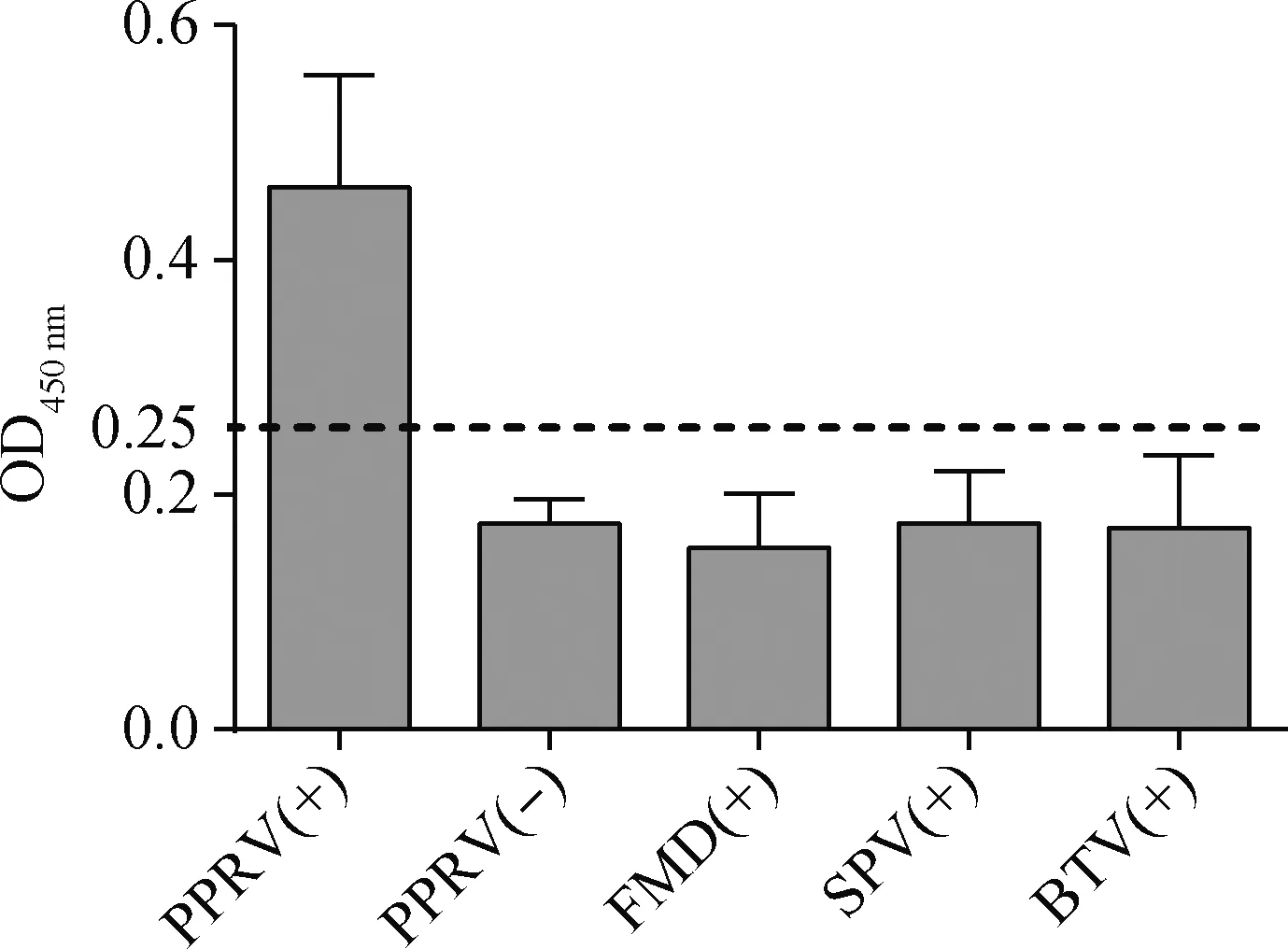
图7 特异性检测Fig.7 The results of specificity detection
2.8 灵敏度分析
用建立的iELISA检测方法对稀释后的PPRV阳性血清进行检测,结果显示,当阳性血清稀度为1∶200 时,OD450 nm值仍大于临界值0.25(图8),说明建立的iELISA检测方法具有较好的灵敏度。

图8 灵敏度检测Fig.8 Sensitivity detection
2.9 临床血清样本符合率检测
本研究建立的iELISA方法与ID-Vet公司的商品化PPRV cELISA检测试剂盒平行检测306份临床羊血清,检测结果统计如表6所示,cELISA检测阳性血清为69份,阴性血清237份;iELISA检测阳性51份,可疑17份,阴性238份,两者相对符合率为92.81%。

表6 相对符合率统计Table 6 Statistics of relative coincidence rate
3 讨 论
小反刍兽疫为一种急性、烈性的国家一类动物传染病,目前,尚无有效的治疗方法[27],这为该病的有效防控增加了难度,因此,建立快速准确的检测方法对该病的防控尤为重要。ELISA因其快速、灵敏等特点而被广泛应用于PPRV抗原和抗体的检测。
多抗原表位进行串联合成时在连接处插入柔性氨基酸进行连接,有利于促进蛋白酶水解的效率,提高抗原表位的递呈效率。在两个抗原表位之间以“GPGPG”作为连接位点可以避免形成新的表位片段[28];然而在抗原表位之间以“AAY”作为连接点则可在一定程度上提高抗原表位的切割效率[29]。甘氨酸和丝氨酸是所有氨基酸中最具柔性的氨基酸,在各个抗原表位之间插入柔性氨基酸进行连接,不仅能够避免在连接处形成新的抗原表位序列,而且能够保证不同抗原表位充分暴露。本研究采用甘氨酸(G)和丝氨酸(S)作为多表位抗原片段之间串联的连接位点,因此在各个B细胞抗原表位连接处加入了GS序列进行间隔。
以PPRV H蛋白中和单克隆抗体为基础的cELISA和阻断ELISA的检测方法也已经建立[31-32],且利用病毒H蛋白单克隆抗体建立的ELISA检测方法能够有效提高试验结果的准确性。研究显示,利用原核表达系统表达的PPRV H蛋白,作为抗原建立的iELISA检测方法与ID-Vet公司的商品化PPRV cELISA试剂盒相比符合率达到93.75%[33]。PPRV N蛋白454—472位氨基酸序列具有针对PPRV非常强的免疫原性,452—472氨基酸区域为其线性B细胞表位,PPRV能够被该区域产生的多肽抗体特异性识别,利用这一优势建立的检测方法可用于PPRV与RPV的鉴别诊断;以N蛋白为抗原建立的ELISA检测方法需依赖该蛋白特定抗原表位产生的单克隆抗体与被检样品中相应抗体之间的相互竞争,由于与N蛋白交叉反应的缺乏,在阴性对照中只能观察到45%的竞争率[34]。麻疹病毒H蛋白是细胞嗜性的主要决定因素,牛瘟病毒H蛋白是导致兔化弱毒株跨种致病的主要原因[35],这些研究表明H蛋白为麻疹病毒属病毒最重要的毒力蛋白。已有相应研究对PPRV H蛋白的功能域进行绘制,位于263—368位以及539—609位氨基酸位点的免疫显性表位最多[36-37],由于H蛋白在麻疹病毒属成员中是最为多样化的,所以以H蛋白作为靶标进行设计DIVA检测方法具有相当的优势。
本研究以筛选的PPRV H蛋白B细胞抗原表位为基础,将鉴定后反应原性较好的4段抗原表位串联后合成作为包被抗原建立针对H蛋白抗体的iELISA检测方法,通过对306份临床血清检测证实其与ID-Vet公司的商品化PPRV cELISA检测试剂盒相比符合率为92.81%,与羊痘、口蹄疫、蓝舌病病毒阳性血清无交叉反应,说明建立的检测方法具有较好的敏感性和特异性,可用于临床血清检测,具有开发相关检测试剂盒的可能性。
4 结 论
建立了针对PPRV H 蛋白抗体的iELISA检测方法,该方法特异敏感,与ID-Vet公司的商品化PPRV cELISA检测试剂盒相比符合率为92.81%,可用于临床血清样品检测。
