鸡蛋壳表面典型菌株的分离鉴定及其对全蛋液致腐能力分析
2021-03-01马艳秋王瑞红迟玉杰
弓 敏,马艳秋,王瑞红,迟 媛,迟玉杰
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
鸡蛋是自然界中营养成分最完善的动物性食品之一,富含蛋白质、脂质、矿物质、维生素等多种营养成分,是一种“全营养模式”的食品原料[1]。随着人们生活水平的提高,消费者对食品安全的意识日益强化,鸡蛋的质量安全问题同样引起消费者的重视,而鸡蛋从生产、加工到制备和食用过程中,微生物均会在不同阶段对鸡蛋造成污染。相关研究发现鸡蛋在母鸡卵巢中形成时就会发生微生物的跨卵巢或“垂直”传播,当其从母鸡泄殖腔排出后,粪便、垫草、羽毛等产蛋外环境,收购运输过程中装蛋容器及贮藏环境中的微生物均有可能穿过蛋壳进入鸡蛋内部,即发生微生物的“水平”传播污染[2-4],鸡蛋内容物营养丰富且水分活度较高,微生物一旦通过气孔进入其内部后,极易分解鸡蛋内的营养物质,使鸡蛋品质发生腐败变质。因此,对鸡蛋有效杀菌是保证鸡蛋质量安全的重要措施,目前对鸡蛋进行杀菌处理应用较为广泛的是对鸡蛋进行清洗消毒,同时利用低温冷藏技术[5-6]达到鸡蛋保鲜的目的,但是鸡蛋在贮藏过程或打蛋过程中仍受到某些特定腐败菌的影响,且这类特定腐败菌随着贮藏时间延长,其数量逐渐占据优势地位,加速蛋制品的劣变。
全蛋液是鸡蛋经过打蛋去壳制备得到的液蛋制品,蛋壳表面微生物在贮藏期间及打蛋过程中均会不同程度地进入到全蛋液制品中,造成全蛋液的腐败变质[7]。虽然鸡蛋壳、壳膜及蛋壳表面的角质层是阻止细菌渗透的有效屏障,但是蛋壳的破碎及壳表面成千上万的气孔为微生物的入侵提供了通道,使得鸡蛋壳表面的微生物极易污染鸡蛋内容物,此外,大量研究证明鸡蛋壳表面细菌渗透与全蛋液受污染之间(水平传播污染)存在一定的相关性[8-9],同时鸡蛋在贮藏过程中发生的呼吸作用也会增加鸡蛋内容物受污染程度[10],严重影响全蛋液品质与其食用安全性。
目前,研究发现温度仍然是影响全蛋液贮藏品质的关键因素,虽然低温条件下可一定程度延缓全蛋液的腐败变质,但是关于全蛋液贮藏过程中特定腐败菌的致腐能力及其变化规律还鲜有报道。本研究通过传统微生物的分离纯化技术结合16S rDNA分子技术,鉴定存在于鸡蛋壳表面的典型菌种,并将分离纯化得到的典型菌株接种到灭菌全蛋液样品中,系统地研究蛋壳表面典型菌株对全蛋液的腐败特性,旨在为全蛋液的腐败机理解析及鸡蛋的杀菌处理条件提供参考。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋 市售;PCA平板计数培养基 北京奥博星生物技术有限责任公司;TransTaqHiFi聚合酶链式反应(polymerase chain reaction,PCR)SuperMix I试剂盒、TaKaRa裂解缓冲液(代码D304) 全式金生物技术有限公司;无菌采样袋(12 cm×18 cm) 青岛高科技工业园海博生物技术有限责任公司;氯化钠、硼酸、盐酸(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
全相显微镜 广州蔚仪金相实验仪器有限公司;PowerPac Basic电泳仪、1000-Series PCR仪 美国Bio-Rad公司;BCM-1000无菌操作台 苏州江东精密仪器有限公司;DHP-9272电热恒温培养箱 上海齐欣科学仪器有限公司;TA-XT plus质构分析仪 英国Stable Micro System公司;YX-280压力蒸汽灭菌锅 河北中兴伟业实验仪器有限公司。
1.3 方法
1.3.1 菌落总数的测定及蛋壳表面典型菌株的分离纯化
取市售新鲜鸡蛋(蛋龄为3 d且肉眼无可见杂质)30 枚,分成3 组,每组10 枚鸡蛋,放入无菌袋内并加入500 mL无菌生理盐水,用手轻轻揉搓无菌袋,使蛋壳表面的微生物尽可能被洗下,将3 组鸡蛋擦洗液混合并进行10 倍递增稀释,参照GB 4789.2ü 2016《食品微生物学检验 菌落总数测定》中的倾注式平板菌落计数法测定蛋壳表面及蛋内容物中的菌落总数,并取适宜浓度的稀释液100 μL涂布于PCA平板计数表面,于37 ℃恒温培养箱内培养24~48 h。依据菌落形态、大小及颜色的不同挑取典型菌落进行划线培养,直至得到单一菌落并于4 ℃冰箱中保存备用。
1.3.1.1 菌落形态及细胞形态观察
将分离得到菌株进行划线培养,观察菌株形态特征,包括大小、形态、颜色、质地、边缘状态、隆起及透明度等,进一步通过全相显微镜观察菌体细胞形态,包括形态、大小及排列方式等。
1.3.1.2 菌株生理生化特性鉴定
将分离得到的5 株菌株进行生理生化实验,包括淀粉水解实验、明胶液化实验、过氧化氢酶实验、吲哚实验、甲基红实验及糖发酵实验,并参照相关文献[11-12]对菌株进行初步鉴定。
1.3.1.3 菌株的16S rDNA分子鉴定
1)DNA模板的制备及引物设计与合成
取适量菌体溶于Takara裂解缓冲液(代码D304)中变性后离心取上清液作为模板(模板DNA),反应条件为80 ℃,15 min。选取通用引物27F和1492R作为扩增引物,正反测序,扩增引物序列分别为27F:5’-AGAGTTTGATCCTGGCTCAG-3’,1492R:5’-GGTTACCTTGTTACGACTT-3’[13]。
2)扩增反应
使用高保真性的TransTaqHiFi PCR SuperMix I试剂盒,进行PCR扩增目的片段。阴性对照为灭菌水;阳性对照为已知菌株的16S rDNA。PCR扩增条件:94 ℃预热5 min;95 ℃变性10 s,55 ℃退火2 s,72 ℃延伸1.5 min,重复35 次;72 ℃延伸10 min。16S rRNA序列的PCR体系(50 μL)如表1所示。

表1 PCR扩增体系Table 1 PCR reaction system
3)扩增产物的检测与测序
通过琼脂糖凝胶电泳完成扩增产物的检测,DNA Marker为2 000 bp DNA Ladder,将扩增出的产物进行测序,由吉林省库美生物科技有限公司完成。
4)序列分析
通过电泳检测到完整的16S rRNA基因,将测序结果输入到NCBI网站GenBank中,利用BLAST功能组件将测得的基因序列与GenBank数据库中基因序列进行同源性比较。选取BLAST结果中得分较高菌的序列,使用MEGA5.2.1软件根据Neighbor-Joining法进行系统进化树的建立及分析。
1.3.2 全蛋液的制备
参照祖林林等[14]的方法并略有改动,采用75%乙醇溶液擦拭鸡蛋壳并将其置于紫外条件下进行灭菌15 min,在无菌操作台下进行打蛋去壳搅拌,过滤除去系带和蛋黄膜,分装于无菌容器中,制得全蛋液样品。
1.3.3 鸡蛋壳表面典型菌种在全蛋液中腐败特性的测定
将上述5 株菌制成浓度为105CFU/mL菌悬液,分别吸取1 mL菌悬液接种到100 mL的无菌全蛋液中,测定蛋壳表面典型菌株对全蛋液的致腐能力,致腐能力通过测定样品在4 ℃贮藏期间典型菌株的生长动力学曲线及样品挥发性盐基氮(total volatile basic nitrogen,TVB-N)值、pH值、质构特性及感官特性为评定依据,对照组为未接种菌株的全蛋液样品。
1.3.3.1 全蛋液中菌落总数的测定
将从蛋壳表面分离纯化得到的5 株典型菌株(大肠杆菌、枯草芽孢杆菌、考克氏菌及2 株蜡样芽孢杆菌)进行活化,采用平板倾倒计数法确定5 种菌悬液的浓度并将其浓度调整为105CFU/mL。吸取1 mL菌悬液接种到100 mL全蛋液中并搅拌均匀,于4 ℃贮藏30 h。参照GB 4789.2ü 2016倾注式平板菌落计数法,每6 h测定1 次全蛋液样品中菌落总数。
1.3.3.2 TVB-N值测定参照GB 5009.228ü 2016《食品中挥发性盐基氮的测定》中的全自动凯氏定氮仪法进行测定。
1.3.3.3 pH值的测定
采用pH计测定贮藏过程中全蛋液酸度值的变化。
1.3.3.4 全蛋液凝胶性质的测定
凝胶的制备及测定参照王轶男等[15]的方法,取全蛋液20 mL放于25 mL的烧杯中,用保鲜膜封口,并用橡皮筋扎紧,置于90 ℃水浴中加热15 min,取出后立即放入冰水中冷却15 min,4 ℃保存24 h,恢复到室温后测定凝胶硬度,测定条件:采用P/0.5探头,测试前速率5.0 mm/s,测试速率2.0 mm/s,测试后速率5.0 mm/s,测试距离为20 mm,触发力为5 g。
1.3.3.5 全蛋液凝胶持水力的测定
参考Kocher等[16]的方法,称取一定量的凝胶W1,切割成大小均一的块状(5 mm×5 mm×5 mm),5 000 r/min离心15 min,取出离心管内的凝胶,用滤纸吸干凝胶表面水分后称量凝胶质量W2。持水性计算见下式:
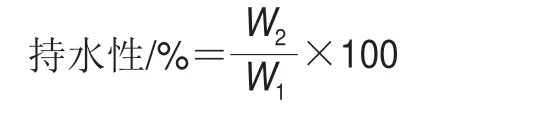
1.3.3.6 全蛋液感官品质的测定
对接种全蛋液样品贮藏过程中的感官特性进行观察描述,包括色泽、气味及组织状态。
1.4 数据处理及分析
应用SPSS Statistics 19.0软件对实验数据进行方差分析,采用Pearson方法进行鸡蛋品质参数及全蛋液中菌落总数与鸡蛋壳表面菌落总数的相关性分析,并使用MEGA5.2.1软件根据Neighbor-Joining法对鸡蛋壳表面主要微生物进行系统进化树分析,采用Origin Pro 8.6软件作图。
2 结果与分析
2.1 鸡蛋壳表面菌落总数与全蛋液货架期的相关性分析
分别取贮藏0、7、15、20、25、30 d的鸡蛋,编号为I~VI组,将6 组鸡蛋进行打蛋、均质、热处理(63.5 ℃,3.5 min)制得全蛋液并于4 ℃条件下贮藏,通过测定全蛋液贮藏过程中菌落总数,分析全蛋液货架期与鸡蛋壳表面菌落总数的相关性,结果如图1、2所示。
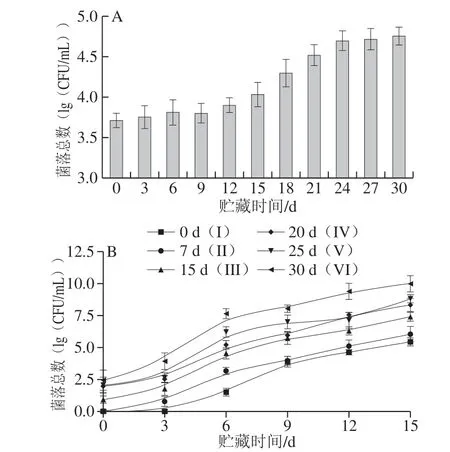
图1 鸡蛋壳表面(A)及全蛋液(B)中菌落总数Fig.1 Growth rates of total number of bacterial colonies on eggshell (A) and in liquid whole egg (B)

图2 全蛋液中菌落总数生长情况与鸡蛋壳表面菌落总数的相关性Fig.2 Correlation between growth rate of total number of bacterial colonies in liquid whole egg and that on eggshell surface
由图1可知,鸡蛋壳表面及全蛋液中菌落总数随贮藏时间延长呈现逐渐增加的趋势,且蛋壳表面菌落总数不同,打蛋制得的全蛋液样品的货架期显著不同,表现为III~VI组的全蛋液货架期明显短于I组和II组。I组制得的全蛋液于4 ℃条件下贮藏8 d,菌落总数达4.61(lg(CFU/mL)),符合GB 2749ü 2015《蛋制品卫生标准》中对全蛋液蛋制品的卫生要求,但当全蛋液贮藏时间为10 d时,其菌落总数达5.45(lg(CFU/mL)),超过国标要求,而II~VI组制得的全蛋液样品于4 ℃条件下贮藏8 d时,菌落总数均已超过全蛋液制品卫生要求。Ayres等[17]研究发现全蛋液在9、2 ℃贮藏条件下分别于5、12 d时,其样品中菌落总数均超过国家卫生标准,与本实验结果略有差异,可能原因是贮藏温度、蛋源及全蛋液热处理参数不同导致的结果差异。
由图2相关性分析表明,蛋壳表面菌落总数越多,全蛋液受污染程度越高,全蛋液货架期越短,由此可见鸡蛋壳表面微生物数量是影响全蛋液货架期的主要因素。相关研究指出新鲜鸡蛋壳表面具有一层生物保护膜,具有封闭气孔和一定的抑菌作用,但随贮藏时间延长,外层生物保护膜自行脱落,失去了抑菌性及对气孔的密封性,使蛋壳表面微生物易渗透到蛋内容物中,在高营养高水分的环境下微生物得到迅速生长繁殖,使得全蛋液的初始微生物数量增加[17];其次在全蛋液制备过程中,尤其是打蛋环节,蛋壳表面微生物极易侵染到蛋液中,最终影响全蛋液的货架期[18-19]。因此,鸡蛋壳表面微生物是全蛋液制品中微生物的主要来源,为了进一步确定蛋壳表面微生物的种类及特性对全蛋液贮藏品质的影响,对鸡蛋壳表面典型菌株进行分离鉴定并探究菌株的腐败特性。
2.2 鸡蛋壳表面典型菌株的分离鉴定
2.2.1 典型菌株的形态学鉴定
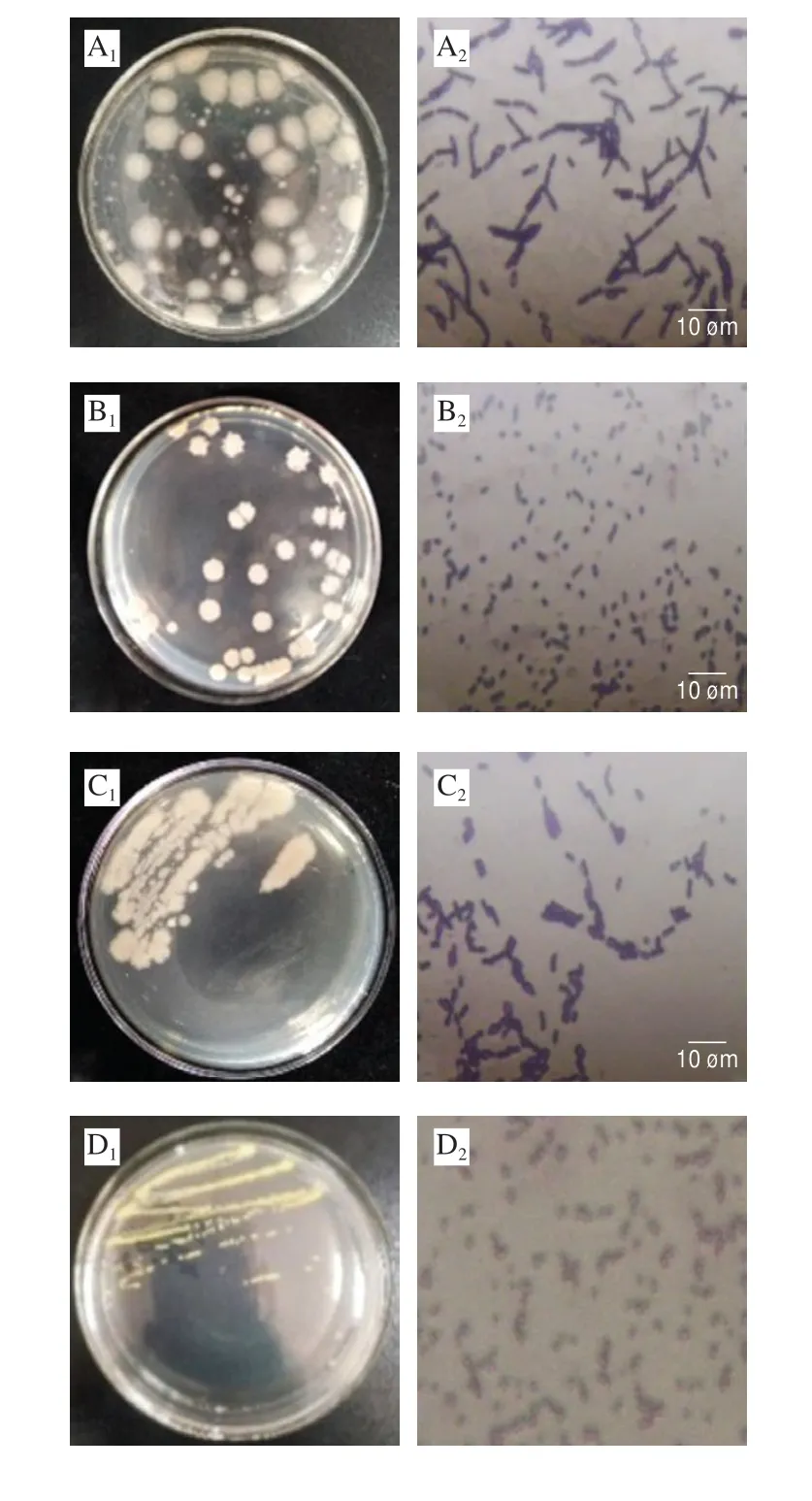

图3 5 株菌的菌落特征及细胞形态Fig.3 Colonies and cell morphology of five isolated bacterial strains
由图3可知,5 株细菌在营养琼脂平板上形态各异,A菌呈白色、表面扁平黏稠且边缘不规则的大菌落特征,显微结构显示为革兰氏阳性,菌体呈短状直杆状且俩端钝圆,内部具有芽孢结构,呈单个或短链状排列;B菌为白色、表面干燥且多褶皱多隆起、边缘呈裂叶状,革兰氏染色呈阳性,且形态为梭状,中间有芽孢结构,呈分散排列;C菌呈现透明乳白色、表面扁平黏稠且边缘不规则的大菌落特征,显微结构为革兰氏阳性,短状直杆菌,呈单个或链状排列;D菌呈现黄色、表面凸起、光滑圆润的菌落特征,革兰氏染色呈阳性,且具有金属光泽,呈现单球菌/四联球菌的排列方式;E菌表现为圆形低凸、光滑、湿润、半透明、灰白色菌落特征,革兰氏染色呈阴性,菌体为两端钝圆的短粗杆状,单个排列方式。Moats[20]和Reu等[21]研究发现,鸡蛋壳表面微生物菌系主要以革兰氏阳性菌居多。
2.2.2 典型菌株的生理生化实验结果
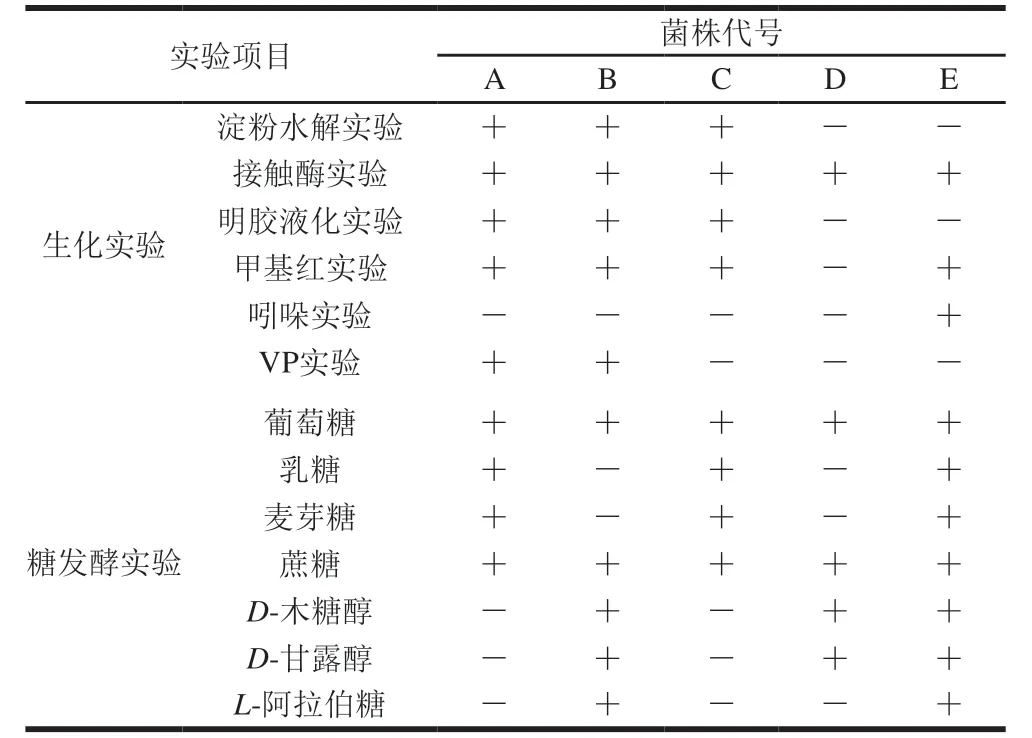
表2 菌株生理生化特征Table 2 Physiological and biochemical characteristics of the strains
生理生化实验可以反映菌种的代谢特点,由表2可以看出,A菌和C菌的生理生化鉴定结果基本一致,可以初步判断其为同一菌属,且从生化结果可初步判定A、B、C为芽孢杆菌。D菌的淀粉水解实验、明胶液化实验、甲基红实验、吲哚实验、VP实验均为阴性,不能利用乳糖、麦芽糖、L-阿拉伯糖产酸产气,其生理生化特性与《伯杰细菌鉴定手册》[11]中微球菌属一致。E菌依据上述糖发酵实验,发现可利用大部分糖且甲基红实验、吲哚实验等呈阳性,同时可利用乳糖产酸产气,依据微生物手册,可初步判定E菌为肠杆菌属。
2.2.3 5 株菌16S rDNA PCR扩增结果
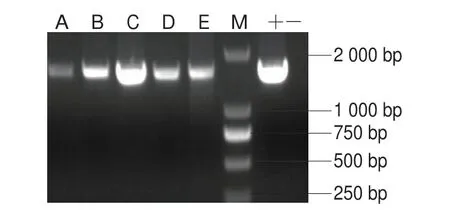
图4 5 株细菌16S rDNA基因序列PCR扩增电泳检测图谱Fig.4 Electrophoresis of PCR-amplified 16S rRNA sequence from five isolated bacterial strains
如图4所示,以提取的5 株细菌的DNA为模板,27f和1492r为引物,进行16S rDNA PCR扩增,扩增后得到的产物经琼脂糖凝胶电泳分析,5 株菌在1 500 bp处出现单一清晰的荧光条带且无拖尾现象,满足实验需求,通过对目的片段进行琼脂糖凝胶回收,以备后续测序使用。
2.2.4 5 株菌16S rDNA基因序列同源性比对与系统发育分析
将菌株A~E的基因序列与GenBank内已知菌株的相应序列进行比对,选取BLAST结果中得分较高菌的16S rDNA序列,使用MEGA5.2.1软件根据Neighbor-Joining进行系统进化树分析,结果如图5所示。
根据供试细菌16S rDNA序列构建的系统发育树可以看出,分离得到菌株A、B、C与芽孢杆菌属(Bacillus)遗传距离最近,均属于芽孢杆菌属,其中菌株A、C与菌株B.cereus相似度最高,达100%,B菌与B.subtilis相似度最高,达100%,因此A、C菌鉴定为蜡样芽孢杆菌,B菌鉴定为枯草芽孢杆菌。而芽孢杆菌属已被证实为多种食品中常见的食品腐败菌,其中蜡样芽孢杆菌产生呕吐毒素和多种肠毒素,引发呕吐和腹泻型食物中毒,常存在于原料乳、肉类、禽蛋类食品中[22],枯草芽孢杆菌可分解食品中蛋白质、糖类等营养物质,造成食品的风味和口感发生不期望的变化,从而引起食品的腐败变质[23]。从图5 可以看出,菌株D 与考克氏菌属(Kocuria)遗传距离最近,属于考克氏菌属,且D菌与K.marina相似度最高,达100%,因此,鉴定D菌为考克氏菌。刘梅等[24]从冰鲜鸡制品中同样分离纯化出了能够分解蛋白质产生生物胺的考克氏菌。E菌与大肠杆菌科的2 个菌属埃希氏菌(Escherichia)和志贺氏菌(Shigella)的遗传距离较近,与菌种E.fergusonii和S.flexneri相似度均达100%,综合E菌生理生化实验,如E菌可分解乳糖产酸产气而志贺氏菌属不分解乳糖可知E菌为大肠埃希氏菌种(E.fergusonii)。因此,依据菌种的菌落形态差异本实验从鸡蛋壳表面分离鉴定得到了5 株典型菌种,分别为:大肠埃希氏菌(E)、枯草芽孢杆菌(B)、考克氏菌(D)及2 株蜡样芽孢杆菌(A、C)。鸡蛋内容物营养丰富且水分活度较高,微生物一旦通过气孔或者在打单过程中进入蛋液后,极易分解其中的营养物质,使其品质发生变化[25]。因此,将蛋壳表面分离得到的典型菌株接种到全蛋液中并进行了致腐能力测定分析。
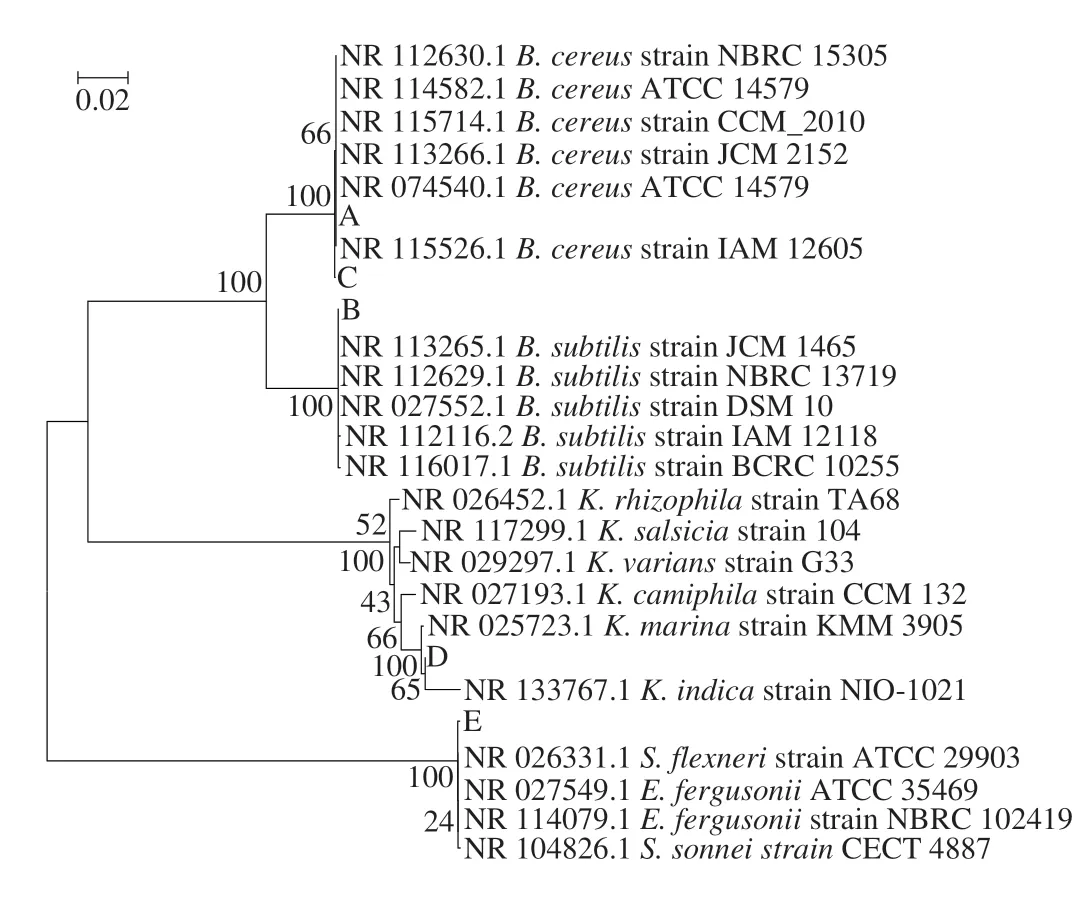
图5 以16S rDNA基因序列为分子标记的5 株细菌系统发育进化树Fig.5 Phylogenetic tree of five isolated bacterial strains based on their 16S rDNA sequences
2.3 鸡蛋壳表面典型菌株在全蛋液中的腐败特性
2.3.1 典型菌株对全蛋液菌落总数的影响
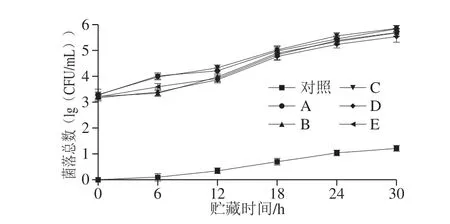
图6 典型菌株对全蛋液菌落总数的影响Fig.6 Change in total bacterial count during storage of liquid whole egg inoculated with each typical strain
由图6所示,贮藏至第18小时,A、B、C、D、E组的菌落总数均已超过GB 2749ü 2015《蛋与蛋制品》中安全限量所规定的最低限量值4.70(lg(CFU/mL)),而对照组在贮藏至第30小时仍未超过限量值。在贮藏6 h后实验组全蛋液中的菌落总数便开始迅速增加,其中A、C组显著高于其他实验组的生长速率,当贮藏至第30小时,全蛋液中的菌落总数从高到低分别为C、A、E、B、D,分别达到5.83、5.8、5.69、5.679、5.53(lg(CFU/mL)),远高于对照组1.21(lg(CFU/mL))。
2.3.2 贮藏期间全蛋液TVB-N值及酸度值的变化
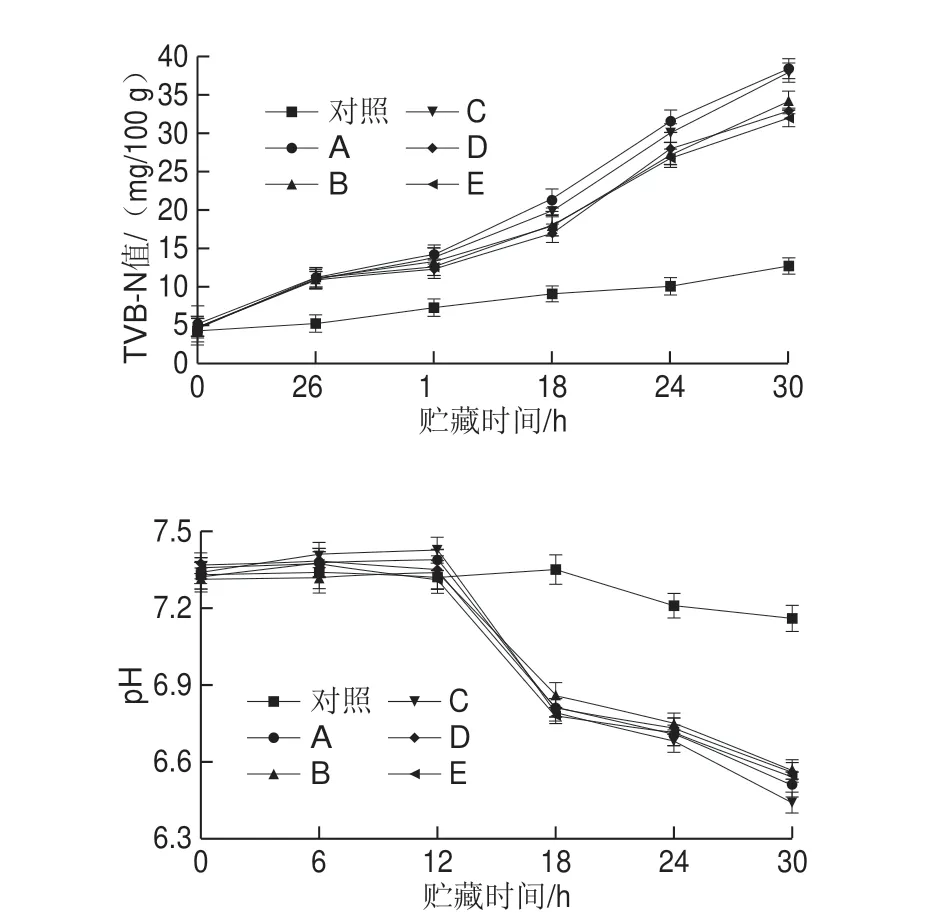
图7 全蛋液贮藏期间TVB-N值及pH值的变化Fig.7 Changes in TVB-N and pH value in liquid whole egg during storage
全蛋液在贮藏期间,蛋白质在酶与微生物作用下不断分解,产生具有挥发性的氨、胺类等碱性含氮物质[26],导致TVB-N值含量升高,因此TVB-N值可用于反映全蛋液贮藏期间的蛋白质被分解程度。此外,全蛋液贮藏过程中,酸度值同样是反映全蛋液制品劣变的重要指标[27]。由图7可知,接菌的全蛋液样品在贮藏过程中,随贮藏时间的延长TVB-N值逐渐增加,酸度值随贮藏时间延长呈现先缓慢增加后急剧下降的趋势。贮藏0~6 h期间,实验组中挥发性盐基氮缓慢增长,而在第12小时,接种菌种的全蛋液样品中挥发性盐基氮的含量变化幅度较大,尤其A、C组增长速度较快,在贮藏第24小时后,TVB-N值分别达(31.67f 1.311)、(30.07f 1.318)mg/100 g,均已超过国标中的限量值30 mg/100 g。经过30 h贮藏,实验组全蛋液样品中挥发性盐基氮的含量由高到低分别为C、A、B、D、E。全蛋液的酸度值随贮藏时间延长呈现缓慢上升后急剧下降的趋势,可能原因是全蛋液中蛋白质在内源蛋白酶及微生物分泌的蛋白分解酶的作用下降解为多肽、氨基酸等碱性基团,导致pH值上升,虽然后期全蛋液中TVB-N值逐渐增加,但是随着贮藏时间延长,蛋液中复杂氮和碳源分解,从而使全蛋液中营养基质适合并支持细菌生长,尤其芽孢菌属可利用多数糖类产酸产气,此外,全蛋液中脂质在贮藏过程中发生水解产生脂肪酸,致使后期全蛋液中pH值在贮藏后期骤降[28]。
2.3.3 贮藏期间全蛋液凝胶性质的变化
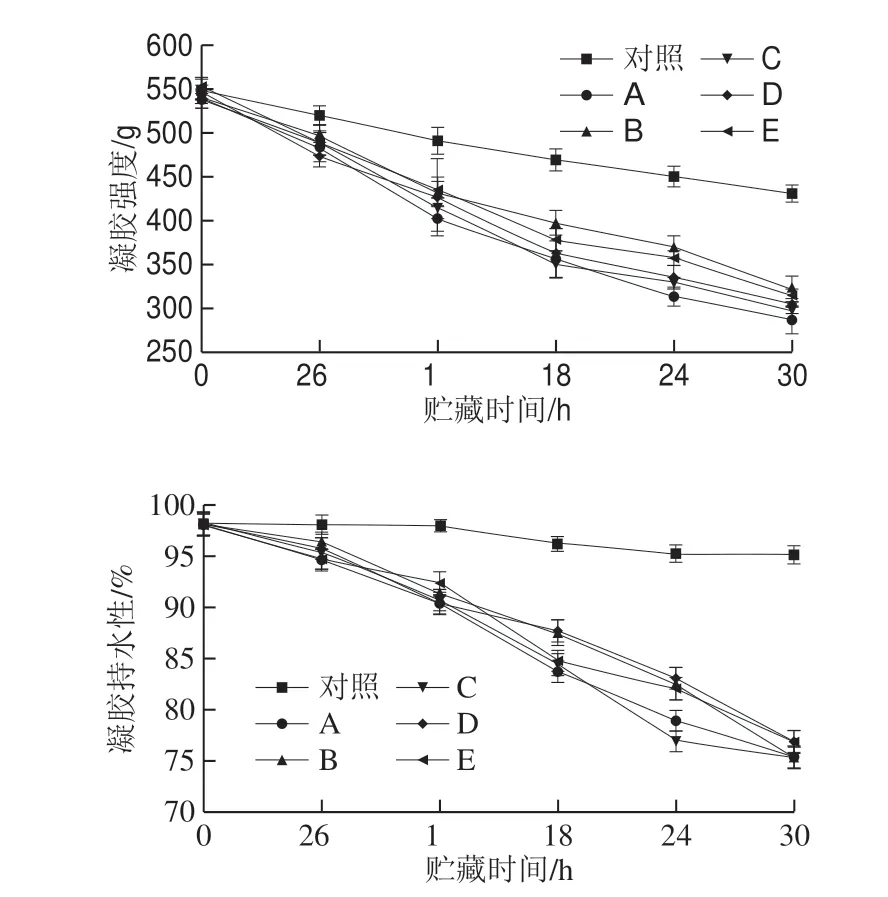
图8 全蛋液贮藏期间凝胶性质的变化Fig.8 Changes in gel properties of liquid whole egg during storage
全蛋液的凝胶硬度及凝胶持水性是评价全蛋液功能性质的重要指标[29],由图8可知,未接种的全蛋液的功能性质在贮藏30 h期间没有显著变化,而接种菌株的全蛋液在贮藏过程中呈现逐渐下降的趋势,尤其A、C菌株对全蛋液的凝胶硬度及凝胶持水性的影响较大,在贮藏30 h后,接种A、C菌株的全蛋液样品的凝胶强度下降了46.29%~46.94%,凝胶持水性下降了23.11%~23.54%。可能原因是微生物将全蛋液中的蛋白质分解成低分子的铵类物质,破坏了蛋白质内部的二硫键的形成[30],尤其蜡样芽孢杆菌在生长代谢过程中能够产生蛋白酶、淀粉酶、脂肪酶及纤维酶等,破坏了全蛋液中蛋白质的交联作用,此外,蜡样芽孢杆菌在生长代谢过程中会产生有机酸降低体系pH值,在较低pH值的条件下同样会降低全蛋液的凝胶强度,进而降低凝胶的持水性[31-32]。
2.3.4 贮藏期间全蛋液感官品质的变化
由表3可知,未接种菌株的全蛋液样品在贮藏30 h后,全蛋液仍然呈现均匀的乳浊液,具有正常蛋液的气味,颜色较新鲜蛋液样品较暗。接种A、B、C、D、E组的全蛋液样品均呈现出腐败变质现象,其中A、C组样品变质情况严重,颜色变成亮黄,全蛋液已经失去原有的液体状态,呈现细腻均一的膏状;接种B、D、E组的全蛋液样品呈现严重的分层现象,上层蛋液呈现深黄,下层为膏状固体。结合贮藏期间全蛋液的TVB-N值、菌落总数的生长曲线及全蛋液功能性质的变化,可知从鸡蛋壳表面分离纯化得到的5 株主要微生物菌种中,致腐能力最强的为芽孢杆菌属(菌株A、C),其次为大肠杆菌(菌株E)、枯草芽孢杆菌(菌株B)及考克氏菌(菌株D)。

表3 典型菌株对全蛋液感官品质的影响Table 3 Effect of inoculation with typical spoilage bacteria on sensory quality of liquid whole egg after storage for 30 h
3 结 论
通过研究鸡蛋在贮藏期间蛋壳表面菌落总数及全蛋液货架期随贮藏时间变化趋势,并建立二者之间的相关性,发现鸡蛋壳表面微生物菌群是影响全蛋液货架期的主要因素,鸡蛋贮藏时间越久打蛋制得的全蛋液货架期越短。且从蛋壳表面分离纯化得到的5 株典型菌株,并接种到全蛋液样品中,分析贮藏期间各典型菌株的生长动力学曲线及全蛋液贮藏品质变化趋势,确定了鸡蛋壳表面5 株典型菌株腐败能力最强的为蜡样芽孢杆菌属(B.cereus)A、C,其次为大肠杆菌(E.coli)E、枯草芽孢杆菌(B.subtilis)B及考克氏菌(K.marina)D。以上研究结果可为鸡蛋杀菌工艺及全蛋液制品的防腐提供理论参考。
