曲霉型豆豉发酵阶段细菌群落的演替及其与环境因子的关系
2021-03-01赵文鹏杨慧林王筱兰
赵文鹏,李 浩,杨慧林,王筱兰
(江西师范大学生命科学学院,江西 南昌 330022)
豆豉作为一种我国特有的传统发酵调味品,通过微生物发酵,较好地保留了大豆原有的营养,也衍生出一定的药用价值,并赋予豆豉独特的风味[1]。豆豉大体可分为霉菌型及细菌型两类,其中霉菌型豆豉的发酵过程分为制曲及(后)发酵两阶段,依据制曲过程的优势微生物划为毛霉型、曲霉型和根霉型[2]。我国南方常见的曲霉型豆豉的传统发酵工艺往往以开放式制曲及长时间后发酵为主要特点,整体上属于半开放式发酵过程,由此造成在不同地域环境下即使采用同样的原料及工艺,豆豉微生物群落结构也不完全相同,进一步体现为豆豉风味及营养的差异。显然,若在明确豆豉发酵中核心微生物群的同时,能将理化因子对核心微生物的影响予以量化,将更有助于理解豆豉发酵过程微生物的演替规律,也可为豆豉品质的定向调控提供一定的理论支撑。
近年来测序技术快速发展,以16S rRNA高通量测序[3]和宏基因组测序[4]为代表的研究策略已较为成熟,其在发酵食品领域主要用于分析发酵食品生产过程中微生物菌群结构动态变化规律以及核心功能微生物[5-6],如白酒[7-8]、泡菜[9-10]、豆豉[11-12]、食醋[13-14]和酱油[15]等。以往豆豉中的微生物多样性研究主要关注不同产地豆豉微生物结构差异的比较,少数研究则阐明了同种豆豉不同阶段微生物多样性的演替,如石聪等[16]利用454测序技术对浏阳豆豉3阶段的真菌及细菌分布特点进行了报道,本实验室也利用Illumina MiSeq平台对曲霉型豆豉9 个阶段的微生物菌群演替进行了探究,发现相较于制曲阶段的微生物多样性单一,发酵阶段细菌多样性变化显著[12]。不难发现,目前曲霉型豆豉的研究热点在于利用高通量测序技术挖掘与豆豉品质密切相关微生物资源,解析发酵过程中曲霉型豆豉微生物群落动态变化,但针对发酵理化因子与曲霉型豆豉微生物群落演变关联性研究鲜有报道,与此同时,已有研究者依托高通量测序技术对某些发酵食品微生物群落演变的关联性进行了报道[17]。
为此,本研究通过采集发酵阶段不同时期的曲霉型豆豉,基于高通量测序技术对豆豉不同发酵阶段的细菌群落组成和变化趋势进行系统比较,并结合发酵环境的理化因子进行相关性分析,以阐明发酵环境与豆豉发酵阶段细菌群落演替的内在联系,从而为后续优化曲霉型豆豉的发酵工艺提供理论支持。
1 材料与方法
1.1 材料与试剂
曲霉型豆豉于南昌稻香园调味食品有限公司采集。以黑豆为原料蒸煮1 h后,其工艺主要包括室温制曲(米曲霉沪酿3.042,接种量0.001 5%(质量分数))7 d、人工控温发酵(堆积自然接种1 d,拌6%(质量分数)盐于发酵池发酵)3~4 周两个过程,中间含洗曲步骤。本研究样品均为洗曲后不同发酵阶段的豆豉。采样时,于发酵池3 个区域分层取样,同一区域样品充分混合后装入已灭菌的自封袋,并做好标记。分别在发酵第0、1、5、9、13、19天取样(编号:Day0、Day1、Day5、Day9、Day13、Day19),每个发酵阶段含3 个样品,样品采集完毕保存于冰盒并立即带回实验室后,部分存于-80 ℃冰箱备用。
Soil DNA Kit与Gel Extraction Kit 美国Omega公司;其他常规生化试剂均为国产分析纯。
1.2 仪器与设备
梯度聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像仪 美国Bio-Rad公司;MiSeq测序仪美国Illumina公司;NanoDrop ND-2000超微量分光光度计美国Thermo Scientific公司;台式高速离心机 生工生物工程(上海)股份有限公司;电泳仪 北京市六一仪器厂;pH计 德国Sartorius公司。
1.3 方法
1.3.1 理化因子测定
1.3.1.1 温度测定
将温度计置于发酵池内部测量,待温度稳定后读数,多次测量发酵池的温度,结果以平均值表示。
1.3.1.2 含水量测定
采用常压恒重干燥法测定豆豉水分含量。取多个干净铝制称量瓶,放入电热恒温鼓风干燥箱中,于100 ℃干燥1 h后取出冷却后称量,重复此操作至前后两次称量的差值不超过2 mg为质量恒定。称取刚取回的豆豉样品,放入质量恒定的铝制瓶中,称质量并记录,于100 ℃加热干燥2 h,冷却后取出称量,重复称量至质量恒定。结果以平均值表示,实验重复3 次。设质量恒定称量瓶的质量为M1,样品与质量恒定称量瓶的质量为M2,干燥质量恒定的样品与称量瓶的质量为M3,含水量按下式计算:
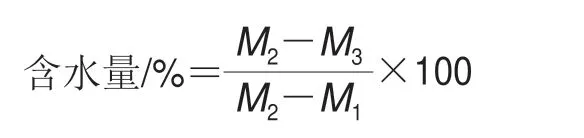
1.3.1.3 pH值测定
取3 份50 mL蒸馏水,用pH仪测定其pH值,调整测定差值不超过0.02,此为空白对照组。取豆豉样品各2.0 g左右,破碎后加入空白组蒸馏水,搅拌均匀(30 min),静置测定豆豉悬浮液的pH值。实验重复3 次。
1.3.1.4 总酸含量测定
采用NaOH滴定法。称取冷冻干燥豆豉样品各2.5 g,粉碎后放入100 mL烧杯中,加入纯水充分搅拌30 min,定容到100 mL。取悬浮液于10 000 r/min离心10 min,收集上清液;吸取20 mL上清液,置于100 mL干净三角瓶中,滴加2 滴酚酞试剂,开动磁力搅拌器,用NaOH标准溶液滴定至酚酞变色,并在30 s内不变色时停止。记录标准溶液的消耗体积,计算总酸含量。
1.3.1.5 总醇含量测定
称取冷藏的豆豉样品100.0 g,研碎后加入纯水充分搅拌30 min,后定容到50 mL,取悬浮液10 mL于10 000 r/min离心10 min,收集上清液;取上清液1 mL于试管中,加入2 mL重铬酸钾溶液,再加纯水至10 mL,混合均匀后沸水浴10 min,取出冷却至室温;于610 nm波长处测定吸光度,计算总醇含量。乙醇标准曲线的制作参考文献[18]。
1.3.1.6 还原糖含量测定
称取冷藏豆豉样品各10.0 g左右,研碎后加入纯水充分搅拌30 min,后定容至100 mL,取悬浮液10 mL于10 000 r/min离心10 min,收集上清液;取上清液1 mL置于25 mL试管中,补水至2 mL,加1.5 mL 3,5-二硝基水杨酸溶液,摇匀后于沸水浴加热5 min,取出冷却至室温,用纯水稀释至25 mL,于540 nm波长处测定吸光度,计算还原糖含量。葡萄糖标准曲线的制作参考相关文献[19]。
1.3.2 豆豉样品宏基因的提取及PCR扩增
称取豆豉样品各1.00 g,用pH 7.0磷酸盐缓冲液将豆豉振荡洗涤3 次,将洗脱液用双层纱布(已灭菌)过滤。将滤液于4 ℃离心后弃上清液,完成豆豉中微生物的收集。按照提取试剂盒说明书操作,完成豆豉微生物宏基因的提取。提取完毕,利用0.8%琼脂糖凝胶电泳及超微量分光光度计评估宏基因的完整性、浓度及污染程度。
将检测合格的宏基因样品作为底物,采用添加标签的338F(5’-ACTCCTACGGGAGGCAGCAG-3’)及806R(5’-GACTACHVGGGTWTCTAAT-3’)引物对细菌16S rRNA的V3-V4保守区域进行扩增,PCR扩增的具体参数参考相关文献[12]。将PCR扩增产物切胶回收,利用超微量分光光度计统一各样品的DNA总量,最后将处理好的DNA样品送至天津诺禾致源生物信息科技有限公司Illumina MiSeq平台进行测序。
1.3.3 高通量测序数据的分析处理
经原始数据进行拼接(FLASH,version 1.2.11),质量过滤(Trimmomatic,version 0.33),去除嵌合体(UCHIME,version 8.1),得到高质量的Tags序列。Trimmomatic软件质控,使用FLASH软件进行拼接,然后用Usearch(vsesion 7.0)软件和 UCHIME 软件过滤,剔除嵌合体得到Effective tags,根据97%的相似度对序列进行操作分类单元(operational taxonomic units,OTU)聚类。在相似性97%的水平上对序列进行聚类(USEARCH,version10.0),以测序所有序列数的0.005%作为阈值过滤OTU。序列经由RDP Classifier置信度阈值为0.8(version 2.2 Silva数据库)进行比对后物种分类注释,比较分析样品中微生物群落结构及组成[20]。利用MOTHUR软件计算Chao 1和Shannon指数。使用R软件(Version 2.15.3)绘制UPGMA聚类树。采用CANOCO 4.5软件对细菌群落结构差异性进行主成分分析(principal component analysis,PCA),细菌群落与理化因子间的相互关系进行冗余分析(redundancy analysis,RDA)。
1.4 数据提交
本研究涉及的高通量测序的原始序列信息已提交至NCBI(National Center for Biotechnology Information)网站SRA(Sequence Read Archive)数据库。项目检索号:SRP219928;18 个样品检索号:SRR10046494~SRR10046511。
2 结果与分析
2.1 曲霉型豆豉宏基因提取
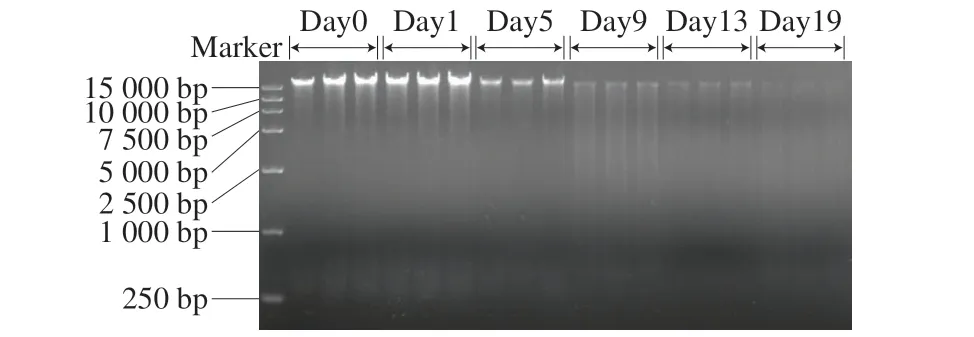
图1 不同发酵时间曲霉型豆豉的宏基因琼脂糖凝胶电泳图谱Fig.1 Agarose gel electrophoresis of bacterial metagenomics DNA from Aspergillus-type Douchi at various fermentation stages
经琼脂糖凝胶电泳检测发现,各发酵阶段的宏基因主条带大小在15 kb左右(图1)。其中,发酵第0天、第1天的宏基因组条带完整性较好且明亮,说明此时微生物丰度相对较高;发酵第5天基因组条带亮度骤降,在发酵第9~19天时,基因组条带亮度继续下降至几乎消失,且拖尾严重。由此反映曲霉型豆豉发酵是微生物量减少的过程。
2.2 曲霉型豆豉理化因子演替规律
总醇、水分、总酸、还原糖含量和温度是曲霉型豆豉发酵过程中的重要理化因子,发酵过程整体上可划分为3 个阶段:发酵前期(Day0与Day1)、发酵中期(Day5与Day9)和发酵后期(Day13与Day19)。发酵过程中主要理化因子变化程度普遍较大(表1),其中总醇含量由0.99 mg/g缓慢下降至0.78 mg/g;还原糖含量则是由30.10 mg/g下降至12.90 mg/g;总酸含量由5.75 mg/g上升至16.75 mg/g;含水量则由45.59%下降至36.15%;相应的pH值由5.52下降至4.49最终稳定在5.12;温度波动较大,具体表现为中期最高,其中Day5是发酵过程中的最高温度(45.6 ℃)。总体上豆豉的水分、总醇含量、pH值和还原糖含量呈下降趋势,总酸含量一直上升,温度则是先升后降的趋势。

表1 曲霉型豆豉发酵过程中豆豉理化因子变化Table 1 Variations in physicochemical properties duringAspergillus-type Douchi fermentation
2.3 曲霉型豆豉细菌α多样性
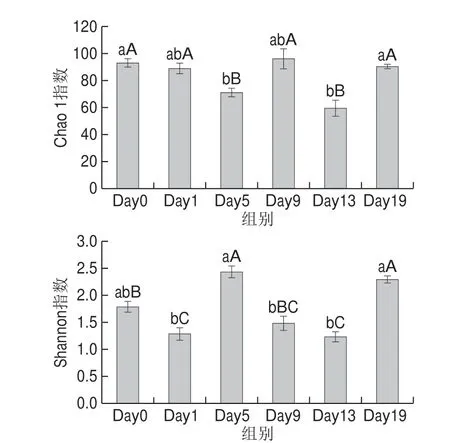
图2 曲霉型豆豉发酵过程中细菌群落α多样性变化Fig.2 Variation in alpha diversity of bacterial communities duringAspergillus-type Douchi fermentation
Chao 1指数和Shannon指数分别体现微生物群落的物种多样性和物种分布的均匀度。具体来看,豆豉细菌群落的Chao 1指数由93.27下降到70.82,又上升至95.65随后下降至59.07,最终稳定在90.25;Shannon指数则由1.79上升到2.44,又下降至1.23,最终稳定在2.30(图2)。这说明在豆豉发酵过程中细菌群落的多样性不断降低;均匀度总体提高。Day0与Day1相比,发酵前期豆豉细菌群落的Chao 1指数无显著差异(P>0.05),Shannon指数具有显著差异(P<0.05);Day5与Day9相比,发酵中期的Chao 1指数具有显著差异(P<0.05),Shannon指数具有极显著差异(P<0.01);Day13与Day19相比,发酵后期的Chao 1指数与Shannon指数均具有极显著差异(P<0.01)。说明曲霉型豆豉发酵过程中细菌群落组成发生了显著变化。
2.4 曲霉型豆豉细菌群落组成
2.4.1 门水平上细菌群落组成
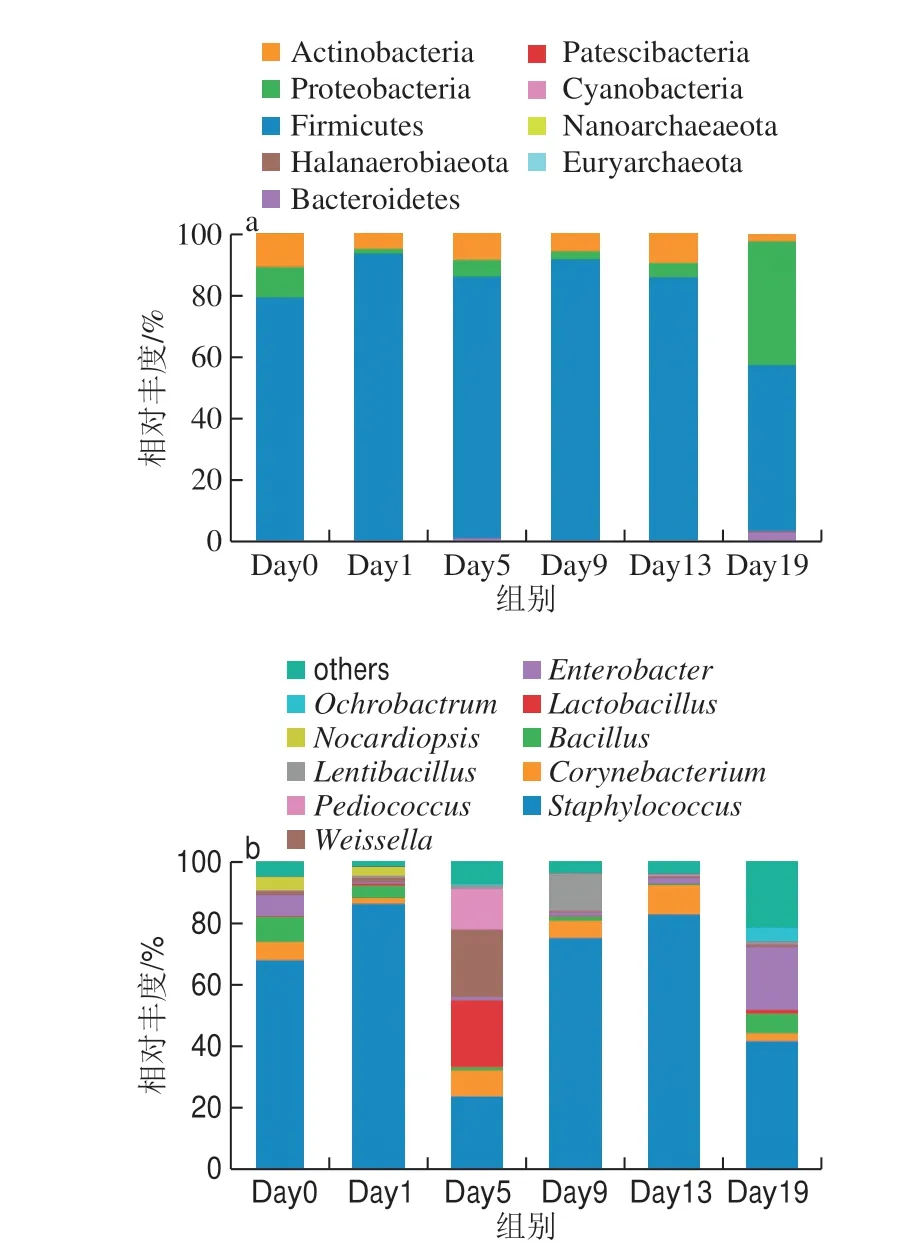
图3 曲霉型豆豉发酵过程中细菌群落的相对丰度分布Fig.3 The distribution of bacterial community during Aspergillus-type Douchi fermentation
经分类学注释,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)是豆豉发酵的主要优势门(图3a,平均相对丰度>1%),三者平均相对丰度分别为81.15%、10.70%和7.17%,其他菌门仅占0.45%。就各优势门的变化趋势看,厚壁菌门与放线菌门的相对丰度在发酵前13 d变化均不大,其中厚壁菌门作为突出优势门,在发酵前13 d的相对丰度均超过70%,但在Day19迅速下降至54.08%;放线菌门也于Day19由起始10.97%下降至2.67%,与Day19新晋优势门即拟杆菌门(Bacteroidetes)的相对丰度(2.73%)基本相当。对于变形菌门而言,其在前13 d的相对丰度维持在1.57%~9.95%之间,但其在Day19的相对丰度迅速上升至39.85%,这与另两个优势门的变化趋势相反。总体来看,厚壁菌门和放线菌门相对丰度呈下降的趋势,变形菌门相对丰度却是上升的趋势。
2.4.2 属水平上细菌群落组成
基于属水平上的分类学注释结果表明,豆豉发酵中主要菌属数为1 0 个(图3 b,平均相对丰度>1%)。在Day1、Day5及Day9,单一或两大优势属相对丰度均超过80%,而在其他阶段,菌属的分布则往往更为均衡、多样。而从特定属在各发酵阶段的分布看,各优势属的丰度变化趋势复杂。发酵前期,葡萄球菌属(Staphylococcus)呈上升趋势,相对丰度为67.57%~85.97%,是该时期豆豉细菌群落相对丰度最高的菌属。此外该时期还存在芽孢杆菌属(Bacillus)、肠杆菌属(Enterbacter)、棒状杆菌属(Corynebacterium)和拟诺卡氏菌属(Nocardiopsis)等。发酵中期温度升高后,葡萄球菌属的相对丰度大幅度降低(24.16%);而就一些典型的乳酸细菌属看,如乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)和片球菌属(Pediococcus)等,其在Day5的相对丰度分别达到21.60%、21.74%和13.50%,但在其他时期,三者仅在1%左右甚至更少。随着发酵后期的到来,葡萄球菌属(42.67%)和肠杆菌属(19.53%)重新成为豆豉细菌群落的优势微生物。另外,包括棒状杆菌属、拟诺卡氏菌属等放线菌在各发酵阶段的相对丰度也均有较大的变化。
2.5 曲霉型豆豉细菌群落分布特征
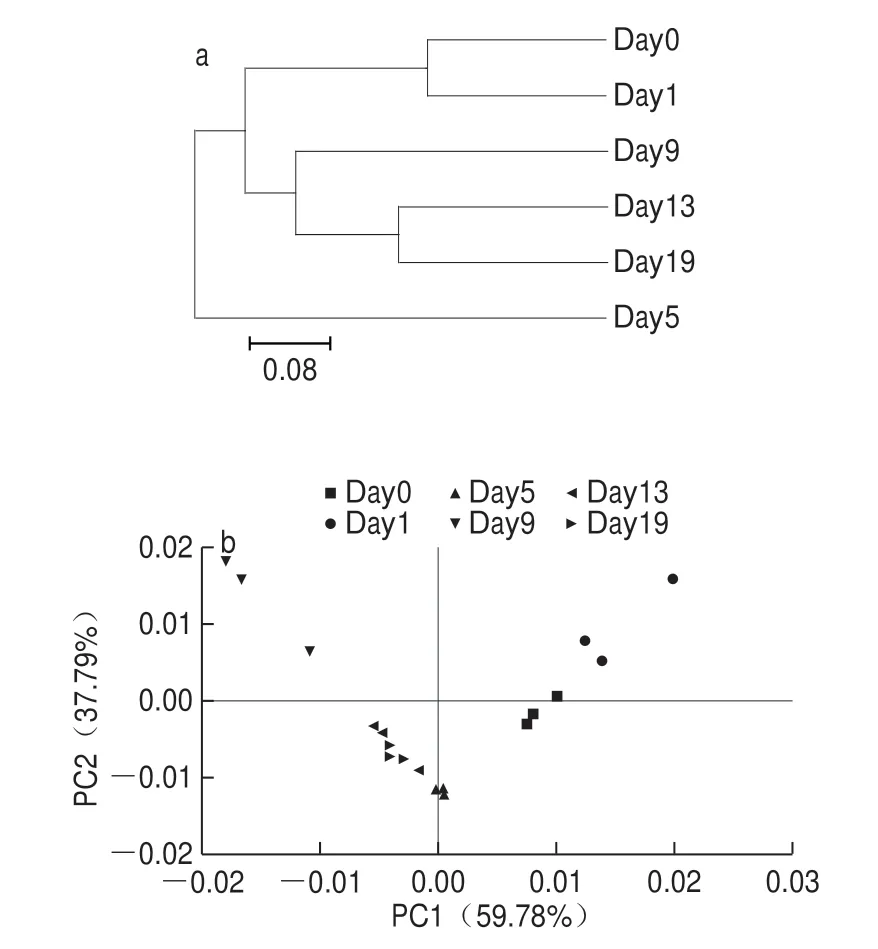
图4 曲霉型豆豉细发酵过程中细菌群落结构UPGMA聚类分析(a)和PCA(b)Fig.4 UPGMA cluster analysis (a) and principal component analysis (b) of bacterial community structure during Aspergillus-type Douchi fermentation
通过UPGMA聚类(图4a),发现豆豉发酵前期与后期细菌群落结构的遗传距离较短,且在相邻两阶段表现尤为明显;而发酵中期豆豉细菌群落结构的遗传距离远大于前两者。由此说明发酵中期的豆豉细菌群落结构与前后期相比存在较大差异,发酵前期与后期的细菌群落结构更为相似。
由图4b可知,PC1与P C2两轴的累计解释率达97.57%,其中PC1轴(59.78%)整体上能够较好区分开豆豉发酵过程中的细菌群落,且组内样品的重复性较好。发酵各个时期细菌的菌群结构均存在一定差异。发酵前、中期(Day0~Day9),不同时间段豆豉样品分布较为分散,表明处于前中期细菌菌群结构差异较大,特别是中期细菌菌群结构存在较大差异。而从发酵后期(Day13~Day19)看,该时期样品的聚集度很高,表明在后期豆豉菌群结构极其相似。
2.6 曲霉型豆豉细菌群落与理化因子关联分析
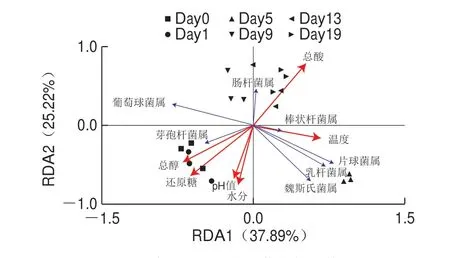
图5 豆豉理化因子与细菌优势属的RDAFig.5 Redundancy analysis of physicochemical factors and dominant bacterial genera
理化因子关联分析后发现,二维排序轴RDA1和RDA2解释种群与环境的累计变化率分别为37.89%和25.22%,两轴和为63.11%(图5),说明RDA1和RDA2即较好地反映出豆豉细菌群落与发酵环境之间的内在关联。就主要优势属看,葡萄球菌属和芽孢杆菌属与pH值、水分、还原糖和总醇含量箭头方向基本一致,说明这两个属与pH值、水分、还原糖和总醇含量存在正相关,并以芽孢杆菌属表现尤为显著;而棒状杆菌属、乳杆菌属、魏斯氏菌属和片球菌属与温度、pH值、水分、总醇和还原糖箭头方向基本一致,且与温度呈明显正相关并以棒状杆菌属尤为强烈;肠杆菌属则与总酸含量箭头方向一致,两者存在显著正相关。
从样品细菌群落分布看,前期豆豉细菌群落的分布主要受水分、还原糖、总醇以及pH值的影响,中后期则是总酸和温度推动发酵进程。表明豆豉发酵细菌结构的演替与发酵环境密切相关。此外,依据优势菌属与理化因子相关性具体排序结果(表2),对豆豉发酵优势属具有重要影响的理化因子指标包括还原糖含量(r2=0.263,P<0.01)、温度(r2=0.248,P<0.01)和pH值(r2=0.203,P<0.01),说明还原糖含量、温度和pH值可能是豆豉发酵过程中细菌群落演替的主要驱动因子。

表2 豆豉理化因子与细菌优势属的蒙特·卡罗检验Table 2 Monte Carlo permutation test of physicochemical factors and dominant bacterial genera
3 讨 论
传统曲霉型豆豉在不同的地域和环境下因工艺不同,豆豉微生物的群落演替各异。研究人员通过对许多豆制品发酵过程中的微生物进行可培养实验和高通量测序,普遍发现细菌是其发酵过程的主要参与者[21-23]。为此,本研究将焦点放在探索豆豉发酵中细菌结构变化及其与发酵环境间的内在关联。首先,从豆豉中微生物的总量看,发酵前期宏基因浓度远大于中后期,且呈现下降趋势,表明豆豉发酵总体上是微生物不断衰亡的过程,此时豆豉中各类微生物虽在逆境(高渗、高温、低pH值等)耐受上存在差异,但在较大的环境胁迫压力下,各类微生物在豆豉发酵的中后期,普遍历经消亡、休眠或缓慢增殖的过程,这一点从丰富度指数整体呈下降的趋势也得到了侧面印证。
其次,从细菌群体的相对分布规律看,厚壁菌门是曲霉型豆豉发酵的优势类群,这与之前许多研究报道均较为类似[11,24-25];隶属于该门的葡萄球菌属、芽孢杆菌属、乳杆菌属、片球菌属和魏斯氏菌属等因对发酵环境具有较好的抗逆性,在发酵食品较为常见[26],这可能是促使厚壁菌门持续成为豆豉发酵中优势类群的重要原因。具体到各属,整个发酵过程虽然细菌群落结构不断变化,尤其是发酵中期细菌菌群演替尤为剧烈,群落分布也极其不均匀,但葡萄球菌属始终是作为发酵菌属的核心角色,芽孢杆菌属及棒状杆菌属占比也较高,三者对某些逆境(盐浓度、氧浓度等)耐受阈值较其他许多发酵细菌更高,优势菌属以绝对的丰度优势消耗发酵环境中的营养基质,间接占据了诸多其他菌属的生存空间。由此细菌群落可能经过环境压力选择趋于同化,这也是细菌群落的“自我净化”[27],使得中期过渡到后期的过程中豆豉细菌群落结构趋向于稳定。
另一方面,发酵食品作为一类人为创设的生境,其自身的温度、酸碱性、有机碳和水分在很大程度上影响发酵食品微生物的生存、演替。有研究发现乙醇、还原糖、pH值和温度等是大曲、白酒及黄酒发酵中菌群演替的主要驱动力[17,28-29]。而在本研究中,曲霉型豆豉发酵在很大程度上是人为升温、保温、最终降温的过程,这种温度变化主要是人为控制因素,另外一定程度上也受细菌产热和豆豉堆积的影响[30]。发酵前期适宜发酵温度和pH值能够为细菌增殖提供良好的生存条件。丰富的碳源及适宜的pH值使得以葡萄球菌属、芽孢杆菌属、棒状杆菌属为代表的优势属增殖,诸类优势属在发酵前期微生物总量较多,代谢中较多地分泌了促进大分子营养基质分解的各类酶类(如淀粉酶、蛋白酶等),发酵初期历经高渗(拌盐)、低氧(密闭)等环境的限制,营养因素(如还原糖)可能也是抑制发酵菌属快速增殖的重要原因。伴随发酵中期温度的骤升,葡萄球菌和芽孢杆菌属的增殖受限。值得注意的是,此时某些放线菌如棒状杆菌属的相对丰度却更高,而该菌属在白酒发酵、醇类生产等高温发酵的报道中较为常见[17],侧面说明棒状杆菌耐高温胁迫能力相对更高。此外,相对更高的温度及前期其他菌属的代谢物,一定程度上使乳酸杆菌属、片球菌属和魏斯氏菌属等乳酸菌更具优势[31],乳酸菌适应环境同时活跃代谢产酸使得发酵环境pH值继续下降,而愈加酸化的环境则可能会抑制以乳杆菌属[32]、魏斯氏菌属[33]为代表的乳酸菌自身生长。但在发酵后期,随着温度的缓慢下降,增殖速度较快的葡萄球菌属、肠杆菌属、芽孢杆菌属在解除了显著负相关的环境因子即高温的限制,重新成为优势菌属,并且出现其他菌属如慢生杆菌属形成新的生态平衡。总体上看,高温、有机酸的累积、还原糖消耗以及菌属竞争降低豆豉细菌类群的丰富度,却一定程度促进群落多样性和推动发酵。豆豉发酵的许多菌属,葡萄球菌属、乳杆菌属、魏斯氏菌属和片球菌属等对发酵温度、pH值以及还原糖的变化较为敏感。因此,未来通过科学、精确地控制豆豉发酵过程中的环境因素,对不同批次豆豉保持稳定的品质风味具有重要的生产意义。
4 结 论
曲霉型豆豉在发酵过程中,伴随着发酵环境的变化,微生物总量逐步减少,隶属于厚壁菌门的葡萄球菌属、乳杆菌属、魏斯氏菌属和片球菌属在发酵进程中十分重要,虽然细菌菌落结构波动较大,但葡萄球菌属始终为核心,而还原糖、pH值以及温度可能是造成豆豉细菌群落演替的重要驱动因子。考虑到实际生产需要,温度可能是未来豆豉工业化生产的人为控制的重要因素。
