乳酸钙对高酯柑橘果胶乳化性的影响
2021-03-01范传会何建军陈学玲王少华
范传会,何建军,陈学玲,王少华
(湖北省农业科学院农产品加工与核农技术研究所,湖北 武汉 430068)
果胶是从植物组织中提取、总半乳糖醛酸含量大于65%的天然生物大分子多糖[1]。根据酯化度不同,果胶分为高酯果胶(酯化度大于50%)和低酯果胶(酯化度小于50%)[2]。果胶具有促进肠道有益菌生长、降胆固醇、降血糖和抗癌等多种生理功能[3-5]。GB 2760ü 2014《食品添加剂使用标准》[6]规定果胶作为绿色、安全、无毒的增稠剂、稳定剂及乳化剂,在除果蔬汁以外的多种食品中可根据实际生产情况适当添加,不作添加量上限限制。果胶广泛存在于植物组织中,从柑橘属植物中提取的果胶称为柑橘果胶。中国是柑橘主产区之一,据统计2018年中国柑橘产量为4 138.1万 t[7]。柑橘汁是柑橘加工产品之一,在柑橘汁加工过程中约50%~60%柑橘果实转变为废弃物,不仅造成资源的大量浪费,还会对环境造成污染[8]。柑橘汁加工废弃物中含有丰富的果胶,以柑橘废弃物为原料提取果胶并加以利用,既充分利用了柑橘汁加工废弃物,又减少了废弃物对环境造成的污染,有利于柑橘加工业的绿色、健康发展。
乳化性质是果胶最重要的性能指标之一,关于果胶乳化性质的研究已经展开多年。一般认为影响果胶乳化性质的因素主要分为两部分,一是内在因素(例如甲基化程度、蛋白质残留量、乙酰基和分子质量等),二是外在因素(例如果胶浓度、蛋白质含量、pH值和离子强度等)[9-11]。果胶分子中含有疏水基团和亲水基团,两亲物质果胶溶于水后会发生自主装,聚集形成胶束(果胶的聚集体)。已有报道表明果胶溶于水后,因氢键的作用迫使果胶分子形成果胶簇[12]。文献[13]中的原子力显微镜图片也探测到了果胶聚集态的存在。目前研究果胶乳化性时,通常从果胶分子的疏水基团、亲水基团和分子柔性等[14-15]方面分析其乳化性质,忽略了果胶自组装后形成的胶束对其乳化性质的影响。根据两亲分子性质,果胶在水溶液中形成胶束后,果胶分子的亲水性基团会分布在胶束的外表面。当单独用果胶作为乳化剂时,果胶胶束因外表面分布着大量的亲水基团,果胶胶束对其乳化性影响较少。果胶胶束的外表面含有的亲水基团中包括未甲酯化的羧基,未甲酯化的羧基带有负电性,电解质中含有带正电的阳离子(如钙离子),向果胶溶液中加入电解质(如乳酸钙),因静电作用电解质会改变果胶胶束性质,果胶胶束对其乳化性的影响则需要进一步研究。目前关于果胶胶束对其乳化性影响的研究鲜有报道。
本研究用商品高酯柑橘果胶(high methoxy citrus pectin,HMP)为乳化剂,以果胶胶束性为切入口,分析外加电解质乳酸钙对HMP胶束形态和大小等变化,探讨乳酸钙对HMP乳化性质的影响,旨在为改善HMP乳化性质提供一定理论依据。
1 材料与方法
1.1 材料与试剂
H M P(酯化度(7 1.2 f 2.2)%,重均相对分子质量(138f 2)×103,半乳糖醛酸含量≥74.0%(干质量)) Sigma(中国)有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
雷磁PHS-3C酸度计 上海精密科学仪器有限公司;JA2003A电子天平 上海精天电子仪器有限公司;POLYPON PT.MR 2100均质器 上海斯高勒生物科技有限公司;Jeol 2010透射电子显微镜(transmission electron microscope,TEM) 日本电子株式会社;Ultrascan 4000数码相机 美国Gatan公司;Mastersizer PAP2000粒度仪、Zetasizer Nanoseries Nano ZS粒度仪 英国马尔文公司;Leica DM3000显微镜 徕卡显微系统(上海)贸易有限公司;DP-26数码显微照相装置 奥林巴斯(中国)有限公司。
1.3 方法
1.3.1 果胶样品溶解
前期研究发现只有当HMP浓度大于一定值时,乳酸钙才能显著改善HMP的乳化能力。为了具体说明乳酸钙浓度对HMP乳化性的影响,本实验固定HMP浓度,通过改变乳酸钙浓度,分析乳酸钙浓度对HMP乳化能力的影响。HMP溶液的配制方法如下:将HMP溶解在0.04%叠氮化钠(抗菌剂,防止微生物生长)的溶液中,室温下用磁力搅拌器搅拌24 h,配制成质量分数1.80%的果胶溶液,备用。
1.3.2 混合液的制备
用蒸馏水配制浓度为0.00、5.00、10.00、15.00、20.00、25.00、30.00 mmol/L乳酸钙溶液。取5.00 mL 1.80%高酯果胶溶液分别于5.00 mL不同浓度的乳酸钙溶液混合制备成含有0.90% HMP和0.00、2.50、5.00、7.50、10.00、12.50、15.00 mmol/L乳酸钙的混合溶液,将混合溶液用均质器13 000 r/min均质2 min后备用。
1.3.3 果胶胶束大小测定
将上述混合溶液用蒸馏水稀释30 倍后,采用动态光散射法,用Zetasizer Nanoseries Nano ZS粒度仪测定HMP胶束大小。
1.3.4 HMP胶束TEM观察
用TEM观察HMP胶束在水和乳酸钙溶液中的形态。在观察之前,先对HMP胶束样品染色。具体步骤如下:取1 滴样品滴加在涂有碳的铜栅格漂浮2.00 min。用镊子除去格栅,并用滤纸芯吸掉多余的样品。在超纯水中短暂冲洗后,如前所述,将多余样品用滤纸芯吸走,将格栅放在1.00%的乙酸双氧铀滴上1 min。用滤纸滤去多余的污渍,将格栅风干。将样品染色后,在120 kV电压下用连接有Digital Micrograph软件的Jeol 2010透射电子显微镜和Gatan Ultrascan 4000数码相机获得TEM图像。
1.3.5 乳液的制备
以上述混合液为水相,以用碱性氧化铝过滤后的菜籽油为油相,以7∶3的水油质量比将水相和油相加在内径1.60 cm、高8.50 cm的玻璃瓶内,用均质器以13 000 r/min速率均质2.00 min,制备乳液。
1.3.6 乳化性分析[9]
将乳液室温下放置28 d,以乳化指数为指标,分析乳化剂的乳化性质。

式中:乳液高度为乳化层高度+水层高度。
1.3.7 乳滴形态观察
在载玻片上加入1 滴乳液并加上盖玻片,在白光下用显微镜观察自然状态下乳滴的形态和大小。取乳化层溶液3.00 g加入2 滴质量分数为0.05%的刚果红溶液染色过夜,将染色后的乳液滴加在载玻片上,加上盖玻片;将蒸馏水滴加在载玻片的一端,另一端用吸水纸轻轻吸出水分,洗涤乳滴3 次;高倍镜下观察乳滴形态。
1.3.8 乳液粒度测定
设定水相相对折光为1.34,油相相对折光系数为1.46,以蒸馏水作为分散剂,用激光粒度仪测定新鲜乳液的粒度,结果以d(0.9)表示。
1.4 数据分析
实验数据为3 次实验的平均值,并用Excel 2013软件进行数据分析。
2 结果与分析
2.1 乳酸钙浓度对HMP胶束粒度分布和形态的影响


图1 乳酸钙浓度对HMP胶束大小分布的影响Fig.1 Effects of calcium lactate concentrations on the size distribution of HMP micelles
两亲分子在水中溶解时,其亲油基团总倾向于脱离极性的水环境;当水溶液中两亲分子达到一定浓度时,其在水溶液中自发地形成以亲水基团朝向水环境、亲油基团处于内部的聚集体,该过程被称为自组装;自组装形成的聚集体被称为胶束[16]。HMP分子中含有多种疏水基团(甲酯化羧基、酰胺基和阿魏酰基等)和亲水基团(未甲酯化羧基和氢键等)。理论推测果胶在水溶液中溶解时,同样会发生自主装形成胶束,该推测也得到了文献[13]中原子力显微镜观察结果的证实。因此图1结果可认为是HMP胶束在溶液中的粒度分布图。由图1a可知,HMP溶解在纯水中,形成的胶束颗粒大小分布在341~2 818 nm之间,胶束颗粒分布呈单峰分布,说明胶束大小不均匀。由图1b~f可知,乳酸钙浓度影响HMP胶束粒度分布,随着乳酸钙浓度的增加,HMP胶束的粒度分布向着变大的方向移动;当乳酸钙浓度增加到7.50 mmol/L时,果胶胶束开始呈现多峰分布状态,且主峰粒度分布范围在400~3 000 nm之间,呈增大趋势。果胶中的未甲酯化羧基可与钙离子发生交联反应,交联反应的模型被称为“鸡蛋型”模型[17]。HMP果胶仅在钙离子存在的条件下不能形成凝胶[18],因此本实验中HMP溶液加入乳酸钙后没有形成凝胶。根据胶束性质知,当果胶达到一定浓度时,果胶胶束才会出现[19]。图1中HMP颗粒主峰分布向增大的方向移动及多峰分布的出现,可能是因为乳酸钙中钙离子的作用;其中70~200 nm分布的颗粒可能是溶液中的HMP分子通过钙离子的交联作用形成的小颗粒,3 000~7 000 nm分布的颗粒可能是HMP胶束彼此之间通过钙离子的交联形成的大颗粒。

图2 0.90% HMP胶束在水溶液(a)和在12.50 mmol/L乳酸钙溶液(b)中的TEM图Fig.2 TEM Images of 0.90% HMP micelle in water (a) and in 12.50 mmol/L calcium lactate solution (b)
由图2a可知,HMP胶束在水溶液中呈现多种形态且大小不均匀,如杆状、圆弧状和不规则圆球状等;胶束颗粒之间单独存在,不存在网状交联结构。类似圆球状HMP胶束在文献[20]中也有报道。对比图1a可知,TEM观察到的HMP胶束在水溶液的大小略小于动态光散射下测定的HMP胶束大小。其原因是图1测定的胶束大小是在水溶液状态下的大小,HMP因为溶胀作用变大[21-22];而TEM观察的胶束大小是在干燥状态下的大小,故HMP胶束大小略微减少,HMP胶束形态在乳酸钙溶液中显著不同于其在水溶液中的形态。如图2b所示,在乳酸钙溶液中HMP胶束彼此连接在一起形成了网状结构,胶束表面出现细小的毛发状结构,其原因是乳酸钙改变HMP胶束在溶液中结构。图2b中箭头所指将胶束彼此连接在一起的细小丝线结构可能是与钙离子交联后的HMP分子。类似结构在文献[23]中也有出现。
2.2 乳酸钙对HMP的乳化能力和乳液稳定性的影响

图3 HMP和乳酸钙混合液制备的乳液图Fig.3 Photographs of emulsion prepared from HMP with added calcium lactate
由图3可知,乳液在室温下放置28 d后,当水相中乳酸钙的浓度不大于10.00 mmol/L时,乳液出现了乳析现象,乳液上层没有油析出说明乳滴没有发生显著聚合。由图4可知,当乳酸钙浓度由2.50 mmol/L增大至12.50 mmol/L时,乳液的乳化指数由0.47增加到1.00,说明乳酸钙显著提升了HMP乳化能力。类似作用结果在文献[24]中也有报道,但其中所用果胶为低酯柑橘果胶(low methoxy citrus pectin,LMP)。LMP分子中未甲酯化羧基含量高于HMP分子中未甲酯化羧基含量[2],根据胶束形成理论[16]推测LMP在水溶液中形成的胶束大小与HMP在水溶液中形成的胶束大小不同;LMP胶束外表面分布的未甲酯化羧基含量大于HMP胶束外表面分布的未甲酯化羧基含量。但文献[25]显示钙离子会降低果胶的乳化能力,产生相反结果的原因可能是果胶种类和钙盐种类不同。果胶来源和理化性质会影响果胶的乳化性质[26]。文献[27]选择阿拉伯胶进行实验,阿拉伯胶的主要单糖组分为阿拉伯糖和半乳糖,与果胶的主要单糖组分(半乳糖醛酸)不同,使阿拉伯胶在水溶液中的存在形式不同,因此,阿拉伯胶在钙离子条件下,乳化性变化与本实验结果不同。
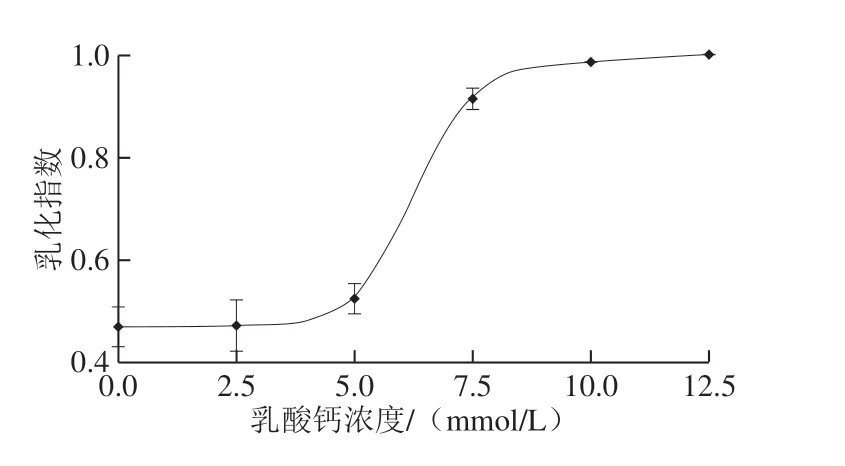
图4 乳酸钙浓度对乳液乳化指数的影响Fig.4 Effect of calcium lactate concentration on creaming index (CI) of emulsion
2.3 乳滴大小和分布

图5 乳酸钙对乳滴d(0.9)值的影响Fig.5 Effect of calcium lactate concentration on emulsion droplet d (0.9)
由图5可知,加入乳酸钙后,乳滴d(0.9)值变小,但在2.5~12.5 mmol/L范围内,d(0.9)变化不显著,说明在该浓度范围内,增加乳酸钙浓度不能显著改变乳液的乳滴大小。如图6a所示,单独用HMP作为乳化剂制备乳液时,乳滴大小呈双峰形式分布,其中乳滴大小的主峰分布在10.00~100.00 μm,次峰分布在1.00~10.00 μm。图6说明乳液中乳滴大小不均匀,乳液为多分散乳液。由图6b~f知,当乳酸钙浓度高于5.00 mmol/L时,乳滴分布中的次峰消失,乳滴分布呈现单峰分布;而乳酸钙对乳滴的主峰分布范围无显著影响,但对峰型有影响,加入乳酸钙乳滴峰型更加纤细,说明乳酸钙使乳滴的大小分布向在10.00~100.00 μm的范围内向中部集中;该种乳滴大小分布的峰型改变是降低d(0.9)值的原因。
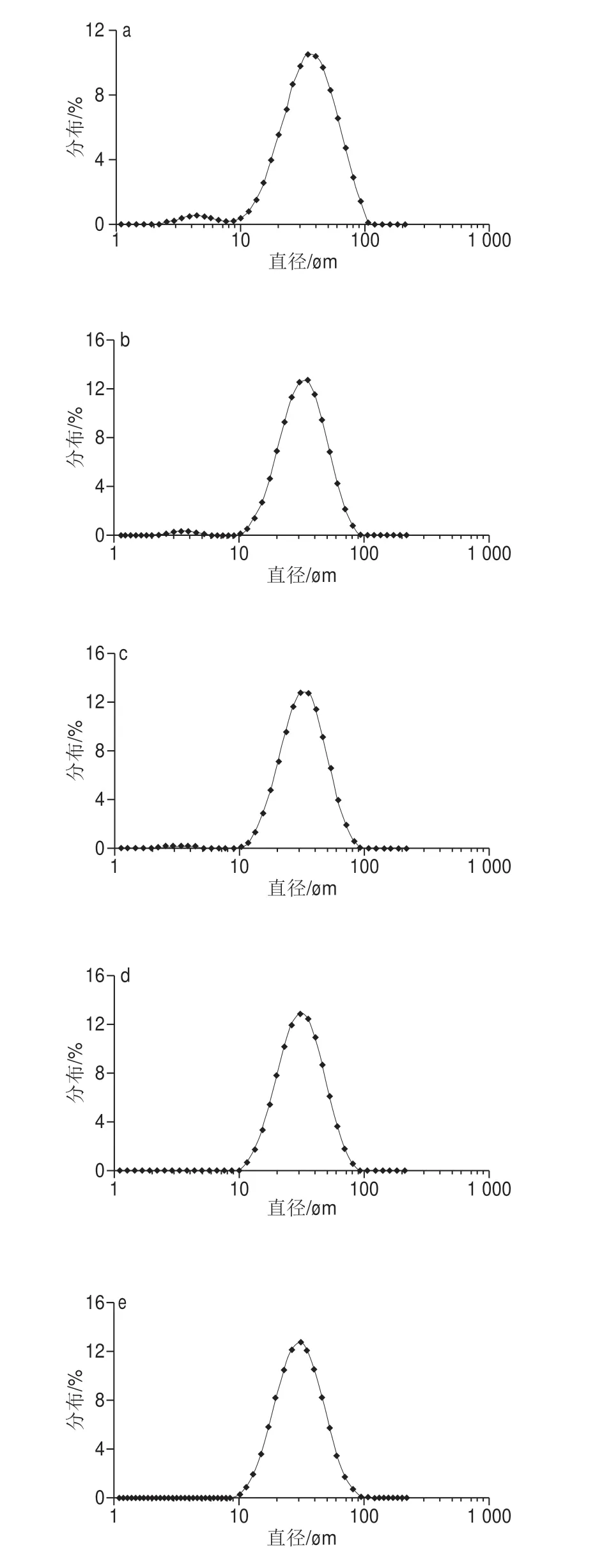
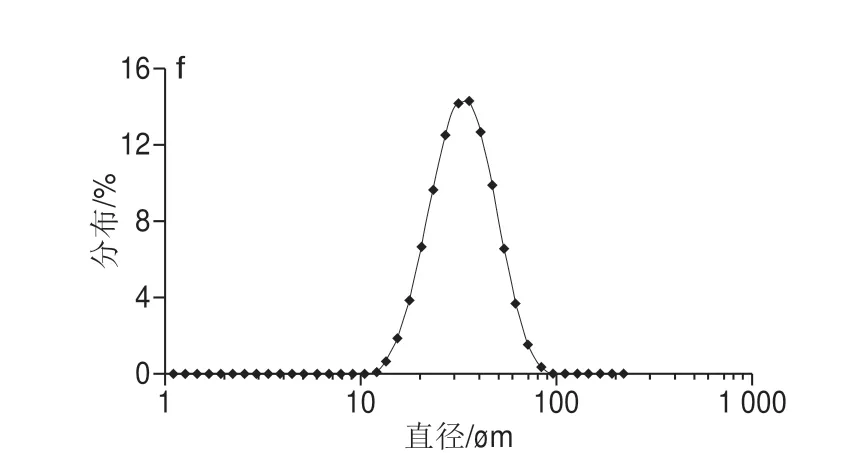
图6 HMP和乳酸钙混合物制备的乳液乳滴大小分布图Fig.6 Droplet size distribution of emulsion prepared from HMP with added calcium lactate
2.4 乳滴形态

图7 HMP和乳酸钙混合物制备的乳液乳滴形态图Fig.7 Droplet morphology of emulsion prepared from HMP with added calcium lactate
如图7所示,乳滴形态为圆球形,大小不均匀,乳液为多分散乳液。仔细观察乳滴形态,发现部分乳滴为非规则圆球形,且在加入乳酸钙的乳液中更为明显,说明乳酸钙影响乳液中的乳滴形态,可能是因为果胶形成的微凝胶颗粒的作用[28]。刚果红可以将果胶染成红色[29],用刚果红溶液对乳液进行染色,得到染色后的乳滴形态图如图8所示。单独使用HMP作为乳化剂制备乳液时(图8a),染色后乳滴的表面比较光滑,不存在染色后的条状结构;部分乳滴表面的圆形颗粒可能是因为盖玻片压下的小粒度乳滴。图8b是用含有乳酸钙的HMP制备的乳液,染色后的乳滴表面出现紫红色细丝条纹,说明乳滴表面附着有物质。结合本实验所用的乳化剂推测在HMP中加入乳酸钙,乳滴表面附着的物质为HMP胶束;图7中非规则圆球形乳滴形态的出现与乳滴表面附着物有关。
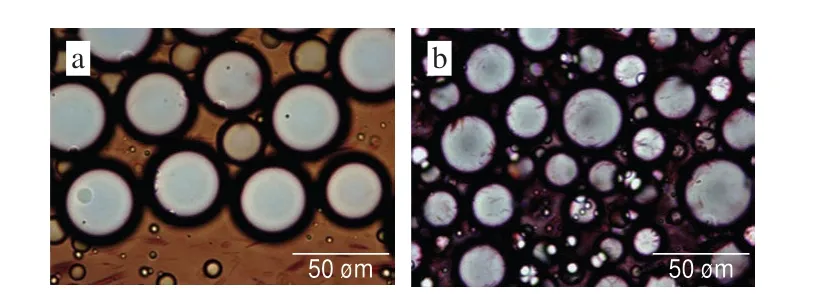
图8 HMP和乳酸钙混合物制备乳液的乳滴染色形态图Fig.8 Dyed droplet morphology of emulsion prepared from HMP with added calcium lactate
2.5 乳酸钙促进HMP乳化能力及促进乳液稳定假设性机理模型
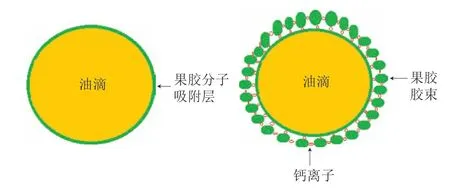
图9 乳酸钙促进HMP稳定性的机理模型图Fig.9 Schematic model illustrating the mechanism for calcium lactate to improve the stability of emulsion prepared with 0.90% HMP
上述分析知乳酸钙显著提升HMP的乳化指数,改善HMP乳化性。用含有乳酸钙的0.9% HMP作为乳化剂制备乳液,乳酸钙在2.50~12.50 mmol/L浓度范围内可显著增加HMP的乳化指数。当乳酸钙浓度达到12.50 mmol/L时,室温贮藏28 d,HMP制备的乳液的乳化指数为1.00,无乳析现象出现,说明乳酸钙可显著抑制乳析现象的发生。乳酸钙在2.50~12.50 mmol/L浓度范围内,乳滴大小分布范围无显著变化,说明在该范围内乳酸钙对乳滴大小无显著影响。乳析现象的出现是因为重力的作用[30]。乳酸钙抑制乳析现象的出现,对乳滴大小无显著影响,说明将乳酸钙加入到HMP溶液中,形成的乳滴质量显著增加。HMP作为乳液剂,主要是因为HMP分子中疏水基团和亲水基团的作用。当单独用HMP作为乳化剂时,果胶胶束因为其表面分布大量的亲水基团不能大量吸附在油滴的表面,可能存在微量小粒径的胶束因为氢键的作用而附着油滴表面,但微量胶束不能显著增加乳滴质量,故HMP胶束对乳液的乳化能力影响较小。在HMP溶液中加入乳酸钙,乳酸钙中含有带正电的金属阳离子(钙离子),HMP胶束表面含有带负电性的未酯化羧基,因静电作用乳酸钙会使溶液中HMP胶束性质发生改变。结合本实验中HMP溶液和乳液的分析结果作出如下假设并绘制出加入乳酸钙后的HMP乳化机理模型图(图9),在钙离子的作用下,HMP胶束表面分布的未甲酯化羧基与HMP分子之间的未酯化羧基通过钙离子的交联作用连接在一起,与HMP分子交联的HMP胶束,因HMP分子中疏水基团的牵引而附着在油滴表面,附着在油滴表面的HMP胶束之间同样因钙离子的交联作用彼此连接,因此在乳液的油滴表面形成了一层HMP胶束吸附层,显著增加乳滴质量,有效抑制了乳析现象的发生。在果胶溶液中加入乳酸钙后,乳液的乳化机理可能发生了改变,形成的乳液类似Pickering乳液。
3 结 论
HMP在水溶液中通过自组装形成胶束。HMP胶束在水溶液中形状和大小不均匀,胶束颗粒之间单独存在,不存在网状结构。HMP胶束在乳酸钙中彼此之间通过钙离子的交联作用连接形成网状结构。胶束表面出现细小毛发状结构。
乳酸钙显著提高HMP的乳化性,乳酸钙可显著抑制乳液中乳析现象的出现。在HMP加入乳酸钙,乳液的乳化指数随着乳酸钙浓度的升高而升高;当乳酸钙浓度达到12.5 mmol/L时,乳液在室温下贮藏28 d乳化指数达到1.00,乳液无乳析现象出现。
乳酸钙影响乳滴粒度分布、乳滴形态及HMP胶束在油滴表面的吸附特性。在HMP中加入乳酸钙,乳滴d(0.9)值略微减少;乳滴形态出现非规则圆球形;乳滴染色后发现乳滴表面有呈现紫红色的细丝条纹附着物,推测该紫红色附着物为HMP胶束。
