卵白蛋白-白藜芦醇相互作用机理及其对卵白蛋白的影响
2021-03-01高金燕陈红兵
操 强,胡 巍,高金燕,陈红兵,佟 平
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.南昌大学中德联合研究院,江西 南昌 330047)
鸡蛋是常见八大食物过敏原之一[1],鸡蛋过敏原蛋白主要存在于蛋清中,其中卵白蛋白(ovalbumin,OVA)占蛋清中蛋白含量的54%[2],是鸡蛋中过敏原蛋白含量最高的一种蛋白质。过敏原的抗体结合表位是过敏原蛋白上可被机体识别并产生一系列免疫反应的位点,一般分为线性表位[3]和构象表位[4]。因此,在脱敏/低致敏蛋制品研究领域,研究人员常采用一些加工手段对过敏原的线性表位和构象性表位进行改造以达到降低/完全消除致敏性的目的[5]。
近年有较多活性物质与蛋白质相互作用的研究,活性物质与蛋白质相互作用一方面可提高活性物质的吸收率、生物利用率[6],另一方面改善蛋白质的加工特性[7-8]、潜在致敏性[9]。现有研究表明多酚类物质可与花生蛋白、牛奶蛋白等过敏原蛋白相互作用,蛋白质的氨基酸微环境、高级结构(二、三、四级结构)都可能受到影响,从而改变过敏原蛋白的线性表位、构象表位,起到降低过敏原蛋白致敏性的作用[10-11]。白藜芦醇(resveratrol,RES)是一种非黄酮类多酚化合物,具有抗肿瘤[12]、保护心血管[13]、抑菌[14]、抗氧化[15]、抗炎症[16]、免疫调节[17]等生物活性。研究显示RES可以抑制IgE介导的皮肤过敏反应的发生/减缓症状[18],另有实验结果表明RES作为膳食补充剂可以预防食物过敏的发生[19]。而RES作为膳食补充剂与鸡蛋中主要过敏原OVA的相互作用及其对OVA潜在致敏性产生的影响仍不清楚,需要进一步的研究阐明。
本研究以RES和OVA为研究对象,利用荧光光谱法探究OVA和RES相互作用的机理,且从体外血清学角度评价OVA-RES复合物的潜在致敏性。本研究旨在指导开发具有丰富活性且低致敏或脱敏的蛋制品,为人们的日常健康膳食提供理论依据。
1 材料与方法
1.1 材料与试剂
红壳鸡蛋 市场;RES(纯度>99%) 上海阿拉丁生化科技股份有限公司;OVA(纯度>95%)由实验室自制;磷酸盐缓冲溶液(phosphate buffered solution,PBS) 北京索莱宝科技有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗、羊抗人免疫球蛋白E(immunoglobulin E,IgE)二抗 美国Sigma公司;3,3’,5,5’-四甲基联苯胺(tetramethylbenzidine,TMB)显色液、链霉亲和素-辣根过氧化物酶(horse radish peroxidase,HRP)结合物 深圳欣博盛生物科技有限公司。
1.2 仪器与设备
Milli-Q超纯水仪 美国Millipore公司;PB-10酸度计 赛多利斯科学仪器有限公司;F-4600荧光分光光度计 日本日立高新技术公司;Lambda 25紫外-可见分光光度计 珀金埃尔默仪器有限公司;MOS-450圆二色谱仪 法国Bio-Logic公司;Varioskan Flash多功能读数仪 赛默飞世尔科技有限公司。
1.3 方法
1.3.1 荧光猝灭光谱
在298、306、314 K三种温度条件下进行荧光猝灭实验,激发和发射狭缝宽度固定为2.5 nm,激发波长为280 nm,发射波长范围250~500 nm,扫描速率为1 200 nm/min。首先向石英比色皿加入3 mL 2h 10-6mol/L的OVA溶液(0.01 mol/L pH 7.4 PBS配制),恒温稳定5 min后扫描荧光光谱,然后再依次加入6 μL 2h 10-3mol/L RES溶液(含20%乙醇,以PBS配制),一共滴加10 次,每次滴加后移液枪吹打混匀,恒温静置3 min后扫描荧光光谱。此外扫描PBS荧光光谱以及相应浓度RES溶液激发波长、发射波长处的紫外-可见光吸收光谱,分别用于缓冲液背景校正和内滤光校正[20]。
1.3.2 同步荧光光谱
298 K条件下,设置激发波长和发射波长间距分别为15 nm(Δλ=15 nm,Tyr)和60 nm(Δλ=60 nm,Trp),扫描2h 10-6mol/L OVA溶液同步荧光光谱,再分别滴加5 次RES溶液,12 μL/次,每次混匀静置3 min后再扫描。
1.3.3 三维荧光光谱
在298 K条件下,激发波长范围200~400 nm(每5 nm),发射波长范围200~600 nm(每5 nm),OVA和OVA-RES以物质的量比为1∶1、1∶2的OVA-RES(1∶1)、OVA-RES(1∶2)溶液分别进行三维荧光光谱扫描。
1.3.4 ANS荧光光谱
将OVA溶液和0.01 mol/L PBS配制的ANS按OVA-RES物质的量比分别为4∶1、2∶1、1∶1、1∶2、1∶4混合,涡旋混匀,避光反应1 h。激发波长为390 nm,发射波长为400~450 nm,狭缝宽度5.0 nm,电压为700 V,扫描样品的ANS荧光光谱。
1.3.5 圆二色谱
以OVA计算,将样品稀释成0.1 mg/mL,远紫外圆二色谱的条件:光径1 mm,扫描范围190~250 nm,速率60 nm/min,带宽1 nm,超纯水作为空白对照。通过在线圆二色谱分析网站(http://dichroweb.cryst.bbk.ac.uk/html/ho.shtml)对数据进行分析计算,结果以平均摩尔椭圆率表示,单位为(degg cm2)/dmol。
1.3.6 潜在致敏性
1.3.6.1 体外IgG结合能力
间接竞争法评估体外IgG结合能力,取A板4 ℃过夜包被抗原(OVA),用含体积分数0.05%吐温20的PBS(即PBST)洗涤后,再用3 g/100 mL的脱脂乳在37 ℃条件下孵育封阻1 h。另取B板用脱脂乳37 ℃封阻1 h后,PBST洗涤后再加入50 μL竞争蛋白与50 μL用PBS稀释50 000 倍的兔血清IgG(一抗)溶液进行反应。竞争反应:B板中的竞争蛋白与稀释的一抗板外反应l h后,从B板将相应孔中的反应液转移至A板,设置阴性孔(PBS代替竞争蛋白和抗血清)、阳性孔(PBS代替竞争蛋白),37 ℃孵育1 h后洗涤,每孔加入100 μL稀释好的HRP标记的羊抗兔IgG(二抗,1∶5 000),37 ℃孵育1 h后。竞争反应结束后洗涤扣干,然后每孔加100 μL TMB显色液,37 ℃孵育15 min,每孔加入50 μL 2 mol/L H2SO4溶液终止反应,在450 nm波长处检测OD450nm。以抑制率表示IgG结合能力,抑制率计算见式(1):

1.3.6.2 体外IgE结合能力
同1.3.6.1节先取A板进行包被抗原,PBST洗涤后脱脂乳封阻1 h。另外取B板脱脂乳37 ℃封阻1 h,洗涤后加入竞争抗原和60 µL稀释的人血清(一抗,1∶20),37 ℃孵育反应1 h。竞争反应:取出A板洗板后,吸取100 µL B板的反应液转入A板中,37 ℃孵育1 h后洗涤,然后加入100 µL生物素标记的羊抗人IgE(二抗,1∶5 000),37 ℃孵育1 h。竞争反应结束后洗涤扣干,每孔加入100 µL HRP标记的链霉亲和素(1∶60),再次37 ℃孵育1 h后洗涤,每孔加入100 µL的TMB显色液,37 ℃反应15 min后再每孔加入50 µL 2 mol/L H2SO4溶液终止显色反应,测定OD450nm。IgE抑制率计算同式(1)。
1.4 数据分析
2 结果与分析
2.1 相互作用机理
蛋白质的色氨酸(tryptophan,Trp)、酪氨酸(tyrosine,Tyr)和苯丙氨酸(phenylalanine,Phe)等氨基酸可以在一定波长的激发光下产生内源性荧光,氨基酸残基的荧光强弱变化和最大荧光强度波长的变化可以表征蛋白质构象的变化,因此常用荧光光谱法研究蛋白质的结构[21]。如图1A~C所示,在298、306、314 K条件下,固定激发波长280 nm,随着RES的加入,OVA的荧光强度有明显减弱,且各温度下都表现出不同程度的红移现象。这可能是OVA被激发后处于激发态时与RES碰撞,这种相互碰撞导致激发态分子的能量转移和丧失,蛋白质恢复基态从而表现为荧光猝灭的现象,而温度的变化使得分子的热运动速率不同,碰撞频率也不一样[21]。由此可得RES和OVA发生了相互作用,RES的加入使得蛋白质的Trp等残基微环境发生了改变。
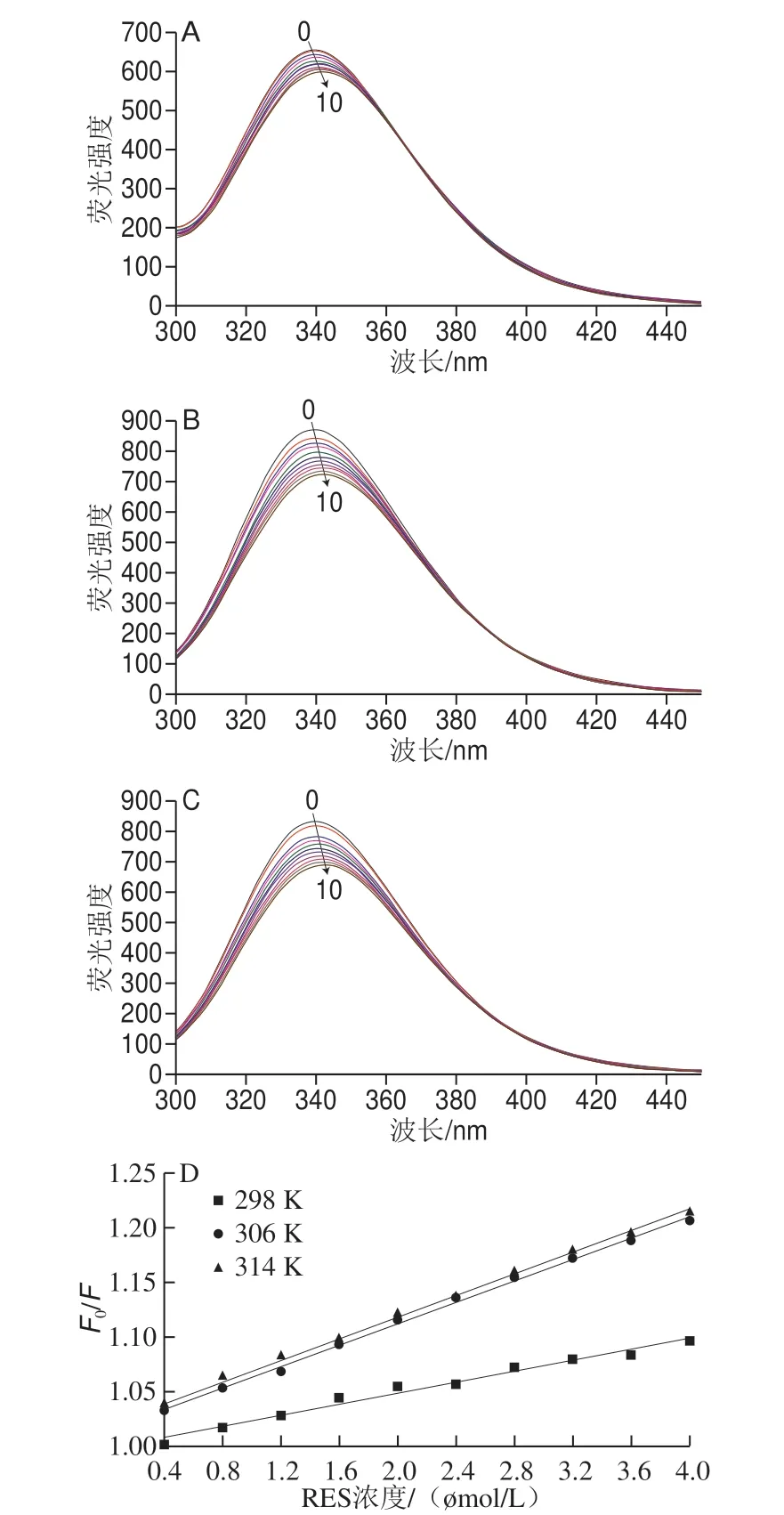
图1 RES对OVA的荧光猝灭影响Fig.1 Effects of RES on fluorescence spectra of OVA at different temperatures
图1D中3 条曲线分别是298、306、314 K条件下,以RES浓度为横坐标、F0/F为纵坐标拟合的Stern-Volmer曲线,方程[22]如下:

式中:F0和F为无猝灭剂和有猝灭剂时的荧光强度;[Q]为猝灭剂浓度/(μmol/L);KSV为Stern-Volmer猝灭常数/(L/(molg s));Kq为生物分子猝灭速率常数/(L/mol);τ0为无猝灭剂的生物大分子平均寿命(τ0=10-8s)[23]。
荧光猝灭类型一般分为动态猝灭和静态猝灭,由图1D可知,猝灭曲线和RES浓度有良好的线性关系,而且Stern-Vlomer斜率随着温度升高而增大,即猝灭常数KSV随温度升高而增大,由此可以判断RES对OVA的荧光猝灭类型为分子间碰撞而引起的动态猝灭。
RES相对分子质量为228.24,是一种多酚类小分子物质。小分子物质在与生物大分子蛋白质相互作用时,可能存在一个平衡状态,即部分小分子与蛋白结合,而另一部分处于游离状态,因此通过如下双对数方程描述这种平衡关系[24]:
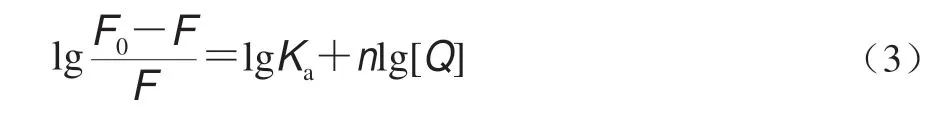
式中:Ka为RES与OVA的结合常数/(L/mol);n为结合位点数。

表1 不同温度下OVA-RES的荧光猝灭常数KSV、猝灭速率常数Kq、结合常数Ka、结合位点数n及热力学参数Table 1 Quenching constants (KSV), binding constants (Ka), and relative thermodynamic parameters for the interaction between RES and OVA at different temperatures
从表1可知,298、306、314 K条件下,OVA-RES的结合常数分别为1.53h 104、0.55h 104、0.20h 104L/mol,而结合位点数分别为0.964 8、0.820 3、0.739 7,说明RES与OVA结合的最佳比例约为1∶1。
此外,研究小分子物质和大分子蛋白质相互作用常涉及对相互作用的热力学参数的计算,以解析相互作用过程中作用力类型为主导,研究常用范特霍夫方程计算焓变(ΔH)、熵变(ΔS)和吉布斯自由能变(ΔG)等相关信息[25]。范特霍夫方程如下:

Ross等[26]总结出依据相互作用过程中由焓、熵、吉布斯自由能的数值可推知相互作用力的类型。其中,ΔS>0、ΔH>0为典型的疏水作用力;ΔH<0、ΔS<0主要存在氢键和范德华力;ΔH<0、ΔS>0时,主要存在静电相互作用。经计算RES和OVA相互作用热力学参数信息如表1所示,ΔH<0,ΔS<0,可以确定RES与OVA的相互作用力主要是氢键和范德华力,该结果与另一类似研究结果相同[27]。这可能与RES含有多个酚羟基有关,酚羟基是较强的极性基团,可与侧链带羟基的氨基酸(例如丝氨酸、苏氨酸)形成氢键,而OVA中丝氨酸和苏氨酸数量之和占全蛋白氨基酸总数的13.73%[28]。
2.2 同步荧光光谱
在Δλ=1 5 n m 和Δλ=6 0 n m 时O VA 的 同 步 荧 光光 谱,分 别 表 示R E S 对O VA 的T y r 和T r p 残 基 微环境的影响。从图2可知,荧光强度都随着RES浓度增大而减小,其中Δλ=15 nm时,荧光光谱表明RES对OVA的Tyr残基的吸收峰最佳吸收波长有所影响,发生了明显蓝移,从原来的297 nm变为296 nm,这可能是因为RES的添加导致Tyr所处微环境的极性减小[29];当RES添加量达到3.92 μmol/L时,最强吸收峰值强度变化为20.78%,这表示蛋白质构象可能发生了明显变化;而Δλ=60 nm时,光谱显示最佳吸收波长无明显移动,RES对OVA中Trp微环境影响较Tyr的弱,当RES添加量为3.92 μmol/L时,荧光最强吸收峰值荧光强度变化为13.65%。此外,因为RES的添加对Tyr和Trp的微环境影响不一,这说明RES与OVA相互作用时,RES与两种氨基酸的作用距离可能有所不同[30]。
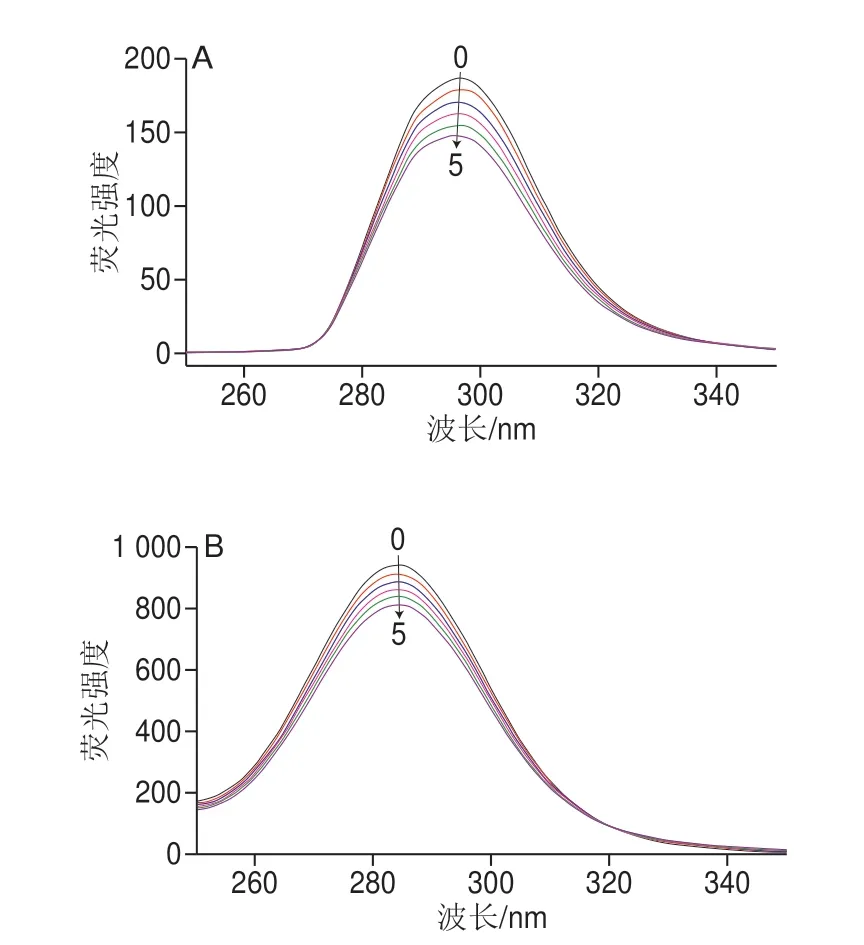
图2 298 K条件下Δλ=15 nm(A)和Δλ=60 nm(B)时OVA的同步荧光光谱Fig.2 Synchronous fluorescence spectra of OVA in the absence and presence of RES at Δλ = 15 nm (A) and Δλ = 60 nm (B)
2.3 三维荧光光谱
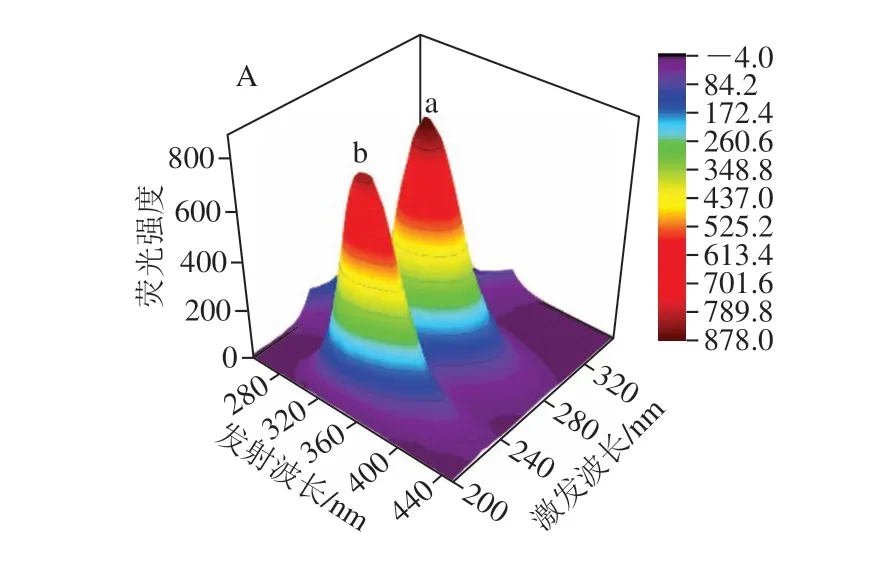
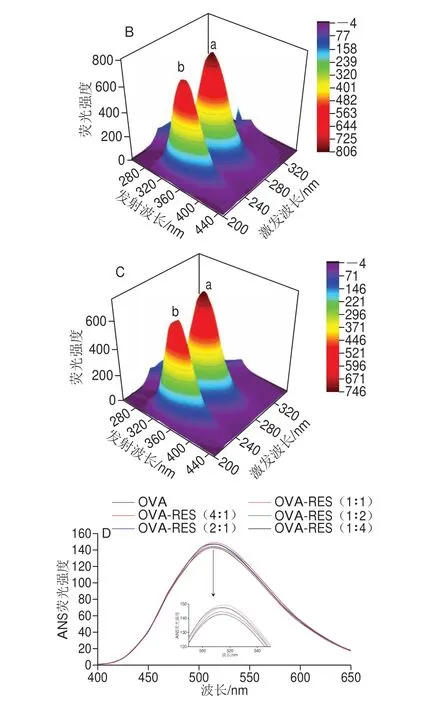
图3 OVA的三维荧光光谱(A、B、C)和外源性荧光光谱(D)Fig.3 3D fluorescence spectra (A, B, C) and changes in ANS-fluorescence (D)intensity of OVA and OVA-RES at different ratios
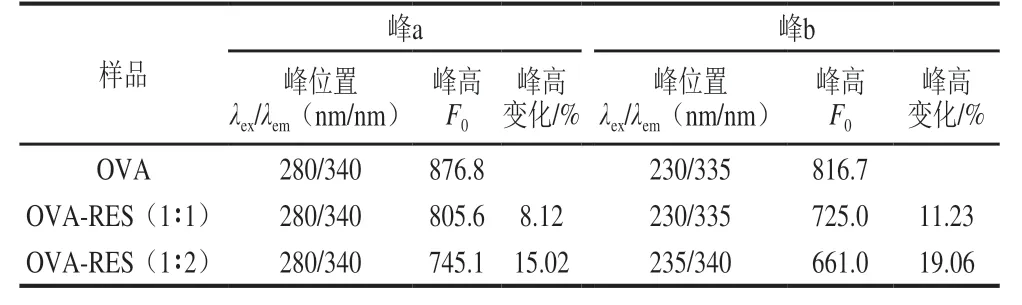
表2 OVA、OVA-RES的三维荧光光谱峰位置和峰高Table 2 Three-dimensional fluorescence parameters of OVA and OVA-RES at different ratios
从图3和表2可知,RES对OVA的三维荧光光谱荧光强度有所影响,其中峰a是Trp和Tyr的特征峰,在三维荧光光谱中表征蛋白质的三级结构,而峰b表征的是蛋白质的多肽链骨架,即二级结构[31]。随着RES的添加,OVA的峰a的峰高明显降低,峰高从原来的876.8减小为805.6和745.1,但是峰位置无明显变化,然而表征二级结构的峰b的峰高、峰位置皆有变化,峰b从原来的(230 nm/335 nm)红移为(235 nm/340 nm),以上信息都表明RES对OVA的氨基酸微环境、蛋白构象有影响,而且从结果看这种相互作用对OVA的二级结构影响更大[32]。
2.4 表面疏水性
从图3D可知,在实验设计的配比范围内,OVA-RES以1∶1物质的量比复合时,RES对OVA的表面疏水性影响最大,且RES导致OVA的表面疏水性增加,其最高吸收峰峰高变化为4.65%(P<0.05)。可能是因为RES作为小分子化合物可以进入OVA内部与之相互作用,从而影响到OVA的疏水性空腔,使得内部的疏水性氨基酸暴露在蛋白质的表面。OVA-RES物质的量比为2∶1对OVA表面疏水性的影响程度与1∶2相当,且都不如物质的量比为1∶1影响大。总之,在实验所设计比例范围中,OVA-RES物质的量比为1∶1是最佳比例,因此后续的实验以1∶1为OVA-RES复合物配比。
2.5 圆二色谱
在光谱中α-螺旋构象在222、208 nm波长处呈负峰,190 nm附近有一个正峰,且峰强度表示结构含量的多少;β-折叠构象在215 nm波长处有一个负峰,在185~200 nm波长处有一较强的正峰[33]。由图4可知,OVA二级结构受到RES的干扰,OVA-RES在190、208 nm和222 nm附近的峰强绝对值较OVA都有所增加,即RES使得OVA的α-螺旋含量增加。复合物和单一蛋白的二级结构含量虽然无显著差异(P>0.05),但是变化主要发生在α-螺旋和β-折叠结构上,而OVA过敏原表位的氨基酸残基组成50%以上是疏水性氨基酸,且主要处于α结构和β结构上面[6],结合表面疏水性结果分析,RES可能是通过氢键、范德华力与OVA相互作用促使疏水性氨基酸环境改变,从而影响到OVA的二级结构。
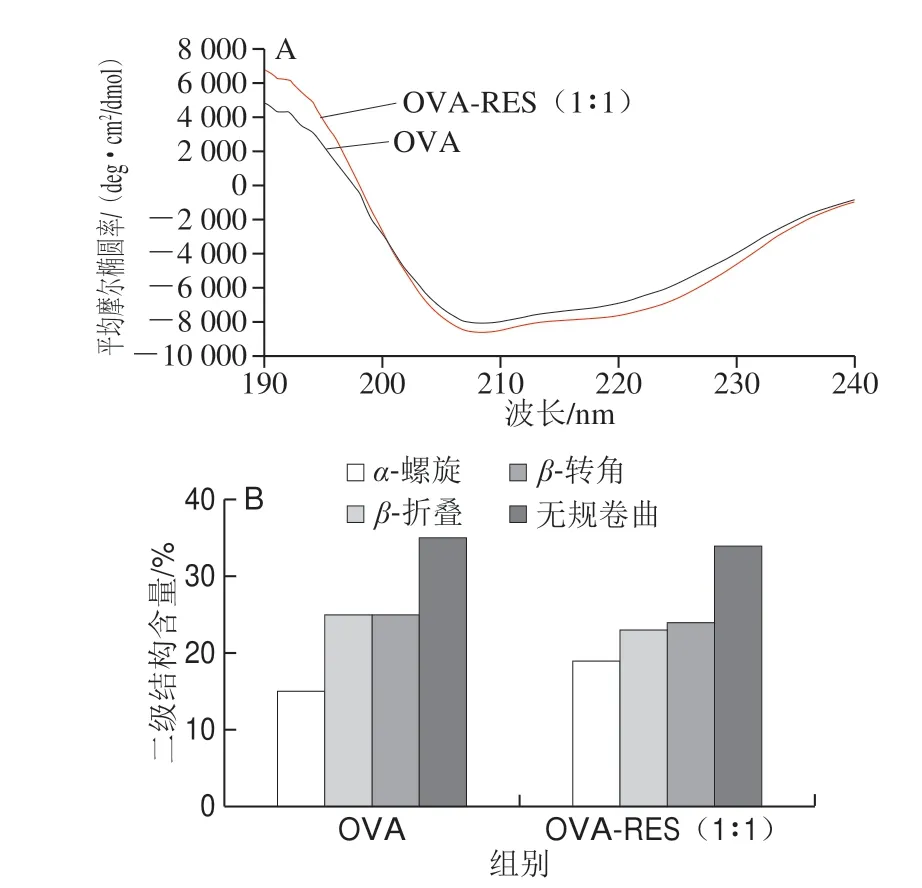
图4 RES对OVA二级结构的影响Fig.4 Effect of RES on secondary structures of OVA
2.6 潜在致敏性

图5 OVA-RES相互作用对OVA体外IgG(A)和IgE(B)结合能力的影响Fig.5 IgG (A) and IgE (B) binding abilities of OVA and OVA-RES
OVA和RES以物质的量比1∶1进行复合,利用进行间接竞争ELISA法测定OVA、OVA-RES的IgG、IgE结合能力,结果以抑制率表示。IC50值越大,样品与IgE的结合能力越弱。从图5可知,RES的加入导致OVA的IC50值显著变小(P<0.05),即RES与OVA相互作用导致OVA与IgG、IgE结合能力变强,即潜在致敏性显著增强。该结果与Shi Xiaolei等[34]的不同,可能是因为文献中的实验对象是动物,橘皮素在其中不仅影响过敏原蛋白的结合位点,而更重要的是橘皮素本身就有较好免疫调节的生物活性,这在其他研究中已有证明[35]。水溶性极差的RES与OVA相互作用,促使蛋白质的疏水性氨基酸暴露在蛋白质表面,蛋白质结构相对展开,内部的IgG、IgE结合位点更多地暴露在表面,表面可及性提升,使得OVA的潜在致敏性增强[6]。
3 结 论
本研究以RES和OVA为研究对象,利用荧光光谱法、圆二色谱法探究OVA-RES复合物相互作用的机理,且从体外血清学角度评价OVA-RES复合物的潜在致敏性。RES通过动态猝灭方式猝灭OVA的内源性荧光,两者最佳复合比为物质的量比1∶1,两者相互作用的主要作用力是氢键、范德华力,属于ΔG<0的自发过程。另外同步荧光、三维荧光、外源性荧光、圆二色谱结果都表明RES可引起OVA氨基酸残基微环境和构象的变化。OVA-RES相互作用导致蛋白质疏水性增加、结构展开,并且可增强OVA的IgG、IgE结合能力,即RES可能会增强OVA的潜在致敏性,这可能与相互作用导致结构展开后暴露更多的过敏原表位有关。
