解淀粉芽孢杆菌DF-7液体培养基优化及其无菌发酵液稳定性研究
2021-03-01敖静李杨高晓梅刘晓辉孙玉禄
敖静 李杨 高晓梅 刘晓辉 孙玉禄
摘要:为确定解淀粉芽孢杆菌DF-7的最优液体培养基及其无菌发酵液的稳定性,利用单因素试验确定了培养基最优碳源为蔗糖,最优氮源为蛋白胨,最优无机盐为KH2PO4;利用响应面法得到最优培养基为蔗糖29.01g/L、蛋白胨24.45g/L、KH2PO46.47g/L,在最优培养条件下DF-7发酵液OD600值为2.365;DF-7无菌发酵液在40~60℃、pH值为4~8之间、紫外线照射90min及-80℃低温条件下均有较好的稳定性,说明DF-7无菌发酵液在耐低温和抗紫外线方面具有较高的研究价值。
关键词:解淀粉芽孢杆菌;液体培养基优化;响应面法;无菌发酵液;抑菌作用;稳定性
中图分类号:S182 文献标识号:A 文章编号:1001-4942(2021)12-0149-06
解淀粉芽孢杆菌(Bacillusamyloliquefaciens)是一类具有促生作用的植物根际细菌,在促进作物生长、防治病害和改良土壤等方面有着重要作用[1]。有研究表明,解淀粉芽孢杆菌具有广泛的抗菌能力,对尖孢镰刀菌(Fusarium oxysporum)、橡胶树褐根病菌(Phellinusnoxius)、橡胶疫霉(Phytophthoraheveae)、小孢拟盘多毛孢(Pestalotiopsismicrospora)、尖孢炭疽病菌(Colletotrichumacutatum)等多种病原真菌具有很好抑制效果,被广泛应用于农作物病害的防治[2-4]。
目前研究表明,解淀粉芽孢杆菌可通过产生脂肽类抗菌活性物质、植物生长激素和酶类等物质[5,6]抑制植物病原菌,预防植物病害。本研究中解淀粉芽孢杆菌DF-7是从辽宁省朝阳市喀左县设施温室土壤中分离所得,具有较高的抗真菌活性,本试验以尖孢镰刀菌黄瓜专化型(F.oxysporumf.sp.cucumerinum)为指示菌,研究DF-7的培养条件和无菌发酵液的稳定性,为开发不同剂型的微生物菌剂和生物农药提供理论依据。
1 材料与方法
1.1 材料和仪器
DF-7菌株:解淀粉芽孢杆菌(Bacillusamyloliquefaciens),由辽宁省微生物科学研究院分离并保存。
病原菌:尖孢镰刀菌黄瓜专化型(Fusariumoxysporumf.sp.cucumerinum),由辽宁省微生物科学研究院分离并保存。
LB液体培养基[7];PDA固体培养基[7];立式压力蒸汽灭菌器(上海申安医疗器械厂型号:LDZX-75KB);恒温摇床(上海世平实验设备有限公司型号:SPF-2008);可见分光光度计(北京普析通用仪器有限责任公司型号:T6新悦);高速冷冻离心机(SIGMA公司型号:3K15);生化培养箱[中仪国科(北京)科技有限公司型号:SPX-450]。
1.2 試验方法
1.2.1 无菌发酵液制备 取一环保存于试管中的DF-7菌株接种到100mLLB液体培养基中,37℃、180r/min培养24h得到种子液。将种子液按2%的比例接种至LB液体培养基中,37℃、180r/min培养24h[8],5000r/min离心10min,0.22μm滤膜过滤,得到无菌发酵液备用。
1.2.2 抑菌作用测定 采用牛津杯法:将1mL尖孢镰刀菌孢子混悬液(1×106个/mL)与10mL融化冷却至45℃左右的PDA培养基混合,倒入平皿中冷却,放置牛津杯,其中加入100μL无菌发酵液,(28±1)℃培养24h,以不含菌的发酵液为空白对照,观察是否有抑菌圈出现,并测量抑菌圈大小,每个处理3次重复[9]。
1.2.3 液体培养基优化单因素试验 以LB液体培养基为基础培养基,用葡萄糖、蔗糖、可溶性淀粉、柠檬酸钠、玉米粉、乳糖和麦芽糖替代LB培养基中碳源酵母膏,替代量为20g/L。用硝酸钠、酵母膏、蛋白胨、氯化铵、尿素、大豆蛋白胨和硫酸铵替代LB培养基中氮源蛋白胨,替代量为20g/L。用硫酸镁、硫酸亚铁、硫酸锰、硫酸锌、磷酸二氢钾和氯化钙替代LB培养基中无机盐氯化钠,替代量为5g/L[10]。接种量为2%,装液量为20%,37℃、180r/min恒温摇床振荡培养24h,测OD600值[11],每个样品重复3次。
1.2.4 响应面法优化设计 根据培养基单因素试验结果,以OD600值为响应值,选择对其影响较显著的蔗糖(A)、蛋白胨(B)和KH2PO4(C)进行响应面优化试验,设置试验为3因素3水平[12](表1)。
1.2.5 无菌发酵液活性成分稳定性试验 热稳定性:将无菌发酵液分别置于40、60、80、100℃水浴中60min和121℃ 20min,冷却至室温[13]。
酸碱稳定性:将无菌发酵液用1mol/L的HCl和NaOH调节pH值分别为2、4、6、8、10,置于冰箱4℃保存24h后[14],将pH值调回至6。
紫外线稳定性:将无菌发酵液敞口置于超净台紫外线灯(功率30W)下照射20、40、60、90min[15]。
反复冻融稳定性:将无菌发酵液于-20℃冷冻2h,室温融化1h,反复冻融3次;将无菌发酵液分别在-20℃和-80℃冰箱中冷冻72h后再融化1h[16]。
以上处理后的样品均用0.22μm滤膜过滤,以未作处理的无菌发酵液(pH=6.3)为对照。利用1.2.2方法观察是否产生抑菌圈,并测量抑菌圈大小,每个处理3个重复。
2 结果与分析
2.1 培养基优化单因素试验
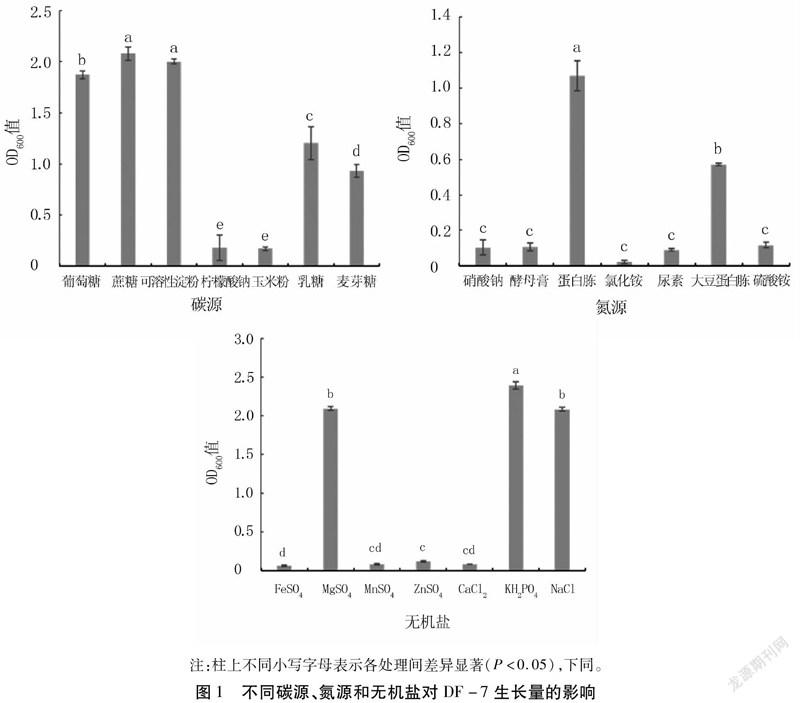
由图1可以看出,不同碳源、氮源和无机盐对DF-7的生长量影响较大。当基础培养基中的碳源被蔗糖取代时DF-7的OD600值最大,为2.077,因此选择蔗糖为碳源;当蛋白胨被其他物质取代时,DF-7的生长量明显减少,所以氮源选择蛋白胨;无机盐的选择中,KH2PO4对DF-7的生长有较明显的促进作用。因此培养基最优碳源、氮源和无机盐分别为蔗糖、蛋白胨和KH2PO4。
2.2 响应面优化结果
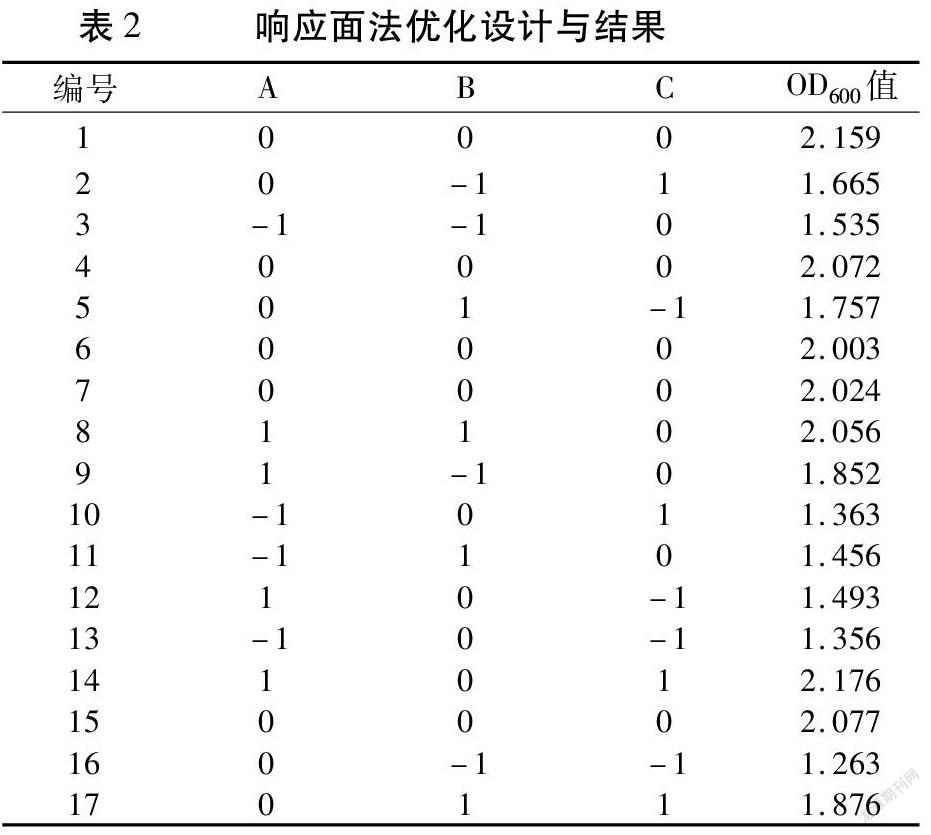
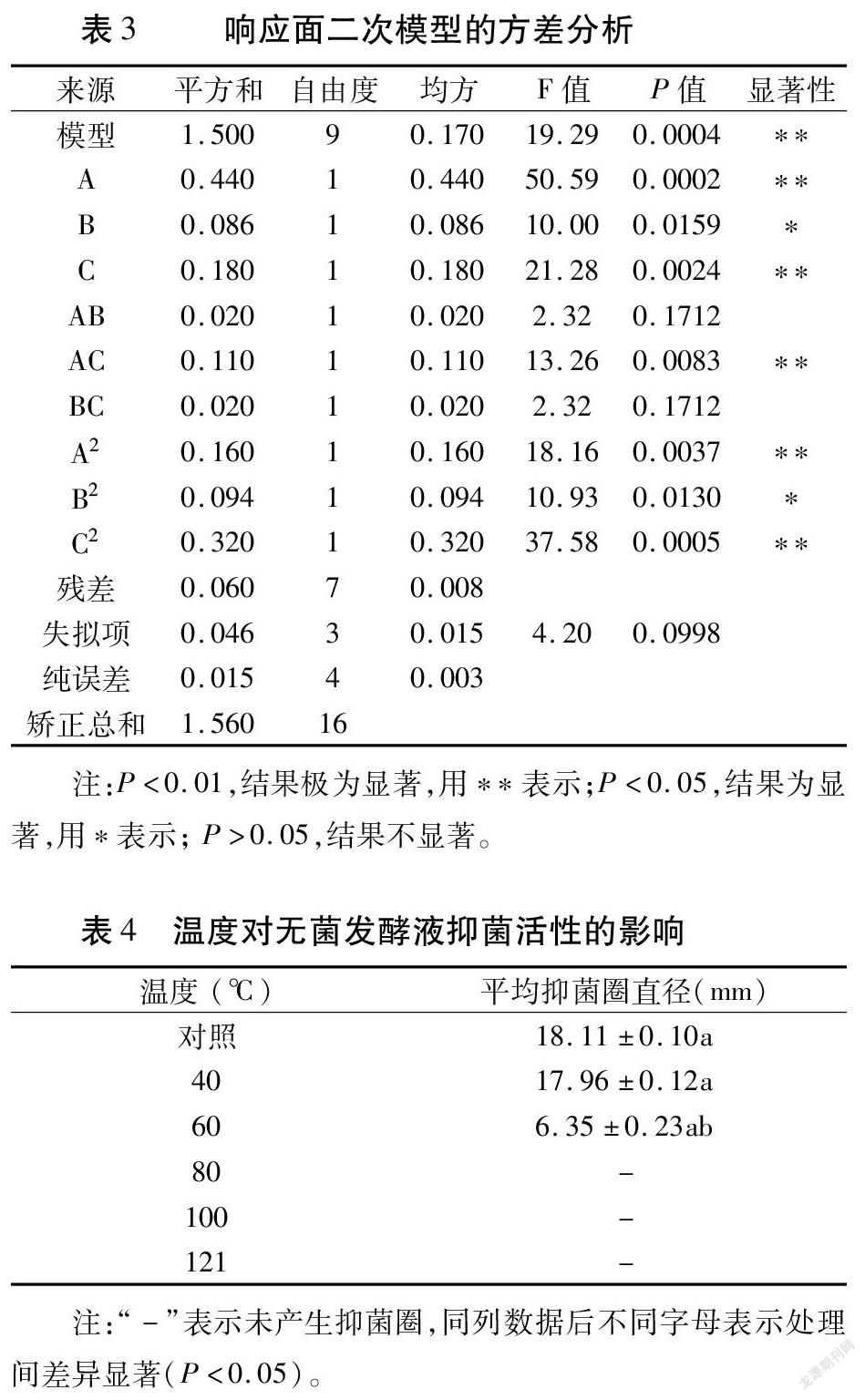
利用DesignExpert8设计试验,以蔗糖、蛋白胨和KH2PO4为响应变量,OD600为响应值,进行响应面设计(表2)。分析结果见表3,得到回归方程为Y=2.070+0.230A+0.100B+0.150C+0.071AB+0.170AC-0.071BC -0.190A2 -0.150B2-0.280C2。该模型P=0.0004(P<0.01),表明回归方程具有统计学意义;其中A、C、AC和A2、C2因素对DF-7的生长量影响极显著(P<0.01),B和B2因素对DF-7的生长量影响显著(P<0.05);AB和BC因素对DF-7的生长量影响不显著(P>0.05)。
2.3 响应曲面分析及最佳条件验证
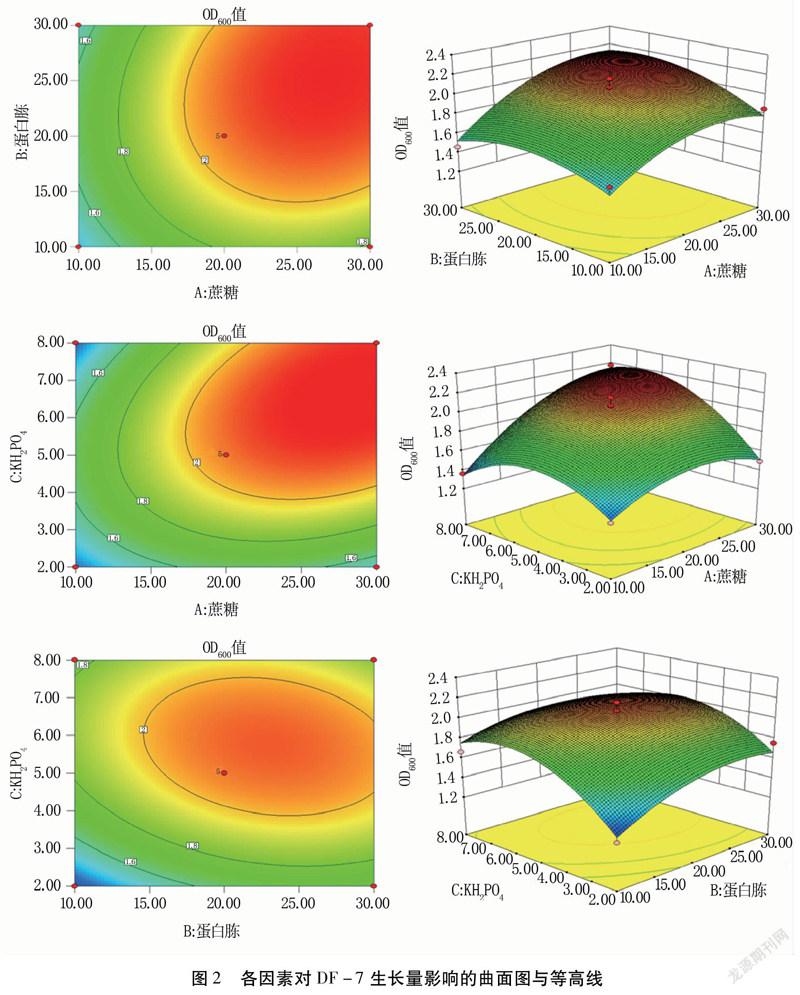
利用DesignExpert8对数据进行分析,构建响应曲面。通过曲面模型(图2)可知,当蔗糖29.01g/L、蛋白胨24.45g/L、KH2PO46.47g/L時DF-7的OD600值为2.233,验证试验OD600值为2.365,说明该模型能够较好地反映实际情况。
2.4 无菌发酵液活性成分稳定性试验
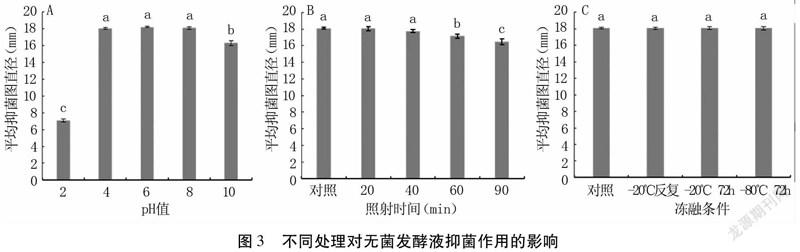
由表4可以看出,随处理温度升高抑菌圈直径逐渐减小,40℃时抑菌圈直径为17.96mm,60℃时抑菌圈直径(6.35mm)明显减小,当处理温度达到80℃时,无菌发酵液未产生抑菌圈,说明温度高于80℃以后,无菌发酵液失去了抑菌活性。由图3A可以看出,pH=2时,抑菌圈直径为7.3mm,当pH在4~8之间,抑菌圈直径基本无变化,当pH =10时,抑菌圈明显变小(16.3mm),说明抑菌作用下降;随着紫外线照射时长的增加,抑菌作用有所下降,但不明显,照射90min后抑菌圈直径仍有16.47mm,说明在90min内DF-7的无菌发酵液具有较好的抗紫外线能力(图3B);由反复冻融试验可知,3种处理方式对无菌滤液抑菌活性影响不大(图3C),说明无菌滤液在低温下具有较好的稳定性。
3 讨论与结论
本研究利用单因素试验得到解淀粉芽孢杆菌DF-7的最优碳源为蔗糖,最优氮源为蛋白胨,最优无机盐为KH2PO4,通过响应面法得到最优培养基为蔗糖29.01g/L、蛋白胨24.45g/L、KH2PO46.47g/L,最优培养条件下DF-7发酵液OD600值为2.365。
本研究从4个方面考察了DF-7无菌发酵液的稳定性。在温度小于80℃时,随温度增加,无菌发酵液抑菌作用下降,说明发酵液中活性成分对高温较敏感,当温度高于80℃,未出现抑菌圈,这可能是由于高温导致发酵液中的活性物质变性[17],失去了抑菌作用。秦楠等[18]发现一株产抗菌蛋白的解淀粉芽孢杆菌,在40~80℃范围内抗菌蛋白具有较好的稳定性。发酵液对酸碱度有一定的要求,pH值在4~8范围内稳定性较好,极酸或极碱的环境下发酵液中活性成分可能变性失活[19],导致抑菌作用明显下降。张娟等[20]研究了解淀粉芽孢杆菌活性成分中大环内酯类抗生素的化学性质,结果表明在酸或碱条件下均不稳定,容易失活。无菌发酵液对紫外线具有一定的稳定性,90min内发酵液的抑菌作用基本不变。Wang等[21]由枯草芽孢杆菌中分离到抗菌蛋白,也具有一定的抗紫外线能力。-80℃下对无菌发酵液活性影响不大,说明发酵液在低温条件下也具有较好的稳定性。以上结果说明DF-7无菌发酵液在耐低温和抗紫外线方面具有研究价值,下一步将对DF-7无菌发酵液中活性成分以及活性物质的分离进行研究。
