阿帕替尼联合肝动脉化疗栓塞术治疗中晚期肝癌的临床效果及安全性
2021-02-28陈巧辉陈德志王琦王佳坤
陈巧辉,陈德志,王琦,王佳坤
肝癌属于临床常见多发恶性肿瘤,具有发病率高、病情进展快及病死率高等特点,且根据病理将其分为肝细胞性肝癌(HCC,占85.0%~90.0%)、胆管细胞肝癌及混合型肝癌3 种类型[1]。由于肝癌发病早期临床症状缺乏典型性,多数患者确诊时已经是中晚期,增加治疗难度。肝动脉化疗栓塞术(TACE) 是中晚期肝癌患者常用方法,借助栓塞剂封闭肿瘤主要供血血管,能阻断、减少肿瘤血供,导致肿瘤组织发生缺氧缺血坏死,可杀死肿瘤细胞[2]。但是,TACE 治疗时部分患者会刺激肿瘤细胞调节,增加肿瘤新生血管而影响患者预后。阿帕替尼属于血管内皮生长因子受体-2(VEGFR-2) 抑制剂,能抑制肿瘤血管内皮细胞的增殖,改变肿瘤的多耐药性,巩固化疗药物效果,但是药物的安全性及对患者远期预后的影响研究较少[3]。本研究观察阿帕替尼联合TACE 治疗中晚期肝癌患者的临床效果及安全性,报道如下。
1 资料与方法
1.1 临床资料 选取2018 年10 月-2019 年12 月中国人民解放军联勤保障部队第九一○医院收治的中晚期肝癌患者96 例为研究对象,根据随机数字表法分为观察组和对照组,各48 例。观察组男33 例,女15 例;年龄37~75(57.15 ±6.79) 岁;病程1~6(3.31 ±0.57) 年;体质指数(BMI) 17~29(23.79 ±3.26) kg/m2;肝功能分级:A 级26 例,B 级22 例;患者中高外转移5 例,血管侵犯4 例。对照组男31 例,女17 例;年龄39~74(56.98 ± 6.71) 岁;病程1~5(3.23 ±0.51) 年;BMI 19~28(23.50 ±3.21) kg/m2;肝功能分级:A 级29 例,B 级19 例;患者中高外转移4 例,血管侵犯6 例。2 组患者临床资料比较差异无统计学意义(P>0.05),具有可比性。研究经医院医学伦理委员会审核批注,患者或家属知晓研究内容并签署知情同意书。
1.2 纳入及排除标准 纳入标准:(1) 符合肝癌诊断标准[4],经穿刺活检、病理检查确诊;(2) 肝功能分级为A、B 级,卡氏功能状态(KPS) >60 分;(3) 均无TACE、阿帕替尼治疗禁忌证,且患者均可耐受。排除标准:(1) 精神异常、肝功能失代偿者;(2) 凝血功能异常、伴有自身免疫系统疾病、其他部位恶性肿瘤者;(3) 重要脏器功能障碍、血液系统疾病或认知功能异常者。
1.3 方法 对照组采用TACE 治疗。治疗前完善患者各项检查,术前常规给予盐酸昂丹司琼注射液[常州兰陵制药有限公司生产,国药准字H19980012,规格:2 ml ∶4 mg(以C18H19N3O 计) ]8 mg 止吐,术后给予保肝药物,尽可能维持患者电解质酸碱平衡。借助改良Seldinger 穿刺法经皮—股动脉穿刺,待穿刺成功后插入导管,并完成肝动脉造影,进一步了解肿瘤情况,结合患者体质量、身体状态确定栓塞剂的剂量。将导管置入肝脏肿瘤供血血管中,并注入注射用表柔比星[辉瑞制药(无锡) 有限公司生产,国药准字H20000496,规格:10 mg) ]30 mg、注射用洛铂(海南长安国际制药有限公司生产,国药准字H20080359,规格:10 mg) 30 mg,碘油同时发挥栓塞剂和载体功能(需与化疗药物混合后注入,结合患者情况选择合适的栓塞球辅助栓塞) 。观察组则在对照组基础上联合阿帕替尼治疗。患者于TACE 手术后第4 天开始口服阿帕替尼,初始剂量每次予甲磺酸阿帕替尼片[江苏恒瑞医药股份有限公司生产,国药准字H20140103,规格:0.25 g(以阿帕替尼计) ]500 mg 口服,每天1 次;对于用药期间出现与阿帕替尼相关的Ⅲ级以上的不良反应时,药物剂量减半或停药,连续用药4 周。
1.4 观察指标及疗效评定标准[5](1) 治疗4 周后评价患者近期疗效。完全缓解(CR):病灶消失,4 周无新发病灶;部分缓解(PR):病灶消失>50.0%,4 周未见新发病灶;稳定(SD):病灶变化不明显,但是未见新发病灶;进展(PD):病灶增大>25%,伴有新发病灶。总缓解率=(CR+PR)/总例数× 100%。(2) 免疫功能。2 组用药前、用药4 周后采用流式细胞仪测定总T 淋巴细胞、总B 淋巴细胞、CD3+CD4+、NK 细胞(CD3-/CD16+CD56+) 及Ts细胞(CD3+CD8+)水平[6]。(3) VEGF、基质金属蛋白酶9(MMP-9) 水平。2 组用药前、用药4 周后采用酶联免疫吸附试验测定患者VEGF、MMP-9 水平,试剂盒购自于美国Sigma 公司[7]。(4) 不良反应:记录2 组治疗期间恶心呕吐、血压波动、皮肤瘙痒、腹泻便秘及手足综合征发生率。
1.5 统计学方法 采用SPSS 24.0 软件对数据进行统计分析。计量资料以表示,组间比较应用t检验;计数资料以频数/率(%) 表示,组间比较应用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 近期疗效比较 治疗4 周后,观察组近期总缓解率为60.42%,高于对照组的37.50%,差异有统计学意义(χ2=5.044,P=0.025) 。见表1。
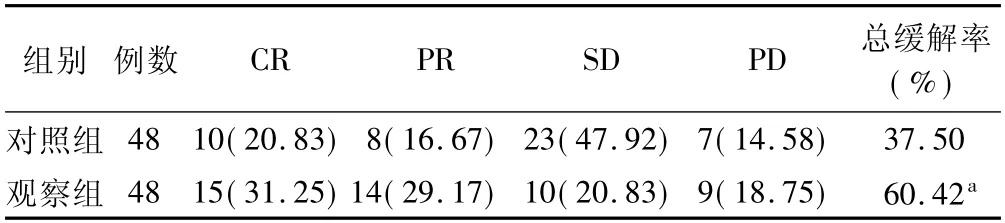
表1 2 组患者近期疗效率比较 [例(%) ]
2.2 免疫功能指标比较 治疗前,2 组患者总T 淋巴细胞、总B 淋巴细胞、CD3+CD4+、NK 细胞、Ts 细胞比较差异无统计学意义(P>0.05) ;治疗4 周后,2 组总T 淋巴细胞、总B 淋巴细胞、CD3+CD4+、NK 细胞及Ts 细胞均较治疗前升高,且观察组高于对照组,差异均有统计学意义(P<0.01) 。见表2。
表2 2 组患者治疗前后免疫功能指标比较 ()

表2 2 组患者治疗前后免疫功能指标比较 ()
2.3 VEGF、MMP-9 水平比较 治疗前,2 组患者VEGF、MMP-9 水平比较差异无统计意义(P>0.05) ;治疗4 周后,2 组VEGF 水平较治疗前升高、MMP-9水平较治疗前降低,且观察组升高或降低幅度大于对照组,差异均有统计学意义(P<0.01) 。见表3。
表3 2 组患者治疗前后VEGF、MMP-9 水平比较 ()
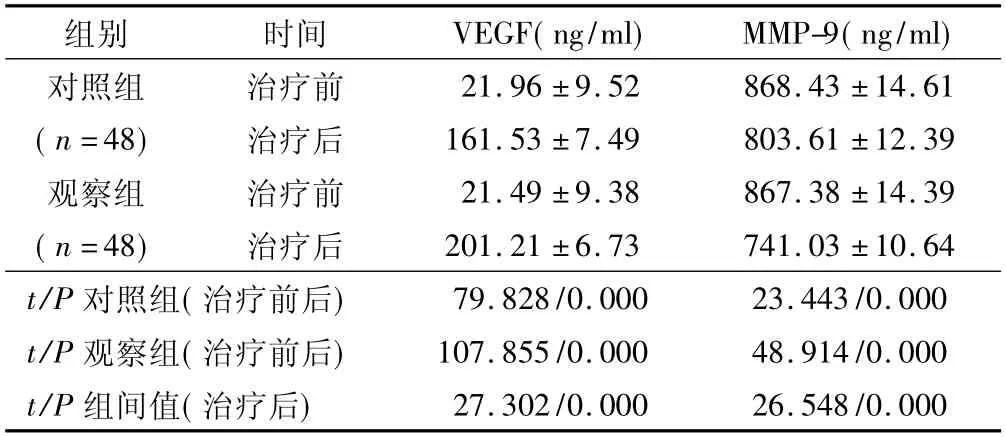
表3 2 组患者治疗前后VEGF、MMP-9 水平比较 ()
2.4 不良反应比较 2 组患者治疗期间不良反应总发生率比较差异无统计学意义(χ2=0.643,P=0.423) 。见表4。
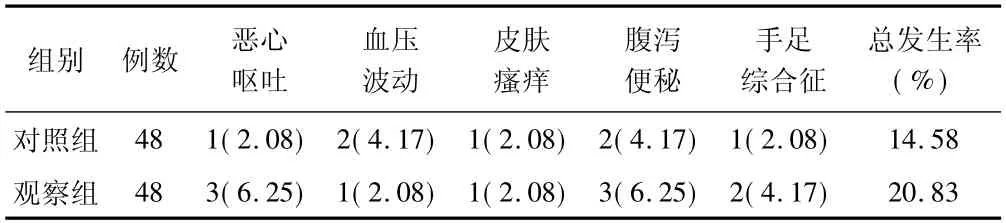
表4 2 组患者不良反应发生情况比较 [例(%) ]
3 讨论
肝癌具有发病率高、病死率高及治愈率低等特点,由于多数肝癌患者症状不明显,导致患者丧失手术治疗时机。TACE 是中晚期肝癌患者中常用的治疗方法,能栓塞肿瘤血管,使得肿瘤细胞缺少血供,抑制肿瘤的生长。但是,单一的使用TACE 难以杀死肿瘤细胞,且随着治疗时间的延长,将会引起肿瘤新生血管代偿,成为患者失败的重要原因[8]。
近年来,阿帕替尼在中晚期肝癌患者中得到应用,且效果较佳[9]。本研究中,观察组治疗4 周后近期总缓解率高于对照组,结果看出,阿帕替尼联合TACE 能获得较高疗效率,可获得良好的治疗预后。阿帕替尼是我国首个自主研发的抗肿瘤靶向药物,最初用于胃癌患者中,药物能与血管内皮生长因子相关靶点竞争性结合,从而能阻止下游信号的传导。同时,阿帕替尼能抑制肿瘤新生血管生成,减少肿瘤血供,发挥良好的抗肿瘤目的。肝癌的发生、发展是一个多因素过程,多与机体免疫功能紊乱有关,而治疗过程中保证患者免疫功能是临床治疗难点。细胞免疫是机体对抗肿瘤及其他疾病的主要机制,CD3+为成熟T 细胞,为主要的免疫细胞,可分为CD4+、CD8+2 个亚群,且二者处于动态平衡状态。对于中晚期肿瘤,将会引起CD4+T 淋巴细胞水平升高,引起机体免疫失衡。临床上,阿帕替尼联合TACE 用于中晚期肝癌患者中能发挥不同治疗方法优势,有助于调节患者免疫水平,发挥抗肿瘤作用。结果显示,治疗4 周后,2 组总T 淋巴细胞、总B 淋巴细胞、CD3+CD4+、NK 细胞及Ts 细胞均较治疗前升高,且观察组高于对照组,差异均有统计学意义。说明阿帕替尼联合TACE 能调节中晚期肝癌患者免疫水平。结果还显示,治疗4 周后,2 组VEGF 水平较治疗前升高、MMP-9 水平较治疗前降低,且观察组升高或降低幅度大于对照组,差异均有统计学意义;2 组患者治疗期间不良反应总发生率比较差异无统计学意义。结果说明阿帕替尼能降低肿瘤血管形成,且药物安全性较高,有助于提高患者治疗耐受性、依从性。既往研究表明,分子靶向药物治疗是中晚期肝癌的治疗研究热点,具有不良反应少、选择性强等特点,能为患者开辟新的思路,且与TACE 联合发挥协同作用[10]。
综上所述,阿帕替尼联合TACE 用于中晚期肝癌患者中能获得较高的疗效,有助于改善患者免疫功能,调节VEGF、MMP-9 水平,且不良反应发生率低,值得推广应用。
