食品中链霉素的可视化免疫亲和凝胶柱快速检测
2021-02-28王敏思朱文博赵凌燕
王敏思,朱文博,赵凌燕,柳 双,宋 洋
(1.天津师范大学 生命科学学院,天津300387;2.天津师范大学 天津市动植物抗性重点实验室,天津300387)
链霉素(streptomycin,STR)是一种氨基酸糖苷类抗生素药物[1],对结核杆菌和许多革兰氏阴性杆菌有较强的抗菌作用[2],是目前我国畜牧业和水产业中的常用药物之一[3],但同时也导致畜禽和水产有机体以及产物(如奶类、肉类等)中高浓度链霉素药物滞留和蓄积[4],并以食物链方式进入人体,危害人类健康[5].链霉素有严重的肾毒性和耳毒性,长期摄入有链霉素残留的食物会造成肾脏及前庭功能和耳蜗神经永久性损伤[6],食物中残留的链霉素可能会造成过敏反应甚至引起休克[7],研究表明链霉素还具有潜在的致畸作用[8].临床上,链霉素已逐渐被其他效果类似的药物所取代,但畜牧业和水产业中仍在继续使用[9].因此建立准确可靠、简单有效的检测方法很有必要.
目前,链霉素在多个国家(地区)均允许使用,但因其对人体的危害性,我国及世界其他国家(地区)对其残留限量均做出了规定.其中,我国农业部规定牛奶、猪肉和牛肉中链霉素的最高残留限量分别为200、600 和600 μg/kg:欧盟国家及日本均规定牛奶、猪肉和牛肉中链霉素的最高残留限量分别为200、500 和500 μg/kg[10-11].国内外定量链霉素残留的检测方法以传统的高效液相色谱法(HPLC)[12-13]、高效液相色谱-串联质谱法(HPLC-MS)[14-16]和酶联免疫法(ELISA)[17-19]为主,但传统方法存在成本高、自动化程度低、时间较长等问题[20].近年来,简单、快速的新型免疫化学分析方法逐步被建立并广泛应用[16].
免疫亲和凝胶柱(IATC)是基于免疫亲和原理发展起来的一种新型的可视化快速检测方法[21-23],该方法将抗体固化在溴化氰活化的琼脂糖凝胶上形成检测层和质控层,利用抗原抗体的特异性反应,最终根据检测层颜色变化情况确定检测结果[24-25].同传统方法相比,该方法具有操作容易、耗时短等优点[17]. 2012 年,Meng 等[26]建立了IATC 法现场快速筛查蜂蜜和水产中氯霉素的残留,样品经简单预处理即可进行检测,整个检测仅需10 min 即可完成,该方法的检出限(LOD)为1 μg/kg;2014 年,Xu 等[27]建立了IATC 法检测牛乳、肌肉和肝脏中安普霉素的残留,检测时间相较ELISA 方法缩短20 min,对牛乳、鸡肉和肝脏的检出限分别为3、3 和10 μg/kg;2016 年,Arduini 等[28]建立了IATC法检测葡萄酒中的黄曲霉毒素,整个程序在10 min 内即可完成,检出限为0.3 μg/L.
本研究基于链霉素多克隆抗体,经简单快速的样品前处理及反应条件优化,建立牛奶和肉类中链霉素残留的可视化免疫亲和凝胶柱检测方法,对实际样品进行测定并与高效液相色谱-串联质谱进行方法比对,其结果对实现牛奶和肉类中链霉素高效、现场化的快速筛查具有重要应用价值.
1 材料与方法
1.1 材料与试剂
链霉素,河北百灵威超精细材料有限公司;酶标二抗(羊抗鼠),中国上海斯信生物技术有限公司;辣根过氧化物酶(HRP)抗体,北京庄盟生物技术公司;β-环糊精,德国Merck 公司;过氧化氢脲、3,3′,5,5′-四甲基联苯胺(TMB)、CNBr-Sepharose 4B 溴化氰活化的琼脂糖凝胶、Proclin 300 抑菌素,美国Sigma 公司;二甲基亚砜(DMSO),中国J&K 公司;甘氨酸,天津联星生物技术有限公司;NaH2PO4·2H2O,天津金海华兴科技发展有限公司;Na2HPO4·12H2O,天津市大茂化学试剂厂.
1.2 仪器与设备
全波长酶标仪(Labsystems)、数显型酶标板振荡器,美国IKA 公司;SPE 柱(1 mL)、聚乙烯垫片,美国Agilent Technologies 公司.
1.3 主要溶液
5 mg/mL 链霉素多克隆抗体和5 mg/mL 链霉素酶标抗原,均由本实验室合成;偶联缓冲液(0.01 mol/L碳酸钠缓冲液,pH 值=8.3);封闭缓冲液(10 mL 偶联缓冲液加0.3 g 甘氨酸);平衡淋洗液(0.01 mol/L 乙酸钠缓冲液,pH 值=4.0);PBS(0.01 mol/L 磷酸钠缓冲液,pH 值= 7.4);PBST(1 L PBS 加0.5 g 吐温20);封闭胶(CNBr活化的琼脂糖凝胶经由甘氨酸封闭获得);抗体胶(将500 μL STR 抗体固化在CNBr 活化的琼脂糖凝胶上);HRP 抗体胶(将10μL 的1mg/mLHRP 抗体固化在CNBr 活化的琼脂糖凝胶上).
1.4 实验方法
利用IATC 法将链霉素抗体和辣根过氧化物酶抗体分别固化在溴化氰活化的琼脂糖凝胶上形成检测层和质控层,然后同时加入待测样品液和酶标抗原.在进行检测时,链霉素会被特异性地结合到检测层,与酶标抗原产生竞争;剩下未与检测层结合的酶标抗原与对照层的HRP 抗体结合,最后加入底物后根据检测层颜色变化情况确定检测结果.当检测样品中的链霉素达到一定浓度的,可使凝胶柱检测层的颜色消失,对照层可作为判断凝胶柱是否有效的参照,若不显色则说明柱子失效.可视化凝胶柱检测链霉素方法的具体原理如图1 所示.
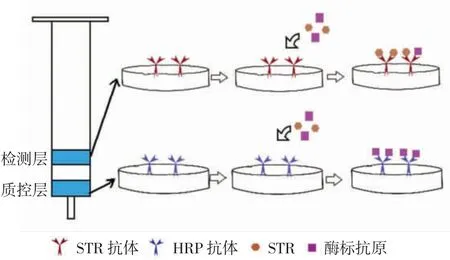
图1 可视化凝胶柱检测链霉素方法的原理Fig.1 Schematic diagram of the detection of streptomycin by the visual gel column method
1.4.1 凝胶柱的制备
免疫亲和凝胶柱主要由下层的检测层和上层的质控层组成:质控层由最底部的垫片、150 μL 抗HRP抗体胶和封闭胶的混合物及第2 个垫片组成:检测层由第3 个垫片、150 μL STR 抗体胶和封闭胶的混合液及第4 个垫片组成.检测层和质控层中间留出3 mm的空气间隔,防止加入底物后试剂迁移造成显色结果误差.
1.4.2 检测步骤和检测条件的优化
首先用0.5 mL PBS 分别稀释酶标抗原与STR 标准品或样品溶液,预混合后从进样口加入到柱子中.然后用3 mL PBST 和2 mL PBS 分别冲洗柱子,以去除未结合的酶标抗原和标准品.最后加入300 μL 底物液,反应后排出,继续反应后,观察显色结果.以目测检测层蓝色消失时STR 的最小浓度定义为凝胶柱的检出限.
为了缩短检测时间和提高灵敏度,需要进行抗体特异性评估,并且对STR 抗体胶和HRP 抗体胶的稀释倍数(STR 抗体胶分别稀释5、10、25、50 倍:HRP 抗体胶分别稀释10、50、100、200、300 倍)、酶标抗原稀释倍数(酶标抗原分别稀释5 000、10 000、20 000 倍)、缓冲液pH 值(设置缓冲液pH 值分别为5.5、7.4、8.5)、反应时间(设置反应时间分别为0.5、1、2、3、5 min)和显色时间(设置显色时间分别为0.5、1、2、3、5 min)进行优化,从而达到快速可视化检测的目的.整个反应在室温条件下进行.
1.4.3 样品的准备与处理
牛奶样品:取5 mL 牛奶样品于10 mL 离心管中,8 000 r/min 离心10 min,取中清液用冰醋酸调节pH值至4.6,震荡混匀后5 000 r/min 离心5 min,取上清液.处理后的样品液体储存于棕色小瓶中,-20 ℃储存备用,用缓冲液稀释即可进行检测.
肉类样品:取1 g 肉类组织样品切碎置于10 mL离心管中,加入2 mL PBS(pH 值=7.4),涡旋5 min后5 000 r/min 离心5 min.取上清液,加入2 mL 正己烷充分震荡后静置5 min,取下层液体加入2 mL 5%的三氯乙酸溶液,震荡后5 000 r/min 离心5 min,取上清液.处理后的样品液体储存于棕色小瓶中,-20 ℃储存备用,用缓冲液稀释即可进行检测.
所有样品均购买于天津当地市场.
1.4.4 与HPLC-MS 和ELISA 试剂盒的比对实验
取牛奶、牛肉、猪肉共12 件空白样品,编号1#~12#,添加链霉素标准品制成盲样用于IATC 和HPLCMS 检测. HPLC-MS 检测条件及方法参考标准方法GBT22945-2008[29].试剂盒选用Beacon 商业链霉素竞争酶联免疫检测试剂盒.
样品用1.4.3 方法处理后接入Oasis HLB 萃取柱配置羧酸型固相萃取柱,待样品全部通过后分别用10 mL 水和10 mL 20%的甲醇溶液冲洗柱子,弃去液体及Oasis HLB 萃取柱,用2 mL 0.01mol/L 的庚烷磺酸钠溶液洗脱羧酸型固相萃取柱,得到的样品洗脱液过0.22 μm 水系滤膜后即可进行检测.
1.4.5 凝胶稳定性实验
一般的免疫亲和凝胶在4 ℃下密封保存,时间过长可能会影响抗体蛋白的活性,从而使抗体抗原结合反应能力下降,或使抗体与凝胶分子分离,显色程度降低.因此,本研究在4 ℃下密封保存免疫亲和凝胶,选取同一批次不同保存时间的凝胶进行比较,观测凝胶的稳定性.
2 结果与分析
2.1 检测条件的确定
本研究对IATC 法检测STR 的检测条件进行优化,优化条件为:检测层STR 抗体胶和质控层HRP 抗体胶分别用封闭胶以1 ∶20 和1 ∶150 的比例稀释,酶标抗原稀释10 000 倍,缓冲液液pH 值为7.4,样品反应时间为2 min,显色时间为2 ~3 min.在此条件下检测层与质控层显现出清晰的蓝色且颜色一致,如图2所示,可以进行进一步的检测.

图2 链霉素可视化凝胶柱检测条件优化Fig.2 Optimization of the detection conditions for STR by visual gel detection column
2.2 检出限的确定
可视化免疫亲和凝胶柱检测STR 的结果如图3所示.随着STR 浓度的升高,凝胶柱检测层的颜色从深到浅再到无.当STR 浓度达到10 μg/L 时,凝胶柱的检测层接近无色,最终确定可视化免疫亲和凝胶柱检测STR 方法的检出限为10 μg/L.

图3 可视化凝胶柱检测链霉素检出限的测定Fig.3 Determination of the detection limit of streptomycin by visual gel column
2.3 抗体特异性的评估
利用免疫亲和凝胶柱对链霉素及双氢链霉素(dihydrostreptomycin)、庆大霉素(gentamicin)、卡那霉素(kanamycin)、氯霉素(chloramphenicol)、硫酸新霉素(neomycin sulfate)和妥布霉素(tobramycin)的交叉反应来评估链霉素抗体的特异性,结果如图4 所示.由图4 可以看出,链霉素和双氢链霉素含量为10 μg/kg时凝胶柱检测层颜色消失,其他抗生素药物含量为10 000 μg/kg 时,凝胶柱检测层仍会出现明显的蓝色,表明本研究中的IATC 方法对链霉素和双氢链霉素有良好的特异性,与其他抗生素药物没有交叉反应.双氢链霉素是链霉素的衍生物,与链霉素仅相差1 个基团,与链霉素有相似的功效,在使用时常同时出现,因此可以同时检测.

图4 STR 抗体与其他抗生素药物的交叉反应Fig.4 Cross-reactivity of STR antibody with other veterinary drugs
2.4 样品的检测
利用可视化ITAC 法对添加了链霉素标准品的牛奶、牛肉和猪肉3 种样品分别进行检测,结果如图5 所示.由图5 可以看出,当牛奶、牛肉和猪肉的链霉素含量分别为20、80和80 μg/kg 及以下时,凝胶柱检测层的蓝色与质控层一致;当添加链霉素含量分别达到40、160、160 μg/kg 时,凝胶柱检测层的蓝色相较质控层明显变浅;当添加链霉素含量分别达到80、320、320 μg/kg 时,凝胶柱检测层的蓝色消失.因此,本研究建立的可视化ITAC 方法检测牛奶中链霉素残留的样品检出限为40 μg/kg,牛肉和猪肉中链霉素残留的样品检出限均为160 μg/kg.

图5 ITAC 法对3 种添加了链霉素标准品的样品的检测Fig.5 Detection of three samples added with streptomycin standard by ITAC method
2.5 可视化IATC 与HPLC-MS 方法和ELISA 试剂盒的比较
取牛奶、牛肉、猪肉共12 件空白样品,编号1#~12#,添加链霉素标准品制成盲样用于ITAC 法和HPLC-MS 法检测,结果如表1 所示.由表1 可以看出,IATC 法最终检测出含有链霉素的样品共4 件,其中牛奶1 件、牛肉2 件、猪肉1 件,其结果与HPLC-LS 方法检测结果一致.

表1 实际样品中链霉素的检测Tab.1 Detection of streptomycin in actual samples μg/kg
IATC 只需要1 min 安装时间和较短的洗涤过程,反应过程仅需2 min,显色过程只需要2~3 min,结果是不用任何仪器直接用肉眼判断.商业链霉素ELISA试剂盒需要较长的培养过程,孵育和洗涤需要75 min,反应需要30 min,显色需要10~15 min,还需要用仪器测量吸光度值和数据分析. IATC 所需的总测试时间(大约7 min)远远小于使用商业链霉素ELISA 试剂盒所需的测试时间(大约120 min).虽然IATC 方法灵敏度低于商业链霉素ELISA 试剂盒,但也远低于我国及欧盟等各国所规定的限量标准.因此,IATC 方法检测牛奶及肉类中链霉素的残留比商业链霉素ELISA 试剂盒更简单、更快速,适用于牛奶及肉类中链霉素残留的快速筛查.
2.6 凝胶稳定性实验
分别选取制备当天、保存1 个月、3 个月、6 个月的凝胶制柱进行检测,结果如图6 所示.由图6 可以看出,随着凝胶柱保存时间的增加,其灵敏度以及条带信号颜色都会有所下降. 当凝胶储存6 个月时,凝胶柱检测标准品时,检测线和质控线颜色几乎消失.因此确定凝胶最长保存时间为3 个月.

图6 免疫亲和凝胶的稳定性Fig.6 Stability of immunoaffinity gel
3 结论
本研究建立了一种可检测牛奶及肉类中链霉素残留的可视化免疫凝胶柱方法.该方法的检出限为10 μg/kg,整个检测过程仅需10 min.牛奶和肉类样品通过简单处理后即可进行检测,牛奶中链霉素的检出限为40 μg/kg,肉类中链霉素的检出限为160 μg/kg.该方法耗时短,操作简单,对于实现牛奶和肉类中链霉素残留的高效、现场化快速筛查具有重要应用价值.
