痛风雏鹅肠道菌群通过TLR4/MyD88/NF-κB通路促进肾损伤的研究
2021-02-27朱道仙
朱道仙,吴 植,陆 江,黄 涛,刘 莉*
(1.江苏农牧科技职业学院动物医学院,泰州 225300;2.江苏农牧科技职业学院宠物科技学院,泰州 225300;3.江苏省兽用生物制药高技术研究重点实验室,泰州 225300)
我国是养鹅大国,养鹅业发展迅速,但近年来全国范围内暴发了雏鹅痛风,导致雏鹅大量死亡,造成巨大经济损失[1]。雏鹅痛风发病机制涉及多个方面,包括尿酸(UA)合成过多[2]、分解减少[3]、排泄障碍[4]及病毒等[5]。肾是UA排泄的主要器官,雏鹅肾发育不成熟易损伤,从而阻碍UA的排泄,是形成痛风的病理基础。因此,减少肾损伤对降低雏鹅痛风发病率具有重要意义。尽管目前研究发现了一些易导致鹅肾损伤的因素,如星形病毒[6],并采取了一些补救措施,但结果并不令人满意,亟需进一步研究。
近年研究发现,肠道菌群紊乱在糖尿病肾病、慢性肾衰竭、IgA肾病等多种肾疾病的发生发展中起着重要作用,这些细菌已被证明具有原发性炎症作用和肾毒性[7-9]。也有研究表明,TLR4/MyD88/NF-κB信号通路在肾损伤和炎症中具有关键性作用[10]。肠道菌群或其产生的脂多糖(LPS)可能通过与肾固有免疫系统Toll样受体(TLRs)结合而成为肾损伤的重要介质[11]。痛风雏鹅肠道菌群也会发生改变,并且与肾损伤关系密切[12]。但其机制不甚明了。因此,本研究从临床病例入手,通过16S rDNA测序技术,基于TLR4/MyD88/NF-κB通路,探讨痛风雏鹅肠道菌群对肾损伤的作用及机制,助力探索有效的防治措施。
1 材料与方法
1.1 痛风雏鹅
2019年1—6月,于江苏省泰州市某鹅场共收集具有内脏型痛风特征(食欲减退,排出石灰渣样稀粪,剖检可见肠系膜、腹膜、胸膜、肌肉以及腹腔和胸腔后的全部内脏器官的浆膜表面等都沉积有大量的白色尿酸盐,肾肿大,输尿管变粗等)的10~14日龄发病雏鹅15只,记为痛风组(Gout)。同时,根据精神活泼,叫声清脆,饮食及排粪正常等特征选取同一鹅场同一批相同日龄的健康雏鹅15只,记为健康对照组(Control)。所有雏鹅均为笼养(笼长100 cm,宽100 cm,高20 cm),每笼20只左右,采用自配雏鹅饲料(粗蛋白约为19%)饲喂,每天喂4~5次,并给予少量菜叶,自由饮食,消毒、卫生防疫和日常管理按照规模化养禽场常规饲养方法进行。
1.2 血液生化指标测定
对所有雏鹅进行颈静脉采血并装入试管中,在37 ℃水浴锅中静置,待分层后吸取上清液于离心管中,按2 500 r·min-1离心10 min,取上清液置于4 ℃ 冰箱中保存,次日检测。血清肌酐(Cr)用改良苦味酸法测定,血清尿酸(UA)用酶比色法测定,血清尿素氮(BUN)用脲酶-谷氨酸脱氢酶法测定。
1.3 肠道菌群16S rDNA高通量测序
1.3.1 粪便采集 将所有雏鹅处死后,无菌采取盲肠粪便分别放置于2 mL无菌管中,-80 ℃保存,并在24 h内进行高通量测序。
1.3.2 粪便总DNA提取与PCR 称取无菌粪便样100 mg,采用Qiagen DNA试剂盒按说明书提取总DNA,再以获得的细菌DNA为模板进行细菌16S rDNA的V3-V4可变区PCR扩增,上游引物F为5′-ACTCCTACGGGAGGCAGCAG-3′,下游引物R为5′-GGACTACGVGGGTATCTAAT-3′。反应条件:95 ℃预变性 10 min,92 ℃变性45 s,50 ℃ 退火30 s,72 ℃延伸30 s,6个循环;92 ℃变性45 s,68 ℃退火30 s,72 ℃延伸30 s,30个循环;然后72 ℃扩展延伸10 min,4 ℃保存。采用生工生物工程(上海)股份有限公司的PCR产物纯化试剂盒对所得PCR产物进行纯化后,用于后续操作。
1.3.3 高通量测序及处理 使用NEB Next®UltraTMDNA Library Prep Kit for Illumina建库试剂盒进行文库构建,构建好的文库经过Qubit定量和文库检测合格后, 使用Illumina Miseq PE 300平台进行Paired-end测序。测序数据经QIIME(version 1.9.1)进行去除接头序列、低复杂度序列和低质量序列的处理,得到高通量原始碱基序列,用RDF分类器将相似性大于97%的序列划分为一个分类操作单元(OTUs),与GreenGene数据库进行比对,得到注释结果。
1.3.4 生物信息学分析 用QIIME1.9.1[13]分析菌群α多样性(Chao1、Shannon),运用Canoco5[14]进行主成分分析(PCA)β多样性,组间差异菌群用LEfSe分析[15],运用PICRUSt[16]预测菌群基因组功能,与KEGG数据库比对,计算KEGG通路后进行STAMP差异分析。
1.4 RT-qPCR测定肾组织TLR4/MyD88/NF-κB通路中相关分子的mRNA表达量
采集新鲜肾组织,液氮速冻,-80 ℃保存待测。TRIzol法提取肾组织总RNA,测定其OD260 nm/OD280 nm均为1.8~2.0,然后,在37 ℃ 15 min,85 ℃ 5 s下逆转录合成cDNA。扩增条件:95 ℃ 30 s;95 ℃ 5 s, 55 ℃ 30 s, 72 ℃ 30 s,循环35次。登录NCBI数据库查找相应基因序列,用Primer-BLAST进行引物设计及特异性检验,最后由上海生工合成,见表1。以β-actin为内参,基因表达量用2-ΔΔCt法计算。

表1 引物信息
1.5 Western blot测定肾组织TLR4/MyD88/NF-κB通路中相关分子蛋白表达
在低温条件下,将肾组织研磨破碎,加RIPA裂解液后,用超声法提取组织蛋白,BCA法测定蛋白浓度,将蛋白样品加到10%的SDS-PAGE电泳胶上进行电泳分离,再转印至PVDF膜上,然后分别和TLR4(1∶1 000)、MyD88(1∶5 000)、NF-κB(1∶500)、IL-1β(1∶1 000)、TNF-ɑ(1∶1 000)、IL-6(1∶1 000)和GAPDH(1∶1 000)抗体在4 ℃摇床中孵育过夜。次日,加辣根过氧化物酶标记兔抗鹅Ⅱ抗(1∶5 000)室温下孵育1 h, TBST洗膜3次,每次5 min,化学发光成像仪中显影成像。所有抗体均购于福因德科技(武汉)有限公司。以GAPDH为内参,采用Image J分析软件对各组条带的光密度值进行分析。目标蛋白的相对表达水平=目标蛋白条带的灰度值/GAPDH条带的灰度值,并以对照组做标准化。试验重复3次,取平均值。
1.6 粪菌移植无菌小鼠试验
参考ZHAO等[17]的方法进行试验。在无氧室中,随机无菌选取痛风组3个粪便样本,并充分混匀,得到痛风粪便混合样本(gout group),同样方法得到健康对照组混合粪便样本(control group)。分别取每个混合粪便样本0.5 g,加入25 mL无菌Ringer’s缓冲液稀释,充分搅匀后,静置5 min,然后将上清液转移到干净的试管中,并添加等量的20%脱脂乳,制成粪菌液。试验当天制备新鲜粪菌液并使用,其余的保存在-80 ℃下,备用。将15只断奶的无菌C57BL/6 J雄性小鼠(由扬州大学实验动物中心提供)在12 h光周期下饲养于无菌的柔性薄膜塑料隔离器中,喂食消毒过的饲料与水,在粪菌移植前定期收集粪便、食物、水和填料等样本进行细菌学检查来监测细菌污染。在7周龄时,随机等分为3组(每组单独隔离):M-Control组、M-Gout组和M-Gout+TAK-242组。试验开始时,M-Control组小鼠口服(灌胃)100 μL Control group的粪菌液,M-Gout组和M-Gout+TAK-242组口服100 μL Gout group的粪菌液,并于第2天各组分别加强口服相同粪菌液1次;M-Gout+TAK-242组每天腹腔注射TAK-242(3 mg·kg-1),其他两组每日注射等剂量的生理盐水,试验期20 d,试验在江苏农牧科技职业学院实验动物饲养房进行。试验结束后,空腹收集各组小鼠血液用于Scr、BUN、UA和肾损伤因子-1(KIM-1,ELISA法)的检测,同时,采集粪便进行16S rDNA测序,方法同上。将小鼠致死后,采集肾组织,部分用于TLR4、MyD88及NF-κB的mRNA表达量测定,方法同“1.3”;部分用于制作组织切片,观察病理变化。
1.7 数据处理
连续性数据用表示, 采用SPSS 22.0统计软件ANOVA程序单因素方差分析进行比较,肠道菌群丰度比较采用Kruskal-Wallis检验,用Spearman分析相关性。P<0.05表示差异显著,P<0.01 表示差异极显著。
2 结 果
2.1 痛风雏鹅血液生化指标及肠道菌群多样性的变化
从图1可以看出,痛风雏鹅血液中的UA、Cr及BUN均极显著高于健康对照组(P<0.01,图1A)。将肠道菌群16S rDNA测序结果按97%相似性聚类所得的操作分类单元(OTUs)进行比较,发现痛风雏鹅的OTUs数量极显著低于健康对照(P<0.01),有67个OTUs显著下调,81个OTUs显著上调(图1B);反映菌群α多样性的Chao 1指数及Shannon指数均极显著低于健康对照(P<0.01),PCA分析发现,在肠道菌群各样本中,组内样本间离散程度较小,组间样本较为分散(图1C),说明雏鹅发生痛风时伴有肠道菌群多样性的改变。
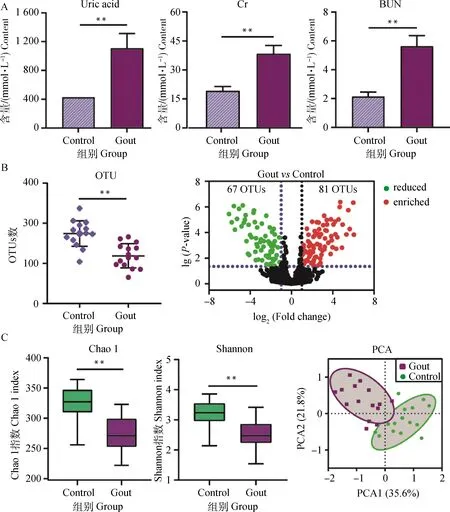
A.血液生化指标(尿酸、肌酐、尿素氮);B.OTUs数量的变化;C.肠道菌群多样性变化(Chao 1指数、Shannon指数、PCA分析);**.P<0.01
2.2 痛风雏鹅肠道菌群结构、差异菌群及基因功能预测分析
在门水平上,雏鹅肠道菌群主要由5大优势菌门组成,分别是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia),且痛风雏鹅的变形菌门相对丰度升高(图2A)。在属水平上,两组丰度前20位菌属无显著变化,拟杆菌属(Bacteroides)、梭菌属(Clostridium)、艾克曼菌属(Akkermansia)等为优势菌属(图2B)。为了进一步分析痛风雏鹅盲肠菌群结构特征,将两组菌群丰度进行LEfSe分析(LDA>2),发现痛风雏鹅盲肠中富集大量的埃希菌属(Escherichia)、变形菌属(Proteus)及肠球菌属(Enterococcus)等细菌,而梭菌属(Clostridium)、乳杆菌属(Lactobacillus)及假单胞菌属(Pseudomonas)等细菌低于健康对照组(图2C)。运用PICRUSt分析对肠道菌群的基因功能进行预测,在KEGG L2水平,痛风雏鹅肠道菌群在免疫系统(immune system)、细菌感染(infectious disease: bacterial)、膜传输(membrane transport)及核苷酸代谢(nucleotide metabolism)等代谢途径参与度较高(图2D)。
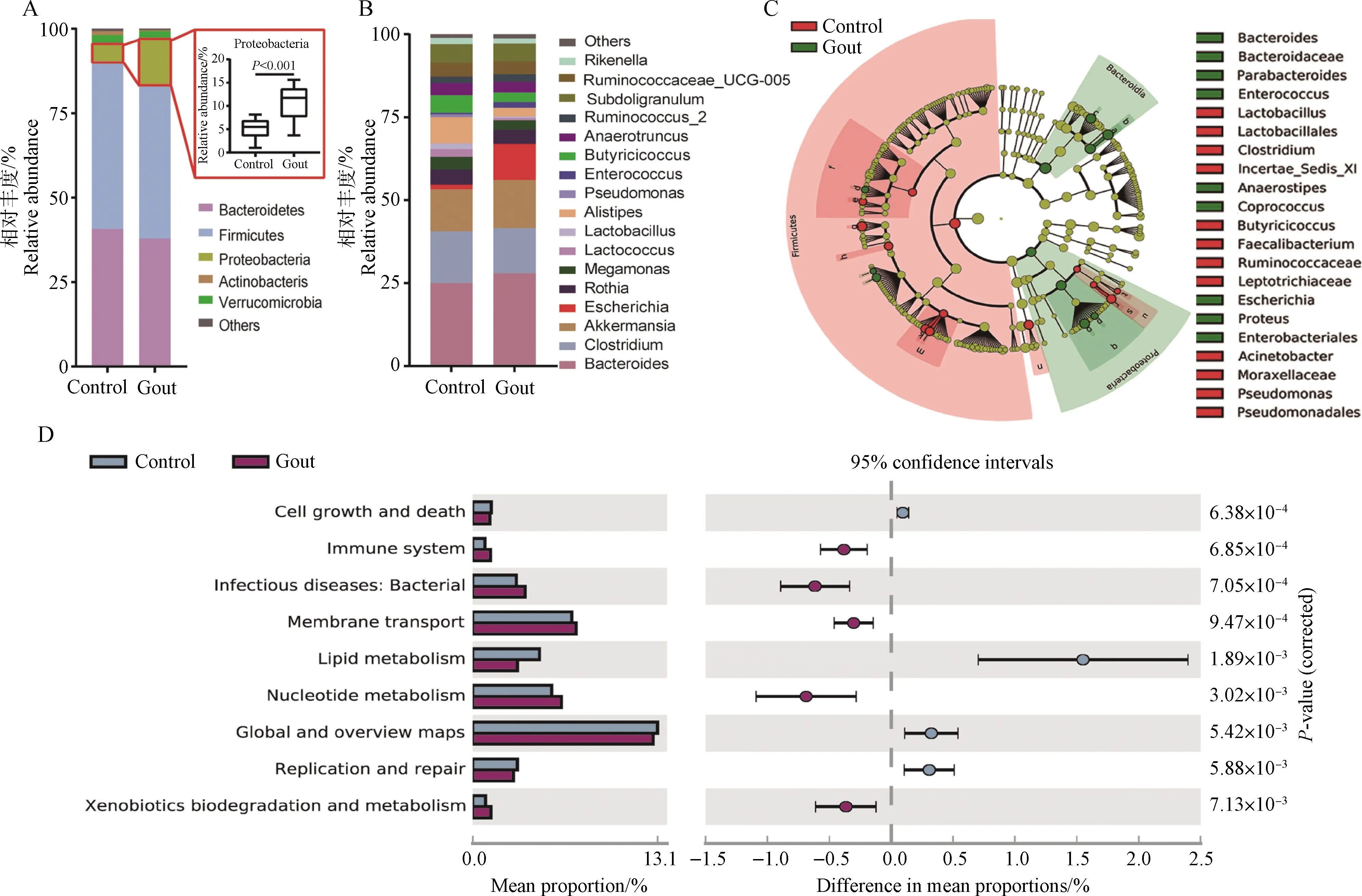
A.门水平的相对丰度;B.属水平的相对丰度;C.LEfSe分析(绿色表示在痛风雏鹅中丰度较高物种,红色表示在健康对照雏鹅中丰度较高的物种);D.KEGG代谢通路富集分析(水平2)
2.3 痛风雏鹅肾组织TLR4/MyD88/NF-κB通路中相关分子的表达情况及与肠道菌群相关性分析
与健康对照组相比,痛风雏鹅肾组织中TLR4(P<0.01)、MyD88(P<0.01)及NF-κB(P<0.01)的mRNA表达量升高(图3A),且TLR4/MyD88/NF-κB通路下游产物IL-1β(P<0.05)、TNF-α(P<0.01)及IL-6(P<0.05)的mRNA表达量亦升高(图3B)。相关性分析发现,这些分子的表达与肾功能指标UA、Cr及BUN呈正相关关系(图3C),与埃希菌属(Escherichia)、变形菌属(Proteus)及肠球菌属(Enterococcus)等菌属呈强正相关,与梭菌属(Clostridium)、乳杆菌属(Lactobacillus)及丁酸球菌属(Butyicicoccus)等菌属呈负相关(图3D)。与对照组比较,痛风雏鹅肾组织中LTR4、TNF-α及IL-6蛋白相对表达上调极显著(P<0.01),MyD88、NF-κB及IL-1β蛋白相对表达显著上调(P<0.05)。
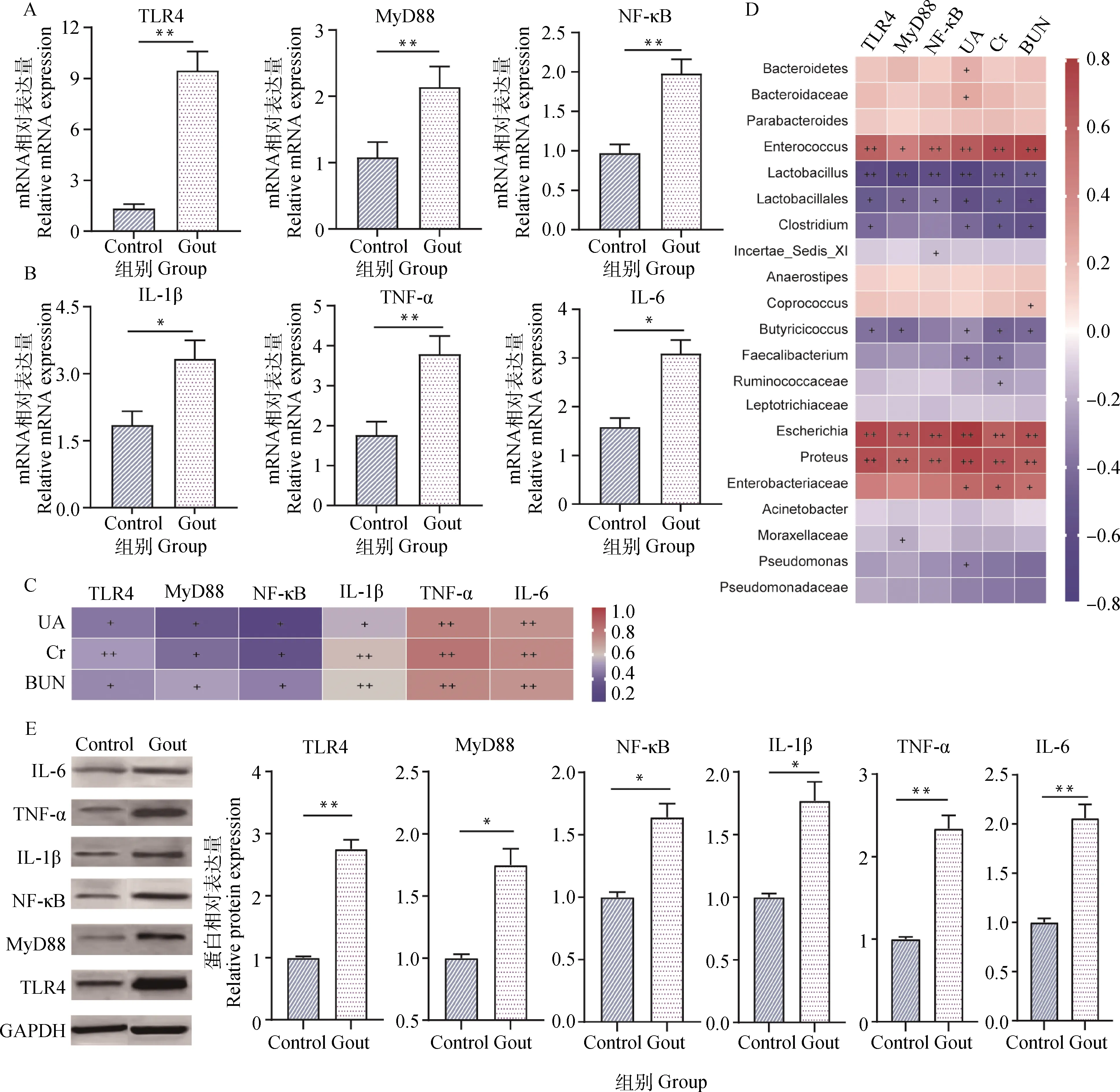
A.TLR4、MyD88及NF-κB的mRNA表达(**,P<0.01);B.下游产物IL-1β、TNF-α及IL-6的mRNA表达(*,P<0.01,**,P<0.01);C.TLR4/MyD88/NF-κB通路中相关分子与肾功能指标相关系数热图(+.P<0.05; ++.P<0.01);D.肠道菌群与TLR4/MyD88/NF-κB通路中相关分子及肾功能指标相关系数热图(+.P<0.05; ++.P<0.01)。E.肾组织TLR4/MyD88/NF-κB通路中相关分子的蛋白表达(*.P<0.01;**.P<0.01)
2.4 痛风雏鹅粪菌移植对无菌小鼠肾损伤的作用
为了确定痛风雏鹅肠道菌群通过TLR4/MyD88/NF-κB通路引发肾损伤作用,分别将痛风组与健康对照组肠道菌群移植了到无菌C57BL/6 J小鼠体内,并且使用TLR4抑制剂TAK-242进行干预。结果发现,M-Gout组和M-Gout+TAK-242组小鼠肠道菌群与痛风雏鹅相似,M-Control组小鼠肠道菌群与健康雏鹅相似(图4A);与M-Gout+TAK-242组和M-Control组比较,M-Gout组小鼠肾组织中TLR4、MyD88及NF-κB分子mRNA表达显著上调(P<0.05,图4B),血中Cr、BUN、KIM-1及UA均显著升高(P<0.05,图4C);M-Gout组小鼠的肾小管发生变性,管腔变窄,有少量炎性细胞浸润,M-Gout+TAK-242组小鼠的肾组织结构变化不明显(图4D)。

A.各样本肠道菌群在属水平的聚类热图;B.TLR4、MyD88及NF-κB分子mRNA表达量;C.肾功能指标的变化(肌酐、尿素氮、肾脏损伤因子-1和尿酸);D.肾组织结构的变化(HE染色,400×)。移植痛风雏鹅粪菌液组:M-Gout;移植痛风雏鹅粪菌液组+TAK-242组:M-Gout+TAK-242;移植健康雏鹅粪菌液组:M-Control;痛风粪菌液供体:Gout group;健康粪菌液供体:Control group。#表示与其他两组比较P<0.05
3 讨 论
动物胃肠道中有1013~1014个微生物,这些微生物参与宿主的各种生理活动,如新陈代谢、免疫反应及发挥肠道屏障作用等[18]。如果这种微生态平衡遭到破坏可使宿主发生疾病。近年来,已经证明肠道微生物群与宿主的肾健康和痛风发生风险有关[19]。在一些研究中,观察到痛风患者的肠道菌群与健康人的肠道菌群具有较大差异,表明肠道菌群与痛风有关[20]。在本研究中,根据PCA分析发现,痛风雏鹅的肠道菌群与对照雏鹅存在差异,表现为菌群多样性显著降低,变形菌门丰度显著增加,病鹅肠道中富集大量肠球菌属、埃希菌属和变形菌属,KEGG代谢通路预测分析显示病鹅免疫系统活跃且存在细菌感染。因此,推测上述菌群可能是痛风雏鹅肠道菌群的主要特征,提示肠道菌群与雏鹅痛风的发生有关。
血清中的肌酐及尿素氮是衡量肾脏功能的重要指标,肾损伤时二者含量急剧升高。本研究中,痛风雏鹅血清肌酐及尿素氮显著高于对照组,说明痛风雏鹅伴有肾损伤过程。Toll样受体4(toll-like receptor,TLR4)是在天然免疫过程中发挥重要作用的一类蛋白质分子,与LPS结合后,可激活TLR4/MyD88/NF-κB通路,使其下游产物IL-1β和TNF-α等促炎因子的表达上调,促进炎症的发生。大量研究表明,TLR4/MyD88/NF-κB通路活化在肾损伤中扮演者重要角色[21-22]。本研究发现,痛风雏鹅肾组织中TLR4、MyD88、NF-κB以及其下游产物IL-1β、TNF-α、IL-6的mRNA表达量及蛋白表达量均显著高于对照组,且这些分子mRNA表达量与Cr、BUN及UA呈正相关。提示TLR4/MyD88/NF-κB通路在痛风雏鹅肾损伤中也发挥着重要作用。为了阐明痛风雏鹅肠道菌群与肾损伤的潜在机制,本研究对肠道菌群、TLR4/MyD88/NF-κB通路中相关分子表达及肾功能指标之间进行相关性分析,发现肠球菌属、埃希菌属及变形菌属等菌群丰度与TLR4、MyD88、NF-κB的基因表达量以及Cr、BUN水平呈正相关。因此,推测痛风雏鹅肠道菌群可能通过激活TLR4/MyD88/NF-κB通路引起肾损伤。
将发病动物肠道菌群移植给无菌小鼠,观察小鼠是否会出现相同病症或病理过程,是验证肠道菌群与疾病之间因果关系的一种重要方法。Zhao等[17]通过肠道菌群移植,证明由膳食纤维调节的肠道微生物群对改善2型糖尿病患者的葡萄糖稳态有因果作用。为了进一步验证本研究的假设,将雏鹅肠道菌群移植到无菌小鼠体内,聚类分析发现,小鼠菌群与供体雏鹅菌群具有高度相似性,且M-Gout组小鼠肾小管上皮细胞发生变性,血清中Cr、BUN及KIM-1水平均显著高于移植健康雏鹅菌群的小鼠。KIM-1是肾小管损伤的一种重要的标志物,在肾小管受损后急剧升高[23]。M-Gout+TAK-242组小鼠尽管菌群与供体雏鹅菌群具有高度相似性,但小鼠肾小管组织结构未见异常变化,血清Cr、BUN及KIM-1水平与M-Control组小鼠无显著差别,显著低于M-Gout组小鼠,这说明抑制小鼠TLR4表达可以减轻痛风雏鹅肠道菌群诱导小鼠发生肾损伤。由此可以推断,痛风雏鹅肠道菌群可以通过TLR4/MyD88/NF-κB通路促进肾损伤的发生。
4 结 论
痛风雏鹅肠道菌群多样性降低,变形菌门、肠球菌属、埃希菌属及变形菌属等细菌丰度增加,而且这种肠道菌群的改变可以通过TLR4/MyD88/NF-κB通路促进雏鹅肾损伤,加剧痛风的发展。因此,肠道菌群可作为雏鹅痛风防治的潜在新靶点。
