基于核磁共振饱和转移差谱技术筛选Protein A仿生多肽配基
2021-02-27王伟颖苏志国马光辉郑永祥郝冬霞
王伟颖,葛 佳,苏志国,马光辉,郑永祥,郝冬霞,余 蓉
(1. 四川大学 华西药学院 靶向药物及释药系统教育部重点实验室,四川 成都 610041; 2. 中国科学院 过程工程研究所 生化工程国家重点实验室,北京 100190; 3. 中国科学院大学,北京 100049)
工业上,常常使用Protein A亲和层析技术纯化抗体,但Protein A亲和介质具有价格昂贵、易从基质上脱落及使用寿命短等缺陷[1-2],而抗体多肽亲和配基具有价格低廉、化学性质稳定的优势[3],因此开发抗体亲和性多肽以取代Protein A亲和介质是非常热门的研究课题。目前对于抗体亲和性多肽的开发和筛选多采用噬菌体展示[4-5]、组合化学库[6]和分子模拟等技术手段[7],这些方法具有筛选周期长、筛选范围大、无法真实反映溶液中配基与蛋白相互作用的缺陷。
核磁共振饱和转移差异差谱(STD-NMR)技术可以用于在溶液状态下筛选能与大分子蛋白结合的小分子配基,并且可以通过表位分析确定小分子配基上与蛋白结合的关键位点信息[8-11]。因此,本文中,笔者以Protein A为目标,通过定向设计Protein A仿生多肽片段,利用STD-NMR技术在真实色谱环境下筛选能与抗体结合的多肽配基,在原子水平上评价多肽与抗体的结合机制,并将筛选到的多肽配基固定在琼脂糖基质上制备出多肽介质,通过静态吸附试验评价筛选出的多肽配基结合抗体的能力。
1 材料与方法
1.1 仪器和试剂
600 MHz液体核磁共振光谱仪(低温探头),布鲁克公司;752型紫外分光光度计,上海舜宇恒平科学仪器有限公司;ZKSY型恒温水浴锅,巩义市英峪仪器厂;XSE104型电子分析天平,Mettler Toledo公司;PHS-220B型pH计,上海三信仪器有限公司。
多肽配基(95%纯度),吉尔生化(上海)有限公司;人抗体 (hIgG,95%纯度),Sigma公司;牛血清白蛋白(BSA,98%纯度),北京欣经科生物制品有限公司;重水(D2O),Cambridge Isotope Laboratories Inc.;琼脂糖微球Sepharose 4FF,美国GE Healthcare公司;其他化学试剂均为市售分析纯。
1.2 STD-NMR实验
所有的STD-NMR实验均在25 ℃、脉冲序列为“STDDIFFGP19.3”的条件下进行,并且使用WATERSUP进行水峰的压制。本实验用的缓冲液为20 mmol/L磷酸缓冲液,溶剂是重水(D2O),不同多肽配基溶解在上述的磷酸缓冲液中,配基的终浓度为1.25 mmol/L,终体积为500 μL,在离心管中充分溶解后,转移到直径5 mm的核磁管中备用。
1.3 吸附等温线的测定
采用环氧活化的方式将六肽FYEILH固定在琼脂糖4FF微球上制备出六肽FYEILH亲和介质[12],将此亲和介质依次用去离子水和结合缓冲液充分洗涤,抽干,然后称取 20 mg抽干介质与 2.0 mL蛋白溶液(0.2~4.0 mg/mL,结合缓冲液溶解)混合,在25 ℃、140 r/min条件下吸附4 h后,将吸附体系在4 000 r/min条件下离心5 min 后收集上清液,在280 nm处用紫外分光光度计测上清液的吸光值以确定上清液中蛋白质量浓度(ρ),进而根据物料守恒原则即可确定配基的吸附容量(式(1)),然后应用 Langmuir 模型(式(2))描述吸附等温线,确定配基的饱和吸附载量qs和解离常数。
(1)
式中:q为吸附容量,mg/mL;ρ0为初始蛋白质量浓度,mg/mL;ρ为吸附平衡时上清液中蛋白质量浓度,mg/mL;Vl为吸附前加入蛋白的体积,mL;Vs为介质体积,mL。
(2)
式中:qm为饱和吸附载量,mg/mL;Kd为解离常数,mg/mL。
2 结果与讨论
2.1 亲和配基精准筛选技术的建立——照射位点的选择
进行STD-NMR实验时,需要选择2个照射位点,其中一个为既远离大分子又远离小分子的非选择性照射位点,另一个为只有大分子没有小分子的选择性照射位点,选择性照射位点的最优化选择是在没有抗体存在时,单独配基溶液不会产生STD信号,以防产生假阳性的实验结果。由于本研究中使用的多肽配基信号比较广泛,且不同肽段的氨基酸组成不同,质子的化学偏移也不同,因此,为了排除因照射位点的选择不当而引起的假阳性,需要对照射位点进行一系列的优化。
图1显示了不同长度、不同氨基酸组成的多肽在不同选择性照射位点下的STD图谱,并将这些多肽在不同选择性照射位点下呈现的阳性和假阳性的实验结果列于表1中。由图1和表1可知,不同长度、不同组成的多肽有自身的适宜的选择性照射位点,从照射位点的优化结果可以看出,最佳选择性照射位点的位置不仅与多肽配基的长短有关,也与配基质子的化学位移δ有关。因此在选择照射位点的位置时,其与配基质子之间的距离(δ)至少为1;对于大于6个氨基酸的多肽,其选择性照射位点的位置与配基质子之间的距离δ要大于1。此外,选择性照射位点的位置在满足不会使多肽配基产生假阳性的基础上,还应该尽可能靠近大分子蛋白的位置,同时由于抗体在δ为1处仍然具有质子信号,所以,在本文中选择的选择性照射位点的位置多在δ为1处。
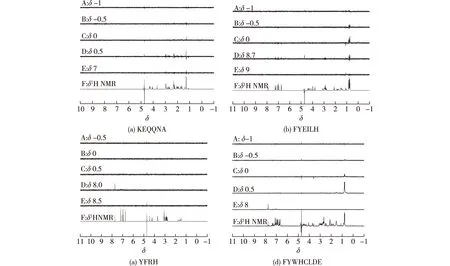
A~E—多肽在不同选择性照射位点下的STD图谱;F—多肽的氢谱1H NMR图1 不同多肽的核磁共振谱图Fig.1 1H NMR spectra of the peptides of different lengths
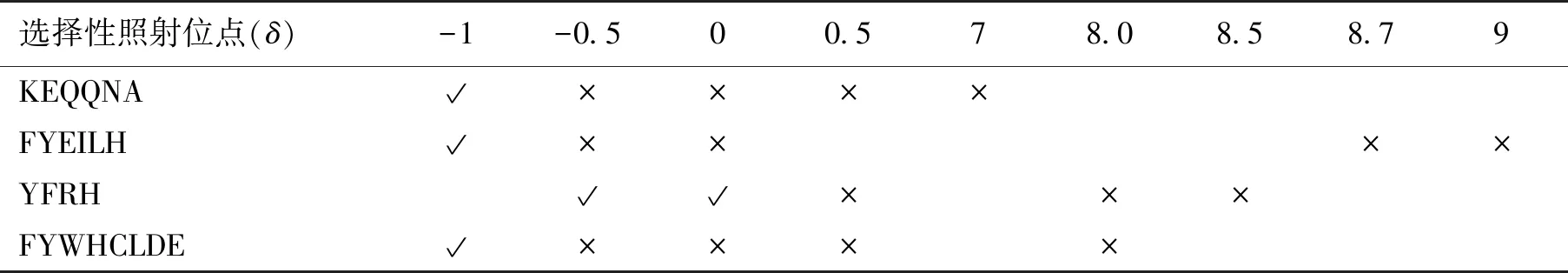
表1 各种肽段的阳性和假阳性位点Table 1 Positive and false positive selective irradiation for various peptides
2.2 Protein A仿生多肽亲和配基的设计和筛选
晶体衍射结果表明Protein A主要通过其前2个螺旋与抗体结合[13-14],因此根据Protein A的 domain B前2个α螺旋上的氨基酸组成进行定向设计,分别合成了KEQQNA、FYEILH、EEQRNG和FIQSLKD这4个肽段(图2)。将STD-NMR技术用于检测这些肽段与抗体的结合能力,并用STD factor来评价肽段和抗体的亲和力强弱(STD factor=ISTD/Io×Eligand。其中,ISTD指的是STD谱上与抗体结合的配基质子的信号强度,Io是off谱上对应的配基质子的信号强度,Eligand是配基与抗体的浓度比,在本实验中使用的配基与抗体的浓度比为100),STD factor值越大表明配基与抗体的亲和性越强。图3(a)显示了合成的4个多肽配基在不同pH条件下与抗体结合的STD factor值,从实验结果可以发现六肽FYEILH在pH 6.0条件下与抗体亲和性最强,大于其余多肽在各个pH下的结合强度。图3(b)展示了六肽FYEILH与文献中报道的具有最高载量多肽配基YFRH与抗体结合STD factor的值的比较,结果显示六肽FYEILH与抗体的亲和性高于目前文献中报道的具有最高载量多肽配基YFRH。由此可见,多肽FYEILH具有发展成为抗体亲和配基的潜力。
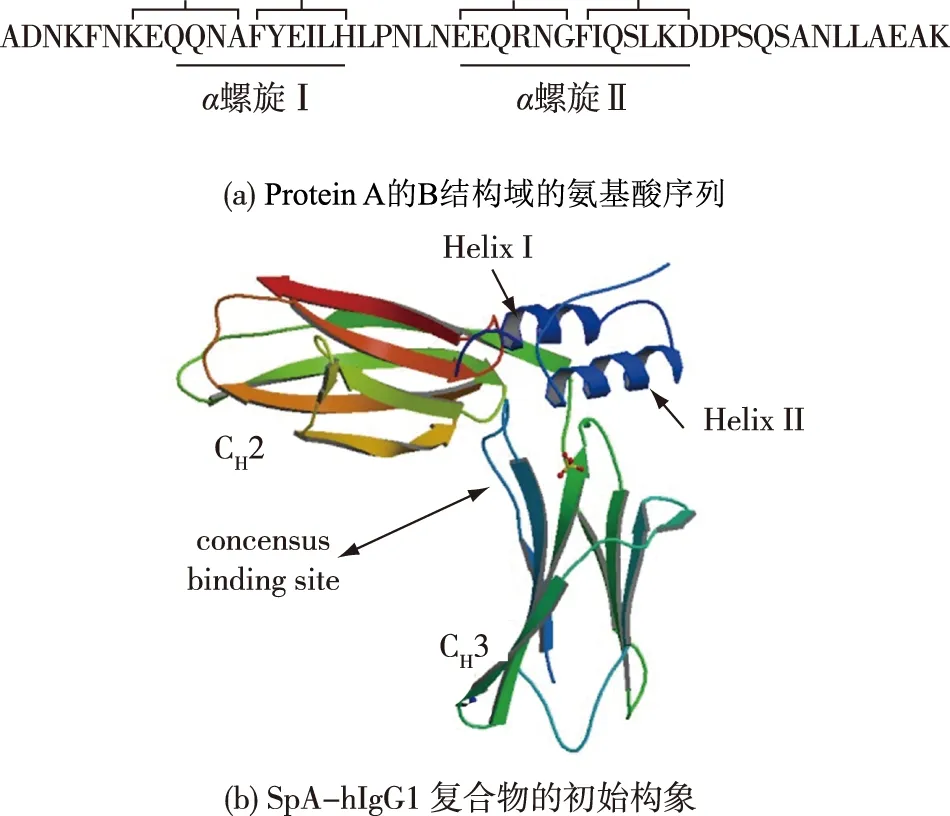
图2 Protein A的B结构域的氨基酸序列和SpA-hIgG1 复合物的初始构象(PDB:1FC2)Fig.2 Sequence alignment of domain B of Protein A and initial conformation of the SpA-hIgG1 complex (PDB:1FC2)
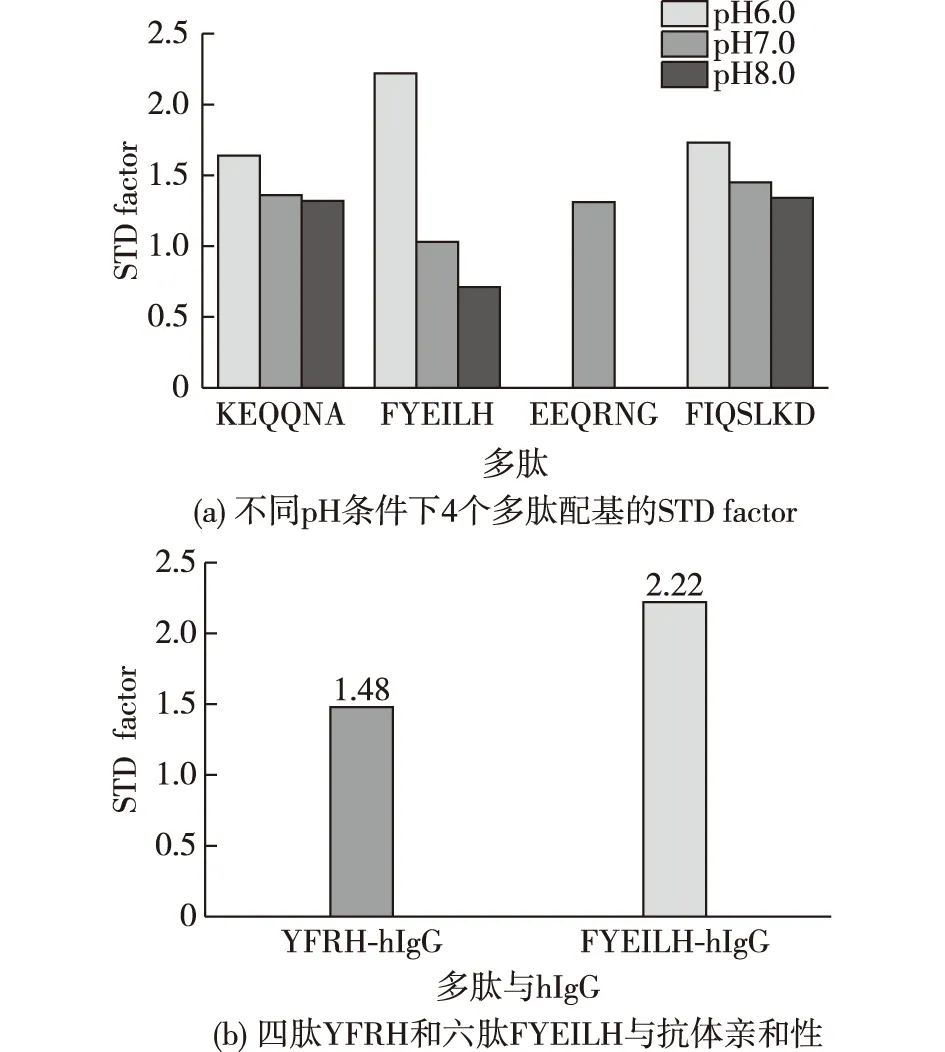
图3 Protein A上4个多肽配基在不同pH条件下STD factor及四肽YFRH和六肽FYEILH的抗体亲和性Fig.3 STD factor of four peptides from Protein A at different pH,and the binding capacity between YFRH-hIgG and FYEILH-hIgG
2.3 仿生多肽亲和配基与抗体结合机制的探究
STD-NMR技术中的重要参数STD effect (ISTD/I0)能够在原子水平上考察多肽配基与抗体结合的关键位点信息。STD effect值代表了多肽上不同质子距离抗体的远近,STD effect值越大,表明质子与抗体距离越近,与抗体的亲和力越强,其在多肽与抗体的结合中发挥着越重要的作用,当某一质子的STD effect大于10%时,则表明该质子与抗体具有明显的相互作用[10]。图4为六肽KEQQNA的结构式以及其与抗体反应后的STD图谱。由图4可知:六肽KEQQNA上的赖氨酸(K)侧链的ε质子具有最大的STD effect值,表明赖氨酸(K)侧链中的氨基通过静电作用与抗体结合;除此之外,位于丙氨酸(A)侧链的脂肪族质子,与抗体也具有相对较近的距离(STD effect为25%),其通过疏水作用参与与抗体的结合。由此可知,六肽KEQQNA在与抗体的相互作用中占主导地位的为静电相互作用,其次为疏水相互作用。

图4 六肽KEQQNA的结构及其与抗体反应的STD图谱Fig.4 Structural formula of hexapeptide KEQQNA and 1D STD-NMR spectrum with spin-lock pulse of KEQQNA in the presence of human IgG
图5为六肽FYEILH的结构式以及其与抗体反应后的STD图谱。由图5可知:六肽FYEILH中谷氨酸(E)侧链羧基的质子具有最大的STD effect值,表明谷氨酸(E)侧链羧基通过静电作用主导六肽FYEILH与抗体的结合;除此之外,亮氨酸(L)、异亮氨酸(I)以及酪氨酸(Y)上的脂肪族和芳香族质子与抗体也具有相对较近的距离,其通过疏水作用参与与抗体的结合。由此可知,六肽FYEILH在与抗体的相互作用中占主导地位的为静电相互作用,其次为疏水相互作用。
图6为六肽EEQRNG的结构式以及其与抗体反应后的STD图谱。由图6可知:六肽EEQRNG中的精氨酸(R)侧链的δ质子具有最大的STD effect值,表明六肽EEQRNG与抗体的结合主要是由精氨酸(R)侧链上的氨基通过静电相互作用和氢键驱动的;此外,位于甘氨酸(G)上的质子与抗体也具有相对较近的距离(STD effect为63%),其通过疏水作用参与与抗体的结合。由此可知,六肽EEQRNG在与抗体的相互作用中占主导地位的为静电相互作用和氢键,其次为疏水相互作用。
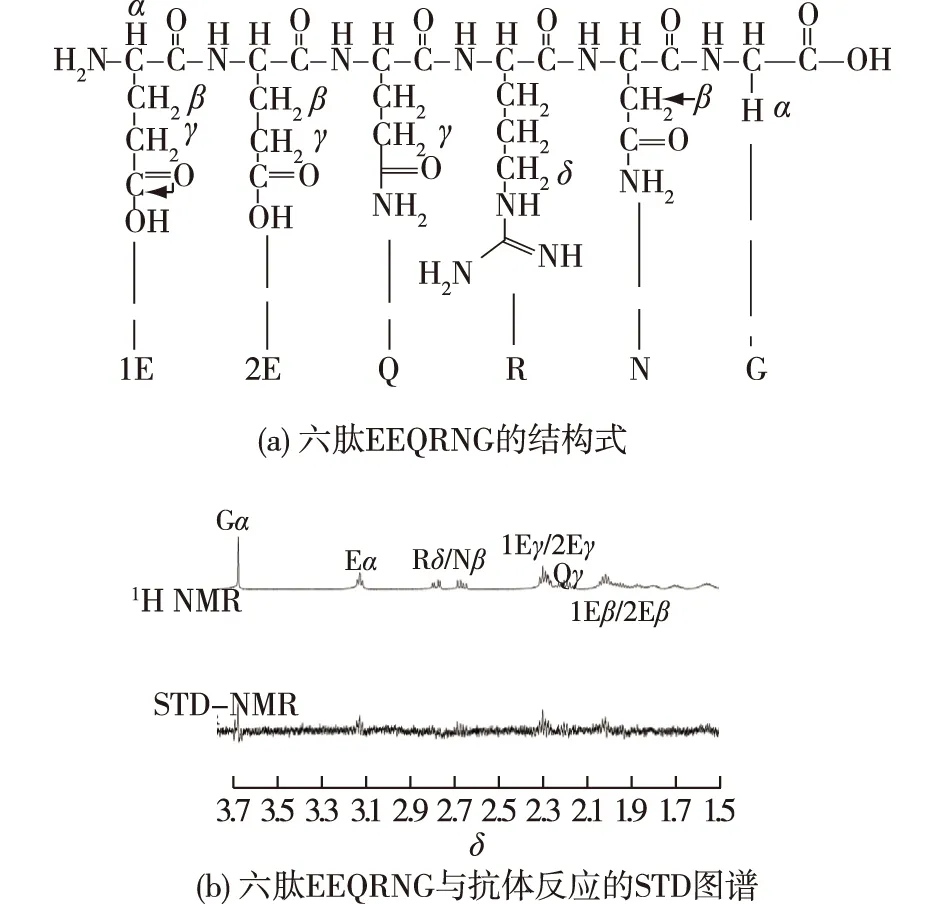
图6 六肽EEQRNG结构及其与抗体反应的STD图谱Fig.6 Structural formula of hexapeptide EEQRNG and 1D STD-NMR spectrum with spin-lock pulse of EEQRNG in the presence of human IgG
图7为七肽FIQSLKD的结构式以及其与抗体反应后的STD图谱。由图7可知: FIQSLKD中丝氨酸(S)β位上的质子具有最大的STD effect值,表明丝氨酸(S)侧链通过氢键和疏水作用与抗体结合;除此之外,位于异亮氨酸(I)、苯丙氨酸(F)、赖氨酸(K)和亮氨酸(L)上的脂肪族和芳香族质子与抗体也具有相对较近的距离,其通过疏水作用参与与抗体的结合。由此可知,FIQSLKD与抗体结合的主要驱动力为氢键和疏水相互作用。
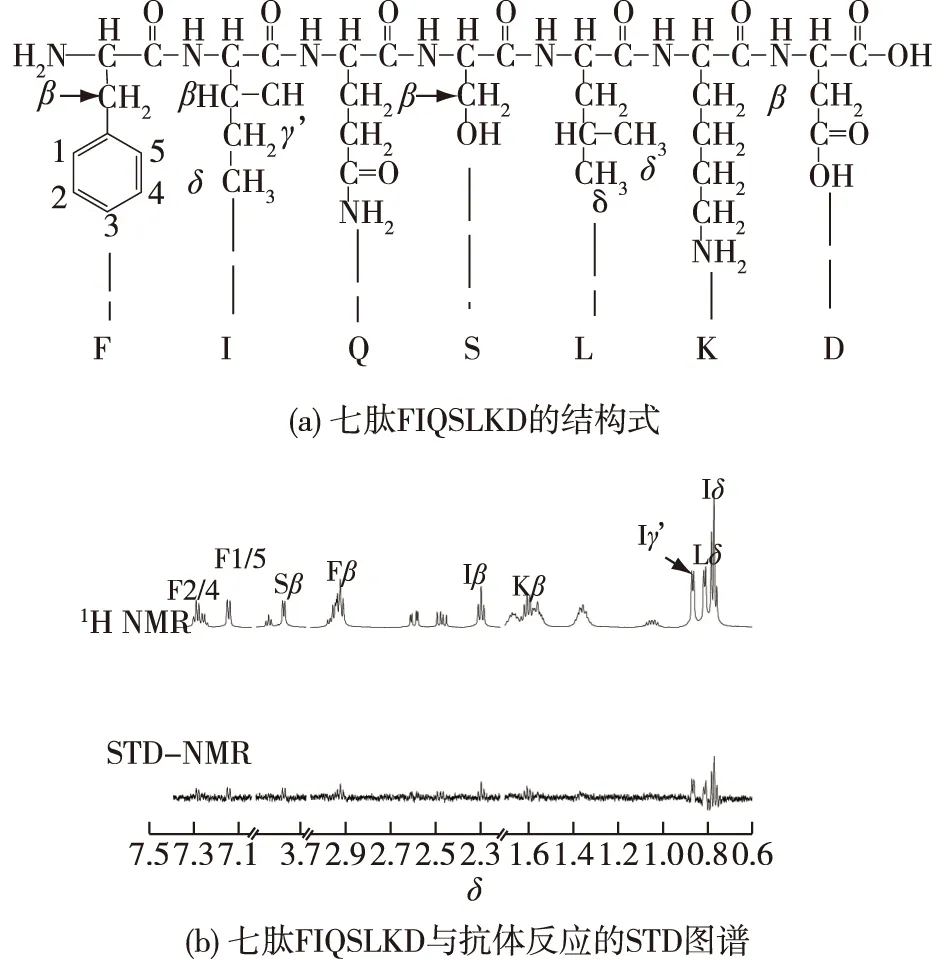
图7 七肽FIQSLKD的结构及其与抗体反应的STD图谱Fig.7 Structural formula of heptapeptide FIQSLKD 1D STD-NMR spectrum with spin-lock pulse of FIQSLKD in the presence of human IgG
表2总结了上述利用STD-NMR技术确定的Protein A上4个肽段KEQQNA、FYEILH、EEQRNG和FYEILH与抗体相互作用的关键位点,以及这些关键位点与文献[14]中利用晶体衍射确定的Protein A上与抗体结合的热点残基。
由表2可知,利用STD-NMR技术和晶体衍射技术确定的关键结合位点大部分能吻合,但在个别位点上有差异。这表明晶体状态与溶液状态中受体和配体的相互作用存在差异,周围氨基酸的调控作用和构象差异能够影响配体和受体的相互作用位点。

表2 仿生肽配基与抗体结合位点的比较Table 2 Comparison of the residues of biomimetic peptide binding to antibody
2.4 静态吸附实验验证六肽FYEILH结合抗体的能力
图8展示了利用Langmuir 模型拟合获得的FYEILH的静态吸附曲线。由图8数据的拟合结果可知,此多肽介质结合抗体的静态吸附容量(qm)为61.22 mg/mL,与抗体的亲和力为0.8×10-6mol/L。表3展示了六肽FYEILH与参考文献中有代表性的抗体亲和配基的静态载量和表观解离常数。由表3可以发现,文献中报道的多数多肽配基与抗体的亲和力即Kd为10-5~10-6mol/L,本研究中笔者筛选出的六肽FYEILH与抗体的结合的解离常数Kd为0.8×10-6mol/L,说明它与抗体的亲和性强于文献报道的许多多肽配基,虽然此亲和力仍然弱于Protein A与抗体的亲和力,但这种较弱的亲和力反而有利于结合在配基上的抗体在更温和的条件下被洗脱,从而有效地避免使用强酸或强碱性洗脱造成的配基脱落和抗体变性聚集。此外,在未来的研究中,还可以通过提高配基密度或连接间隔臂来固定配基的方式进一步提高多肽结合抗体的容量[12,20]。
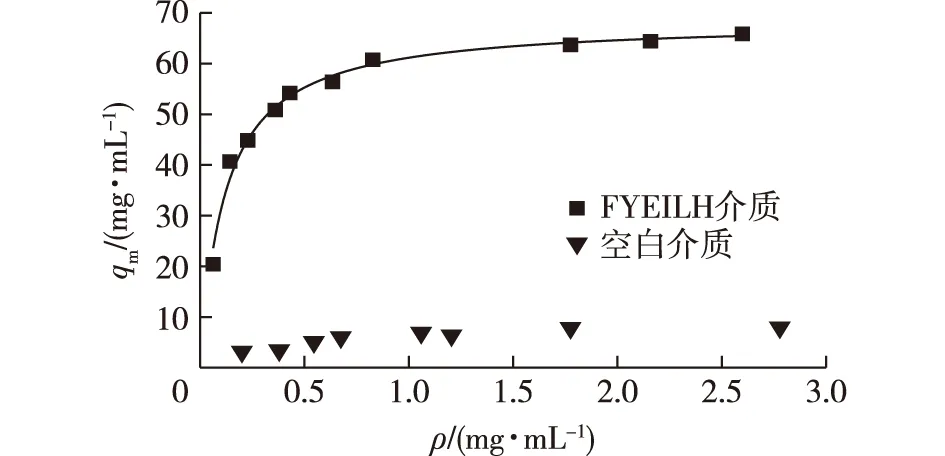
图8 FYEILH亲和介质和空白介质对 hIgG 的吸附等温线(pH 6.0)Fig.8 Adsorption isotherm of hIgG onto the FYEILH peptide resins and blank resins at pH 6.0
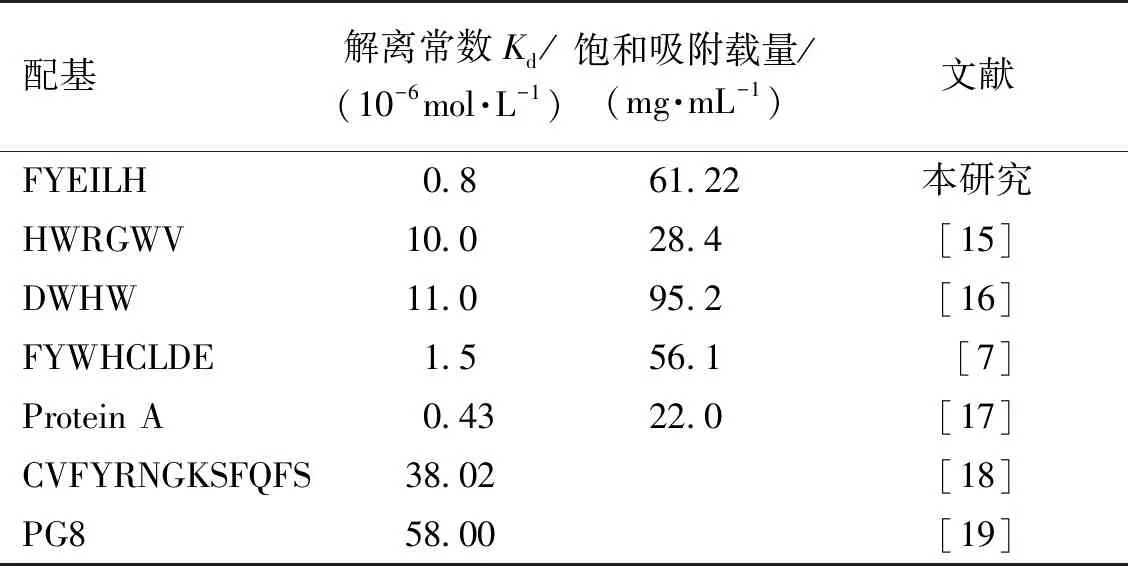
表3 FYEILH、HWRGWV、DWHW、FYWHCLDE、Protein A、CVFYRNGKSFQFS和PG8表观解离常数(Kd)和静态载量(qm)Table 3 Comparison of the capacity (qm) and apparent dissociation constant(Kd) of FYEILH,HWRGWV,DWHW,FYWHCLDE,Protein A,CVFYRNGKSFQFS and PG8
3 结论
在本研究中,定向设计了Protein A上能与抗体结合的4个仿生肽段,利用STD-NMR技术表征了这些肽段与抗体结合的关键位点,与利用X线晶体衍射确定的Protein A上与抗体结合的关键位点信息进行比较,发现两者确定的关键位点信息基本吻合。
将筛选到与抗体亲和性最强的六肽固定在固体基质上制备出了六肽介质,此介质与抗体的亲和性达到0.8×10-6mol/L、静态吸附容量为61.22 mg/mL。由此可见,通过对Protein A定向设计,将其最小化获得的六肽FYEILH与抗体具有较高的亲和性。本研究为开发其他用于纯化的功能性大蛋白质的最小化多肽配基提供了思路和方法。
