定点突变解析短乳杆菌酪氨酸脱羧酶的关键催化位点
2021-02-27许国超
倪 婕,许国超,倪 晔
(江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122)
生物胺是生物体所必需的一类重要含氮化合物,其作为神经递质,在细胞间信息传输中发挥重要作用[1]。生物胺包括多巴胺、5-羟色胺、组胺和酪胺,广泛存在于微生物、植物和动物细胞中[2-3]。酪胺是一种天然存在的痕量单胺,具有多种用途:酪胺可作为多巴胺和章鱼胺的生化前体,这些物质是无脊椎动物神经系统中的神经递质和神经调节剂[4-6];酪胺还可以用于制备降血脂药物苯扎贝特,通过降低胆固醇和甘油三酯水平来降低血脂[7];此外,Olarte等[8]发现,酪胺可以作为胰岛素类似物刺激葡萄糖的转运,从而有效治疗Ⅱ型糖尿病。目前化学法生产酪胺工艺复杂,具有一定的局限性[9-10]。而生物催化法以L-酪氨酸为底物,通过酪氨酸脱羧酶直接生成产物酪胺,具有绿色和高效率的优点,开发应用前景广阔。
酪氨酸脱羧酶(TDC,EC 4.1.1.25)是一种磷酸吡哆醛(PLP)依赖型氨基酸脱羧酶,负责合成生物胺和多胺化合物。Sandmeier等[11]通过序列同源性和保守结构域的进化分析,将氨基酸脱羧酶分为4个亚组,其中酪氨酸脱羧酶与3,4-二羟基-L-苯丙氨酸(多巴)脱羧酶、谷氨酸脱羧酶、组氨酸脱羧酶和半胱磺酸脱羧酶属于Group Ⅱ脱羧酶。TDC可以催化L-酪氨酸和L-多巴脱羧生成酪胺和多巴胺,并释放CO2。目前已经从植物、昆虫和不同的微生物中鉴定出多种TDC,包括果蝇[12],罂粟[13]、红景天[14],短乳杆菌[15-16]、粪肠球菌[17]、甲烷球菌[18]、芽孢杆菌[19]等。TDC催化的反应是多种途径中的关键反应,影响动物、昆虫中神经递质的合成以及植物中生物碱、芳香族挥发物和抗氧化剂的合成。此外,TDC还参与昆虫卵的成熟、免疫反应和肌肉发育。不同来源的TDC在序列上具有较大差异,而短乳杆菌来源的酪氨酸脱羧酶具有最高的比酶活。Pereira等[20]研究发现,短乳杆菌中的TDC可以在酸性条件下合成酪胺,通过脱羧反应中的质子消耗产生质子动力,帮助菌体对抗外界的酸性环境。目前关于TDC底物结合和影响催化活性关键氨基酸的报道较少。2014年,笔者所在课题组的Zhang等[15]实现了短乳杆菌(Lactobacillusbrevis)来源TDC(LbTDC)的异源可溶性表达,该重组TDC催化L-酪氨酸及L-多巴脱羧反应的比酶活分别为134和58.6 U/mg。2016年,Zhu等[21]通过蛋白结晶解析了LbTDC晶体结构(PDB登录号:5HSJ,LbTDC)。
本研究中,笔者在晶体结构的基础上,通过分子对接分析底物与活性口袋氨基酸的相互作用,选取活性口袋内重要位点进行定点突变;对突变体进行蛋白纯化,分别测定突变体对L-酪氨酸和L-多巴的比活力;并结合晶体结构和分子动力学模拟,对影响催化活性的关键位点进行结构分析,以期对其他酪氨酸脱羧酶的分子改造及酶法生产酪胺提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
pET24a-tdc为笔者所在实验室前期构建,用于表达LbTDC;表达菌株EscherichiacoliBL21(DE3),Novagen公司。
1.1.2 培养基
LB培养基:酵母提取物5 g/L、胰蛋白胨10 g/L、NaCl 10 g/L;pH 7.0。121 ℃灭菌20 min。固体培养基再加入20 g/L琼脂。
LBG培养基:酵母提取物5 g/L、胰蛋白胨10 g/L、NaCl 10 g/L、葡萄糖5 g/L;pH 7.0。115 ℃灭菌20 min。
1.1.3 试剂
KOD-Plus-Neo高保真酶,Toyobo公司;限制性内切酶DpnI,TaKaRa公司;DNA Marker、蛋白Marker、质粒DNA小量抽提试剂盒,上海捷瑞生物工程有限公司;胰蛋白胨、酵母提取物,Oxoid公司;异丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素(Kan),生工生物工程(上海)股份有限公司。
1.1.4 引物
本研究用到的引物详见表1。

表1 本研究所用引物序列Table 1 Primers used in this study
1.2 方法
1.2.1 突变体的构建
以LbTDC表达质粒pET24a-tdc为模板,使用KOD-Plus-Neo高保真酶进行全质粒PCR。PCR产物通过琼脂糖凝胶电泳验证成功后,使用限制性内切酶DpnI消化产物中的模板质粒,加10 μL已消化的样品到E.coliBL21(DE3)感受态细胞中,冰浴30 min后,42 ℃水浴热激90 s,再在冰上放置2 min后,加入800 μL的LB培养基,放入摇床37 ℃培养1 h后,将培养液均匀涂布于含Kan抗性的固体LB平板,37 ℃恒温过夜培养。对长出的单菌落进行菌落PCR验证,取验证成功的单菌落接种至LB培养基中,37 ℃、120 r/min过夜培养。将活化好的单菌落进行质粒抽提并测序,测序成功的单菌落加入30%(体积分数)甘油保藏。
1.2.2 培养方法
种子液培养:将测序正确的突变体接种至LB/Kan培养基,37 ℃、180 r/min培养10 h。
摇瓶发酵条件:将种子液以1%(体积分数)接种量转接至LBG/Kan培养基,37 ℃、180 r/min培养。当OD600达到0.6~0.8时,加入终浓度为0.2 mmol/L的IPTG诱导,25 ℃培养8 h。
1.2.3 TDC的蛋白纯化
将发酵液在8 000 r/min条件下离心5 min,弃上清液。加入适量A液,将收集菌体悬浮,超声破碎15 min。将破碎液在4 ℃、8 000 r/min条件下离心30 min得到的上清液用微孔滤膜(0.25 μm)过滤去除杂质后,使用AKATA蛋白纯化仪(His-Trap 5 mL镍柱)进行蛋白纯化。
上样缓冲液A液。25 mmol/L Tris-HCl(pH 7.4)、300 mmol/L NaCl、20 mmol/L咪唑、5 mmol/Lβ-巯基乙醇、10%(体积分数)甘油。
洗脱缓冲液B液。25 mmol/L Tris-HCl(pH 7.4)、300 mmol/L NaCl、300 mmol/L 咪唑、5 mmol/Lβ-巯基乙醇、10%甘油。流速为5 mL/min,采用梯度洗脱方法进行分步洗脱。
收集洗脱液进行SDS-PAGE分析,选取纯度较高的洗脱液,使用截留分子量为3.0×104的超滤管浓缩置换,当蛋白质量浓度大于10 mg/L后,将蛋白分装并使用液氮速冻,-80 ℃冰箱保存[22]。
1.2.4 TDC酶活力的测定
酶活测定体系(1 mL):10 μL合适浓度的酶液、40 μL PLP(2 mmol/L)、40 ℃预热的950 μL底物(2 mmol/L,溶于0.2 mol/L pH 5.0的醋酸钠缓冲液),40 ℃反应10 min后100 ℃灭活10 min以终止反应。将冷却的反应液在12 000 r/min条件下离心10 min,并采用微孔滤膜(0.22 μm)过滤后进行HPLC分析。
使用反相HPLC,Diamonsil C18柱(250 mm×4.6 mm)测定酪氨酸脱羧酶的比酶活。测定TDC对L-酪氨酸和L-多巴2种底物的活力,采用Bradford方法测定蛋白质含量。
液相检测条件:进样体积为10 μL,柱温30 ℃,流速1 mL/min,检测波长220 nm。流动相为甲醇-水-冰醋酸,三者体积比为10∶ 90∶ 0.1。
TDC酶活力定义:在上述活力测定条件下,1 min生成1 μmol酪胺所需的酶量。
1.2.5 TDC与底物的分子对接
使用Discovery Studio 4.0将LbTDC(PDB登录号:5HSJ)与底物L-酪氨酸的分子对接。首先,删除晶体结构中的PLP分子作为蛋白受体,绘制外部醛亚胺(L-酪氨酸与PLP复合物)分子结构并使用Prepare Ligand工具处理、利用Prepare、Protein功能对受体LbTDC模型结构进行预处理;然后,用Receptor-Ligand Interaction模块下Define and Edit Binding Site工具,通过空腔定义受体中可能的结合部位,选择重要催化残基His241、Asp328、Lys392所在空腔为对接部位,并将自动生成的活性部位球体半径修改为1.0 nm;最后,使用CDOCKER工具进行分子对接操作。根据酪氨酸脱羧酶的催化反应机制及CDOCKER_ENERGY得分对所获得的构象进行筛选评价,选择符合催化机制且得分最高的构象为最佳对接构象。
1.2.6 TDC与底物的分子动力学模拟
以分子对接获得的结果为输入构象进行分子动力学模拟:使用Antechamber添加小分子GAFF力场;通过PBD2PQR在线工具使蛋白所有氨基酸侧链处于pH 5.0下质子化状态,并对蛋白质施加AMBER99SB力场;使用GROMACS 5.1.4软件对蛋白和小分子复合物进行分子动力学模拟,获得蛋白质运动轨迹。
在分子动力学(MD)模拟中,采取周期性边界,粒子网格Ewald(PME)方法用于评估长程静电相互作用。模拟步长2.0 fs,静电与范德华力截断值取1.2 nm。将小分子与蛋白的复合物置于八面体盒子中,加入TIP3P水分子模型,使水溶液密度为1.0 g/L。蛋白质与盒子边界最小距离设定为1.0 nm,加入Na+中和系统电荷。通过1 000步最陡下降法与9 000步的共轭梯度最小化,实现系统能量最小化,得到正确的起始模拟结构。保持系统粒子数目,体系温度与体积恒定,在313.15 K下平衡100 ps,再保持系统粒子数目,体系温度与压力恒定,在0.1 MPa气压下平衡100 ps。体系处于需要的温度和压力后,放开位置限制运行成品模拟并收集数据,收集3组10 ns的轨迹用于进一步的分析。
2 结果与讨论
2.1 突变位点的选择
为了进一步阐明底物与TDC活性位点的相互作用,笔者选择已经得到的LbTDC/PLP复合物晶体结构,删除结构中的PLP分子作为蛋白受体,对L-酪氨酸进行分子对接,得到酶与底物复合物结构。获得的活性位点由H98、M99、N100、N120、K240、H241、V294、G296、S297、T298、A330、Y331、K392、D398、H391、V396、P397和Y398等氨基酸组成。通过Discovery Studio软件分析底物与活性中心氨基酸的相互作用,结果见图1。由图1可知:与其他来源的TDC相似,保守的H241的咪唑环与PLP的吡啶环形成π-π堆积作用;D328中带负电荷的氧原子(O3)与PLP带正电荷的吡啶氮(N1)形成盐桥[23];M99与L-酪氨酸的苯环形成π-sulfur相互作用;H98、Y331和Y398与底物复合物形成碳氢键作用。LbTDC的最适pH为5.0,与Huang等[24]的研究结果类似,在pH 5.0条件下,底物口袋表面所带的正电荷有助于L-酪氨酸的正确结合。

图1 底物与活性位点氨基酸之间作用力Fig.1 Interactions between L-tyrosine and LbTDC
由于LbTDC的高度灵活性,活性中心的loop区域在催化中发挥重要作用,选取LbTDC活性口袋中底物侧H98~E102的loop区域(图2),对这5个位点进行定点突变,将这些氨基酸突变为其他不同类型的代表氨基酸,包括侧链较小的非极性氨基酸Ala、极性不带电氨基酸Asn、带负电荷氨基酸Asp、非极性氨基酸Leu、芳香族氨基酸Phe、带正电荷氨基酸Lys和侧链较小的极性不带电荷氨基酸Ser,以探究其在催化中的具体作用。酪氨酸作为重要的催化氨基酸,其独特的苯环与酚羟基可能在催化中发挥重要作用。因此选取Y331和Y398这2个位点,将酪氨酸突变为极性氨基酸,以探究这些位点在脱羧反应中的具体作用。

图2 关键活性位点在LbTDC中的位置Fig.2 Structure of key residues in thecatalytic center of LbTDC
2.2 loop区域突变体的构建及比酶活分析
按照1.2.1节的方法成功扩增所有突变体,并将重组质粒通过化学转化法转入E.coliBL21(DE3)感受态细胞中,选取测序正确的突变体进行摇瓶培养。前期研究发现,在LB培养基中加入5 g/L葡萄糖可以改善LbTDC包涵体现象,实现可溶性表达[15]。本研究在此基础上,将表达的突变体进行蛋白纯化。以H98位点为例,突变体的SDS-PAGE分析结果见图3。根据图3结果,选取纯度大于90%的纯酶进行比酶活测定。
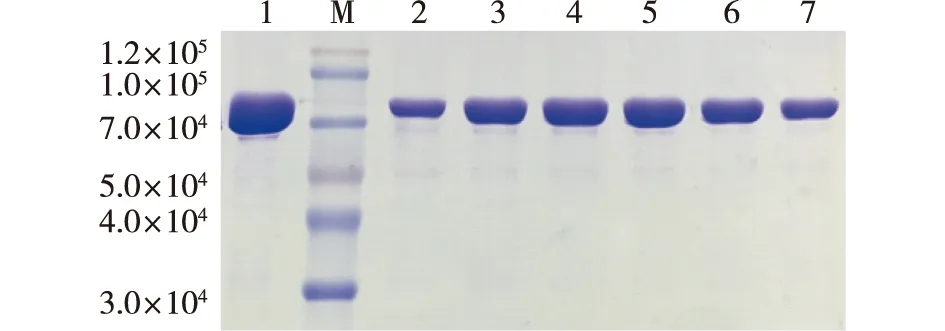
M—标准蛋白质;1—H98A;2—H98N;3—H98D;4—H98L;5—H98F;6—H98K;7—H98S图3 H98位点突变体SDS-PAGE电泳Fig.3 SDS-PAGE analysis of variants of H98

野生型LbTDC对L-酪氨酸和L-多巴的比酶活设定为100%;L—酪氨酸,L—多巴图4 H98-E102位点突变体对L-酪氨酸和L-多巴的相对比酶活Fig.4 Relative activities of site-directed mutagenesis mutants on H98,M99,N100,S101 and E102
H98~E102位点突变体相对活力测定结果见图4。由图4可知:H98位点突变体H98A和H98N对L-酪氨酸残留酶活力均小于5%,天冬酰胺是极性氨基酸,其侧链酰胺基团在pH 5.0下带电荷,因此H98N残存少量脱羧活力;H98D、H98L、H98F、H98S和H98K则完全丧失对L-酪氨酸和L-多巴的脱羧活力;与H98相似,当M99与N100突变为其他类型氨基酸后,仅M99A、N100D、N100S保留小于10%的比酶活;S101与E102突变为结构相似的氨基酸时保留较高的酶活力,S101A对L-酪氨酸和L-多巴的比酶活分别为29.1和19.7 U/mg,分别保留66.9%和74.2%的酶活力。Ser和Ala具有相似的较小侧链基团,因此突变为Ala后仅丧失少量比酶活,S101位点其他突变体除S101N外几乎全部失活;E102D对L-酪氨酸和L-多巴的比酶活分别为30.1和16.2 U/mg,分别保留69.1%和61.3%的酶活力,Asp和Glu均为带负电的酸性氨基酸,相似的侧链性质使E102D保留较高活力,E102位点其他突变体残余比酶活均小于野生菌株(WT)的10%。
2.3 Y331及Y398位点比酶活分析
Y331和Y398位点突变体比酶活测定见图5。由图5可知,Y398位点突变为极性氨基酸后,Y398N对L-酪氨酸和L-多巴的比酶活分别为5.44和1.08 U/mg,分别保留12.5%和4.6%的酶活力;Y398S和Y398T保留低于5%的酶活力;而当398位点的Tyr突变为极性氨基酸His、Lys、Arg、Glu和Asp后,所有突变体完全失活。331位点的Tyr在催化过程中发挥无可替代的作用,Y331位点突变为Asn、Ser和His后,突变体仅保留2%~10%的酶活力。

图5 Y398和Y331位点突变体对L-酪氨酸和L-多巴的相对活力Fig.5 Relative activities of site-directed mutagenesis mutants on Y398 and Y331
2.4 突变位点的作用分析
通过对MD模拟轨迹进行聚类分析,得到模拟过程中底物与蛋白复合物的代表性构象,并对该构象进行结构分析。M99与E102形成的loop区域与底物作用力分析,结果见图6。由图6可知,H98侧链吡啶环氮原子与酪氨酸的羧基形成重要氢键(N—O,0.27 nm),M99侧链的硫原子与L-酪氨酸的酚环形成π-sulfur相互作用,N100的侧链氨基与L-酪氨酸的酚氧形成氢键(N—O,0.31 nm)。组氨酸是蛋白活性位点和结合位点中最常见的极性氨基酸,其侧链pKa约为6.5,最接近生理pH,这意味着组氨酸侧链容易得到或失去质子[25]。而LbTDC中H98通过氢键作用固定底物羧基位置,使L-酪氨酸的羧基垂直于PLP的共轭π平面,这种构象有利于高效脱羧反应的进行。
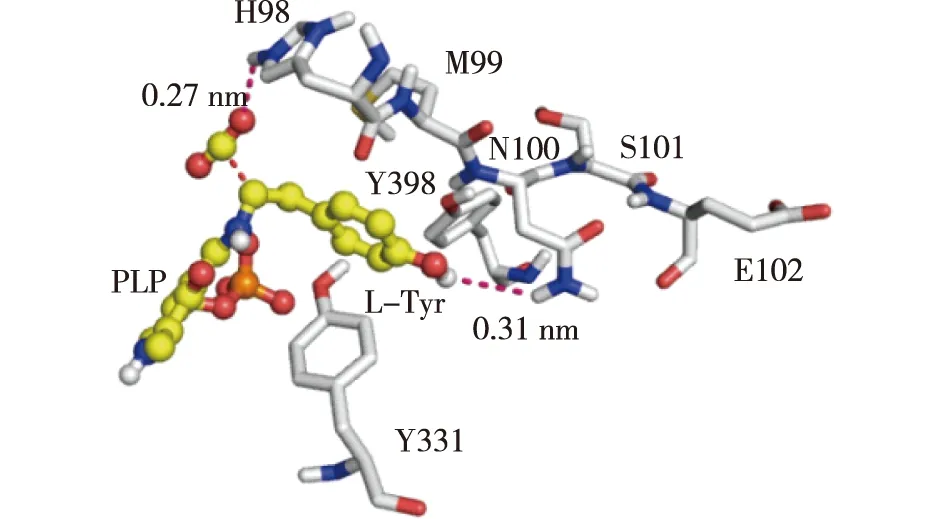
图6 LbTDC中底物与周围活性位点的相互作用Fig.6 Interactions between L-tyrosine andactive site in LbTDC
甲硫氨酸作为一种非极性氨基酸,在疏水底物(如L-酪氨酸)的结合与识别中发挥重要作用。而天冬酰胺的极性侧链有助于与其他极性或带电原子的相互作用[26]。因此当L-酪氨酸进入活性口袋后,M99与N100位点通过一系列相互作用进一步稳定底物空间构象,在底物识别与结合中发挥关键作用。101位点丝氨酸较小的侧链可以减小底物与周围氨基酸的空间位阻效应,因此当S101突变为较小的丙氨酸后,仍然保留60%以上的活力,这些具有较小位阻的氨基酸侧链为底物酚环提供空间。
H98与E102形成的loop区域在底物的识别与结合中起着至关重要的作用,通过氢键及范德华力等相互作用,使底物羧基处于有利脱羧的构象,L-酪氨酸的羧基垂直于PLP的吡啶环共轭平面。根据Dunathan假说,这种构象是脱羧反应发生的先决条件[27]。
将猪肾来源DDC结构与LbTDC结构的叠加表明,LbTDC中的Y398位点在DDC中为苯丙氨酸[17]。但Y398F突变体对L-多巴和L-酪氨酸分别残留9.8%和12%的比活力,这说明Y398位点的酚羟基在底物识别上发挥重要作用。当Y398突变为苯丙氨酸失去侧链酚羟基后,蛋白将无法快速识别底物,导致酶活力急剧下降。酪氨酸的苯环易与其他芳香族侧链形成π-π堆积作用,从结构可以看出,Y331的侧链与底物L-酪氨酸的苯环形成T-型π-π堆积作用,与H98和E102形成的loop区域一起稳定底物构象。
2.5 TDC底物结合位点的进化分析
尽管PLP依赖型氨基酸脱羧酶具有极为相似的三级折叠构象,但在进化过程中,每个脱羧酶通过进化获得与其底物特异性相关的独特结构元件[28],LbTDC也已进化出独特的底物识别区域。在LbTDC中,底物结合位点被深埋在活性位点空腔中,并延伸至PLP吡啶环的Si-面下。从PDB数据库中选取不同来源的Group Ⅱ脱羧酶晶体结构进行三级结构比对,包括人类来源组氨酸脱羧酶(PDB登录号:4E1O)、人类来源多巴脱羧酶(PDB登录号:1JS3)、果蝇来源多巴脱羧酶(PDB登录号:3K40)、短乳杆菌来源酪氨酸脱羧酶(PDB登录号:5HSJ)、人类来源谷氨酸脱羧酶(PDB登录号:2OKJ)和人类来源半胱亚磺酸脱羧酶(PDB登录号:2JIS)。比对结果如图7所示。由图7可知,Group Ⅱ脱羧酶三级序列较为保守,且都存在H98~E102的loop区域。这段loop区域延伸至活性位点空腔中,并位于底物一侧,不同类型脱羧酶的loop区域存在较大差异。这种差异使酶可以结合不同结构的底物,当底物进入活性口袋后,loop区域的氨基酸与底物发生相互作用,使底物脱去羧基转化为对应的胺产物。

图7 Group Ⅱ脱羧酶loop区域比较Fig.7 Comparison of the loop region between group Ⅱ decarboxylases
此外,在NCBI非冗余蛋白数据库中选取与LbTDC同源性大于40%的酪氨酸脱羧酶序列,将这500个蛋白序列使用Bioedit软件进行多序列比对,并对结果进行保守性分析,结果见图8。由图8可知,H98与E102形成的loop区域氨基酸在酪氨酸脱羧酶中高度保守,H98与S101位点在部分酪氨酸脱羧酶中分别为结构相似的Gln或Ala。为了验证保守性分析结果,构建H98Q突变体并测定其酶活力。H98Q对L-酪氨酸和L-多巴的比酶活分别为23.6和11.3 U/mg,分别保留53.8%和50.1%的酶活力。H98Q与S101A突变体保留较高比酶活与保守性分析结果相一致,这也证明了TDC关键活性位点在进化过程中的高度保守性。

字母大小表示在保守性分析中,该氨基酸在此位点所占比例对应纵坐标的概率图8 H98~E102间形成的loop区域保守性分析Fig.8 Conservative analysis of H98-E102 loop
3 结语
在蛋白晶体结构的基础上,使用Discovery Studio软件进行分子对接,得到酶与底物复合物结合结构。通过作用力分析获得与底物结合和催化相关的重要位点,并对这些位点进行定点突变。当这些位点突变为其他类型氨基酸后,酶活力大幅度下降。结构与进化分析确定了H98~E102间形成的loop区域、Y398和Y331位点在底物识别与特异性结合中的重要作用。通过氢键及π-π堆积作用固定底物构象,促进高效脱羧反应的发生。本研究为TDC的分子改造和生物催化法合成酪胺提供了结构基础和指导意义。
