黄连素抗动脉粥样硬化的效果及作用机制研究
2021-02-27任晓娜张晓丽宋超
任晓娜 张晓丽 宋超
动脉粥样硬化是一种血管内皮的慢性无菌炎症,长期血脂异常会导致动脉粥样硬化[1]。动脉粥样硬化又会加剧心脑血管病的发病率和死亡率。Barrington等[2]研究中显示,脑卒中形成主要是由动脉粥样硬化导致的,所以降低血脂能逆转、控制以及延缓动脉粥样硬化可以预防脑卒中的发生。杨硕等[3]研究显示,与其他药物比较,黄连素帮助患者节约大量医药经费,使经济条件差的动脉粥样硬化患者得到了有效治疗,减少了心脑血管疾病的发生。杨志等[4]研究显示,黄连素是一种从植物中提取出的生物碱,在临床上用途十分广泛,其中就有调节血脂作用,而在动脉粥样硬化形成中血脂发挥重要作用。蓝鹏等[5]研究显示,黄连素既能增强肝脏超氧化物歧化酶的活性,还能降低血脂三酰甘油(TG)、总胆固醇(TC),促进脂类分解代谢,提高抗氧化能力。因此本文研究黄连素对动脉粥样硬化小鼠抗动脉粥样硬化的效果及作用机制,报告如下。
1 材料与方法
1.1 实验动物 选取30只健康雄性SD小鼠,年龄9~11个月,平均年龄(9.6±0.4)个月,体重200~260 g,平均体重(210.0±9.6)g。由北京科奥力饲料有限公司提供[合格证号:京动(2000)第015号],小鼠均放于无菌干净笼子里喂养,温度维持在(23.0±1.6)℃,饮用水和食物均进行高温以及高压消毒。
1.2 药物与仪器 黄连素(成都深科制药有限公司,规格:30 mg/片),辛伐他汀(杭州默沙东制药有限公司,规格20 mg×7 s)。免疫比浊法试剂盒[贝克曼库尔特商贸(中国)有限公司)],酶联免疫试剂盒(北京维德维康生物技术有限公司)。
1.3 方法
1.3.1 动脉粥样硬化模型建立:选取24只小鼠制作模型,建模型前所有小鼠禁止饮食饮水10 h,参考左雅敏等[6]文献建立动脉粥样硬化小鼠模型,具体操作:24只小鼠均每日喂养高脂饲料(2%胆固醇、3%猪油、0.5%胆酸钠、0.2%丙基硫氧嘧啶和94.3%的基础饲料)加维生素D3粉剂(1.25×106U/kg)每隔30 d在小鼠右下肢肌内注射维生素D3(3×105U/kg),连续造模90 d。
1.3.2 用药及分组:将建模成功的24只小鼠随机分为模型组、辛伐他汀组、黄连素低剂量组、黄连素高剂量组,每组6只;正常组小鼠6只。辛伐他汀组给予小鼠辛伐他汀10 mg·kg-1·d-1配成悬液灌胃2周,黄连素低剂量组给予小鼠黄连素8 mg·kg-1·d-1配成悬液灌胃2周,黄连素高剂量组给予小鼠黄连素 18 mg·kg-1·d-1配成悬液灌胃2周。正常组及模型组给予等体积的无菌0.9%氯化钠溶液灌胃治疗。治疗期间所有小鼠自由饮食饮水。
1.3.3 病理学观察:小鼠断头处死后,解剖腹腔快速取出新鲜大鼠肝脏,放置于甲醛溶液中,固定24 h,常规脱水、透明、石蜡包埋,进行切片、HE染色,光镜下常规组织学检查。
1.3.4 5组小鼠血脂检测:采取禁食12 h后的小鼠眼眶静脉丛血液5 ml,离心后取血清,使用免疫比浊法检测TC、TG、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平。
1.3.5 5组小鼠动脉粥样硬化斑块检测:使用美国GE-LOGLQ3型彩色超声多普勒仪检测。离颈内外动脉分叉1 cm处的测量值为颈动脉管腔直径(CCAD),离颈内外动脉分叉1 cm测定颈动脉内膜-中层厚度IMT>1.2 mm提示动脉粥样硬化,>1.5 mm提示斑块形成。
1.3.6 血清炎性因子浓度检测:采用酶联免疫吸附试验检测C-反应蛋白(CRP)、白介素-6(IL-6)水平。

2 结果
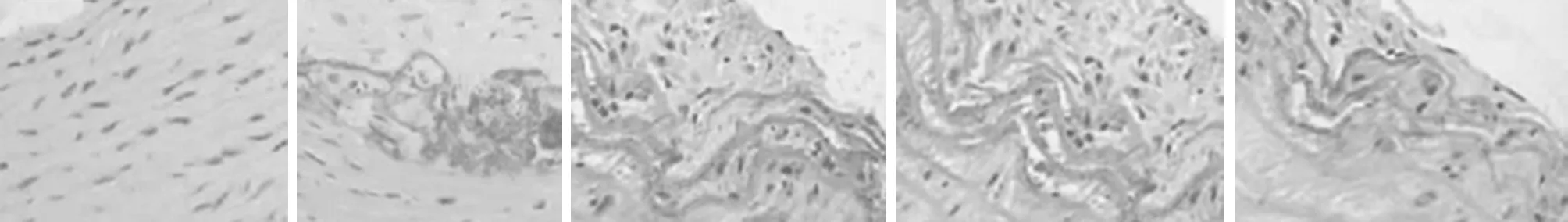
2.1 5组小鼠病理学形态观察 模型组与正常组比较,小鼠主动脉内皮细胞破损,慢性炎症病变、泡沫细胞形成,并且粥样硬化斑块形成等明显的病理性形态结构改变;与模型组相比,辛伐他汀组、黄连素低剂量组、黄连素高剂量组粥样硬化病变程度明显减轻;黄连素高剂量组与新伐他丁组、黄连素低剂量组比较,黄连素高剂量组粥样硬化病变减轻程度最为显著。见图1。
2.2 5组小鼠血脂变化比较 模型组与正常组比较,模型组TC、TG、LDL-C水平均高于正常组(P<0.05),HDL-C水平低于正常组(P<0.05);辛伐他汀组TC、TG、LDL-C水平均低于黄连素低剂量组,高于黄连素高剂量组(P<0.05),HDL-C水平高于黄连素低剂量组,低于黄连素高剂量组(P<0.05);黄连素高剂量组TC、TG、LDL-C水平低于辛伐他汀组(P<0.05),HDL-C水平高于辛伐他汀组(P<0.05)。见表1。
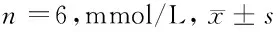
表1 5组小鼠血脂变化比较
2.3 5组小鼠动脉粥样硬化斑块比较 模型组斑块面积、IMT均高于正常组(P<0.05),CCAD低于正常
组(P<0.05);辛伐他汀组斑块面积、IMT低于黄连素低剂量组,高于黄连素高剂量组(P<0.05),CCAD高于黄连素低剂量组,低于黄连素高剂量组(P<0.05);黄连素高剂量组斑块面积、IMT低于辛伐他汀组(P<0.05),CCAD高于辛伐他汀组,差异有统计学意义(P<0.05)。见表2。

表2 5组小鼠动脉粥样硬化比较
2.4 5组小鼠血清炎性因子浓度比较 模型组血清CRP、IL-6水平均高于正常组(P<0.05);辛伐他汀组血清CRP、IL-6水平低于黄连素低剂量组,高于黄连素高剂量组(P<0.05);黄连素高剂量组血清CRP、IL-6水平低于辛伐他汀组(P<0.05)。见表3。
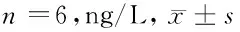
表3 5组小鼠血清炎性因子浓度比较
3 讨论
动脉粥样硬化是促进脑血管时间发生的主要因素。李艳君等[7]研究中显示,颈内动脉系统短暂性脑缺血发作及其他机型脑血管事件发生的主要因素是由斑块破裂、出血、脱落和栓子阻塞远端血管造成。孙龙飞等[8,9]研究中显示,动脉粥样硬化的病理机制非常复杂,其中逐渐得到认可的有氧化应激损伤和炎性反应学说,然而抑制动脉粥样硬化的发生发展可以通过药物抑制氧化反应激和炎性反应。
作为从黄连、三颗针、黄柏中提取的季胺类化合物黄连素属于喹啉类生物碱[10]。邓晓威等[11]研究显示,黄连素具有抗菌性广,毒副作用小的特点,临床常用于清热解毒、抗肠道细菌感染类应用。柴华等[12]研究发现,黄连素可以阻止类脂类的吸收,阻止游离脂肪酸通过黏膜上皮细胞的再脂化作用,降低血脂,提高机体抗氧化能力。李兴明等[13]的研究显示,黄连素在临床应用上多为盐酸黄连素,是降LC药物,经口服吸收水解后为相应的A羟酸结构,是早期限速酶催化胆固醇合成的主要结构。仲婷婷等[14]研究显示,黄连素可以降低TC、VLDL-C、LDL-C的血清浓度,还可以不同程度的提高HDL-C和降低TG的血浆浓度。本研究结果显示,黄连素高剂量对动脉粥样硬化小鼠治疗后,TC、TG、LDL-C水平均降低,HDL-C水平升高,说明使用黄连素高剂量治疗动脉粥样硬化小鼠,可以调控血脂水平,降低血脂。
目前人类死亡的主要原因之一是由动脉粥样硬化导致心脑血管疾病引起的。冠心病、缺血性脑卒中的主要发病机制是由动脉粥样硬化斑块破裂、出血、脱落等引起[15,16]。本研究结果显示,黄连素高剂量对动脉粥样硬化小鼠进行治疗后,动脉粥样硬化小鼠斑块面积、IMT平降低,CCAD升高,说明黄连素高剂量治疗动脉粥样硬化,可以缩小动脉粥样硬化斑块面积。
CRP、IL-6是重要的炎性免疫因子。IL-6主要是在急性反应期刺激肝细胞产生急性期反应蛋白的功效[17]。CRP可以诱导B淋巴细胞终末期的分化,刺激T淋巴细胞。古贤君等[18]研究中显示,CRP是炎性反应重要的下游标记物,是重要的急性期反应蛋白,在机体正常情况下水平非常低,在炎症的刺激下,水平会急剧上升,是前炎性反应最灵敏的标志物。曾庆范等[19]研究显示,CRP、IL-6促使单细胞趋化蛋白释放,组织因子释放,使黏附分子表达增加。钟承韵等[20]研究中显示,CRP、IL-6促进血管平滑肌细胞增殖迁移,CRP、IL-6在动脉粥样斑块的损伤中均有表达。本研究结果显示,黄连素高剂量对动脉粥样硬化小鼠进行治疗后,血清CRP、IL-6水平均降低,说明使用黄连素高剂量治疗动脉粥样硬化可以降低炎性因子水平,提高免疫能力。
综上所述,黄连素对动脉粥样硬化小鼠抗动脉粥样硬化可以调控血脂水平,从而起到降低血脂作用,缩小动脉粥样硬化斑块面积,降低炎性因子水平,提高免疫能力。
