miR-138靶向GRK6调控骨关节炎软骨细胞增殖和凋亡的研究
2021-02-27樊萍冯秀媛胡楠蒲丹吕晓虹孙怡宁何岚
樊萍 冯秀媛 胡楠 蒲丹 吕晓虹 孙怡宁 何岚
骨关节炎(osteoarthritis,OA)患者临床表现主要为关节僵硬、疼痛、肿胀等,性别、年龄及炎性反应等多种因素均与OA发生发展密切相关[1]。OA病理特征主要为关节软骨退变、软骨细胞外基质减少,软骨细胞是软骨组织中主要细胞类型,且具有维持软骨完整性功能,并可有效维持软骨损伤及重构的平衡关系[2,3]。研究表明,微小RNA(microRNA,miRNA)可通过调控软骨组织降解及软骨细胞凋亡而参与OA发生及发展过程[4,5]。但部分miRNA在OA发生发展过程中的作用机制尚未完全阐明。通过寻找新型miRNA探究其在OA致病机制中的作用有助于寻找治疗该病的新方法。研究表明微小RNA-138(microRNA-138,miR-138)通过抑制WNT/β-Catenin信号通路而促进NEK2诱导的软骨细胞存活[6]。但关于miR-138如何通过调控下游靶基因而发挥作用尚未可知。靶基因预测显示G蛋白偶联受体激酶 6(G protein-coupled receptor kinase 6,GRK6)可能是miR-138的靶基因,有研究指出抑制GRK6表达可减弱IL-1β诱导的软骨细胞外基质降解,减轻软骨细胞炎症损伤[7]。但OA软骨细胞中GRK6的表达水平是否受miR-138表达的影响尚未可知。因此,本研究通过探讨miR-138与GRK6的靶向调控作用,分析其对OA软骨细胞增殖及凋亡的影响及潜在作用机制,以期为OA治疗奠定理论基础。
1 材料与方法
1.1 材料 庆大霉素、RPMI 1640培养基、胰蛋白酶、胎牛血清均购自上海生工生物工程有限公司;Ⅱ型胶原酶购自美国Sigma公司;Lipofectamine2000、Trizol试剂购自美国Invitrogen公司;荧光素酶报告基因检测试剂盒购自美国Promega公司;反转录试剂盒购自大连宝生物工程有限公司;实时荧光定量PCR试剂盒购自北京全式金生物技术有限公司;miR-138 mimics与无意义小分子阴性对照片段(miR-con)、GRK6小干扰RNA(si-GRK6)及阴性对照(si-con)均购自美国Invitrogen公司;青霉素与链霉素均购自美国Sigma公司;兔抗人GRK6、Bcl-2、Bax抗体、辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗均购自美国Abcam公司;ECL化学发光试剂盒、BCA蛋白浓度测定试剂盒均购自美国Thermo Fisher公司;miR-138、U6、GRK6、β-actin引物均由南京金斯瑞生物科技有限公司合成。
1.2 方法
1.2.1 人原代OA细胞分离及培养:选取2015年2月至2018年3月我院经关节镜清理及膝关节清理的OA患者30例为研究对象(OA组),其中男16例,女14例;年龄53~65岁,平均年龄(58.62±7.36)岁;根据国际软骨修复协会分级标准,患者宏观评分均为Ⅰ级损伤[8]。同时选取同期医院急诊外科就诊的紧急创伤性截肢患者5例(Normal组),切取正常软骨标本。排除标准:类风湿性关节炎患者;化脓性关节炎患者。本研究经医院伦理委员会批准,患者知情且签署同意书。参照相关文献[9]分离软骨细胞:无菌条件下,剪切OA患者软骨标本及非OA患者正常软骨标本,去除标本多余纤维结缔组织,软骨组织剪切成方块(1 cm3),PBS(含有青霉素钠、庆大霉素双抗)洗涤5次,加入0.25%胰蛋白酶消化,放入37℃恒温培养箱内消化30 min,弃上清,加入0.2%Ⅱ型胶原酶,放入37℃恒温培养箱内消化16 h,每隔4 h收集细胞,用200目滤网过滤细胞,4℃条件下,1 000 r/min转速离心5 min,弃上清,用含有10%胎牛血清及双抗的RPMI 1640培养液洗涤3次,细胞接种于培养瓶内(密度1×105/ml),放入37℃恒温培养箱继续培养,取对数生长期软骨细胞接种于6孔板(密度1×105/ml),经甲苯胺蓝染色及Ⅱ型胶原免疫细胞化学染色鉴定软骨细胞。
1.2.2 实验分组:取对数生长期OA软骨细胞,以1×105/ml的密度接种于6孔板,放入37℃恒温培养箱培养16 h后收集细胞进行转染,参照Lipofectamine2000转染试剂试剂盒说明书分别将miR-138 mimics与miR-NC转染至OA软骨细胞,分别为OA+miR-138组、OA+miR-con组。为探究GRK6对OA软骨细胞生物学行为的影响,本研究分别将si-GRK6与si-con转染至OA软骨细胞,分别为OA+si-GRK6组、OA+si-con组。后续实验中为验证miR-138是否通过抑制GRK6表达而影响OA软骨细胞增殖及凋亡,分别将GRK6过表达载体(pcDNA-GRK6)与空载体(pcDNA)分别与miR-138 mimics共同转染至OA软骨细胞,分别为OA+miR-138+pcDNA -GRK6组、OA+miR-138+pcDNA组。转染6 h后更换为RPMI 1640完全培养基,继续培养48 h收集细胞。
1.2.3 qRT-PCR检测细胞中miR-138、GRK6 mRNA表达水平:用Trizol试剂分别提取各组软骨细胞总RNA,按照反转录试剂盒配置反应体系,反转录合成cDNA,以cDNA为模板进行qRT-PCR实验。miR-138、GRK6 及其内参引物分别为:miR-138正向引物:5’-AGCTGGTGTTGTGAATCAGGCCG-3’,反向引物:5’-TGGTGTCGTG GAGTCG-3’;U6正向引物:5’-CTC
GCTTCGGCAGCACA-3’,反向引物:5’-AACGCTTCAC
G AATTTGCGT-3’;GRK6 正向引物:5’-CAGCCCATG
GAGCTCGAGAA C-3’,反向引物:5’-G GTGCA AACTGTTAAACGGCGC-3’;β-actin正向引物:5’-TGCTGT CCCTGTATGCCT CT-3’,反向引物:5’-TGATGTCACGCACGATTT-3’。引物均由上海生工生物工程股份有限公司合成。qRT-PCR反应体系:cDNA 2 μl,正反向引物各1 μl,SYBR Premix Ex Taq Ⅱ(2×)10 μl,ddH2O补足体系至20 μl;反应条件:95℃ 2 min,95℃ 30 s,60℃ 30 s,72℃ 30 s,共循环40次。应用LightCycler 480荧光定量PCR仪收集荧光信号并分析溶解曲线,采用 2-ΔΔCt法计算miR-138、GRK6 mRNA相对表达量,实验重复3次。
1.2.4 细胞增殖实验:OA软骨细胞转染48 h后收集细胞,细胞以3×105个/ml的密度接种于96孔板,每孔加入20 μl MTT,继续培养4 h,每孔加入150 μl DMSO,分别于作用时间24 h、48 h、72 h时在490 nm波长下应用酶标仪读取各孔吸光度值(OD),实验重复3次。
1.2.5 细胞凋亡实验:收集各组OA软骨细胞,胰蛋白酶消化,收集细胞,预冷PBS洗涤细胞,10 000 r/min转速(4℃)离心5 min,弃上清,依次加入5 μl膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)与碘化丙锭(PI),充分混匀,室温避光孵育20 min,应用流式细胞仪检测各组细胞凋亡率,实验重复3次。
1.2.6 荧光素酶报告基因实验:分别构建野生型(GRK6-WT)与突变型GRK6-3’UTR序列的报告基因质粒(GRK6-MUT),收集对数生长期OA软骨细胞,参照Lipofectamine2000转染说明书进行miR-138 mimics与GRK6荧光素酶报告载体共转染,OA软骨细胞分为GRK6-WT+miR-138 mimics共转染组;GRK6-WT+miR-con共转染组;GRK6-MUT+miR-138 mimics共转染组;GRK6-MUT+miR-con共转染组,转染后继续培养48 h,检测不同组相对荧光素酶活性,实验重复3次。
1.2.7 蛋白免疫印迹(Western blot)检测GRK6、Bcl-2、Bax蛋白表达:收集各组对数生长期软骨细胞,加入预冷RIPA缓冲液裂解,提取细胞总蛋白,参照BCA蛋白浓度测定,按照试剂盒说明书检测蛋白浓度并定量蛋白,SDS-PAGE凝胶电泳反应分离蛋白,反应结束后经电转移至PVDF膜,5%脱脂牛奶封闭1 h,加入蛋白一抗(稀释比1∶1 000)放入4℃孵育24 h,TBST洗涤,加入相应二抗混合(稀释比1∶2 000),TBST洗涤,ECL显影,曝光,应用ImageJ软件分析条带灰度值。

2 结果
2.1 miR-138和GRK6在人原代OA软骨细胞及正常细胞中的表达 OA软骨细胞中miR-138的表达水平显著低于Normal组,差异有统计学意义(P<0.05);GRK6 mRNA及蛋白表达水平显著升高,差异有统计学意义(P<0.05)。见图1,表1。
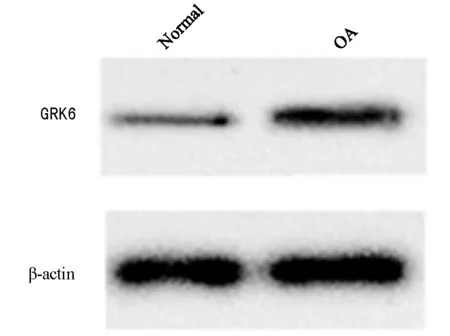
图1 Westen blot检测人原代OA软骨细胞及正常细胞中GRK6蛋白的表达

表1 人原代OA软骨细胞及正常细胞中miR-138和GRK6的表达
2.2 转染miR-138对人原代OA软骨细胞增殖的影响 与Normal组比较,OA组软骨细胞活力显著降低,差异有统计学意义(P<0.05);OA软骨细胞中转染miR-138 mimics后,与OA+miR-con组比较,软骨细胞活力显著升高,差异有统计学意义(P<0.05)。见表2。

表2 转染miR-138对人原代OA软骨细胞增殖的影响
2.3 miR-138过表达对人OA软骨细胞凋亡的影响 相对于Normal组,OA组软骨细胞凋亡率显著升高(P<0.05);与OA+miR-con组相比,OA+miR-138组软骨细胞凋亡率显著降低(P<0.05),Western blot检测结果显示,OA组软骨细胞中Bcl-2蛋白表达量显著降低(P<0.05),Bax蛋白表达量显著增加(P<0.05);与OA+miR-con组比较,OA+miR-138组软骨细胞中Bcl-2蛋白表达量显著升高,差异有统计学意义(P<0.05),Bax蛋白表达量显著降低,差异有统计学意义(P<0.05)。见表3,图2。

表3 转染miR-138对风湿关节炎关节成纤维样滑膜细胞凋亡的影响

图2 流式细胞术检测细胞凋亡和Western blot检测Bax和Bcl-2蛋白的表达
2.4 沉默GRK6对人OA软骨细胞增殖和凋亡的影响 与OA+si-con组比较,OA+si-GRK6组软骨细胞增殖活力显著升高(P<0.05),细胞凋亡率显著降低(P<0.05),Bcl-2蛋白表达水平显著升高(P<0.05),而Bax蛋白表达水平显著降低(P<0.05)。见图3,表4。
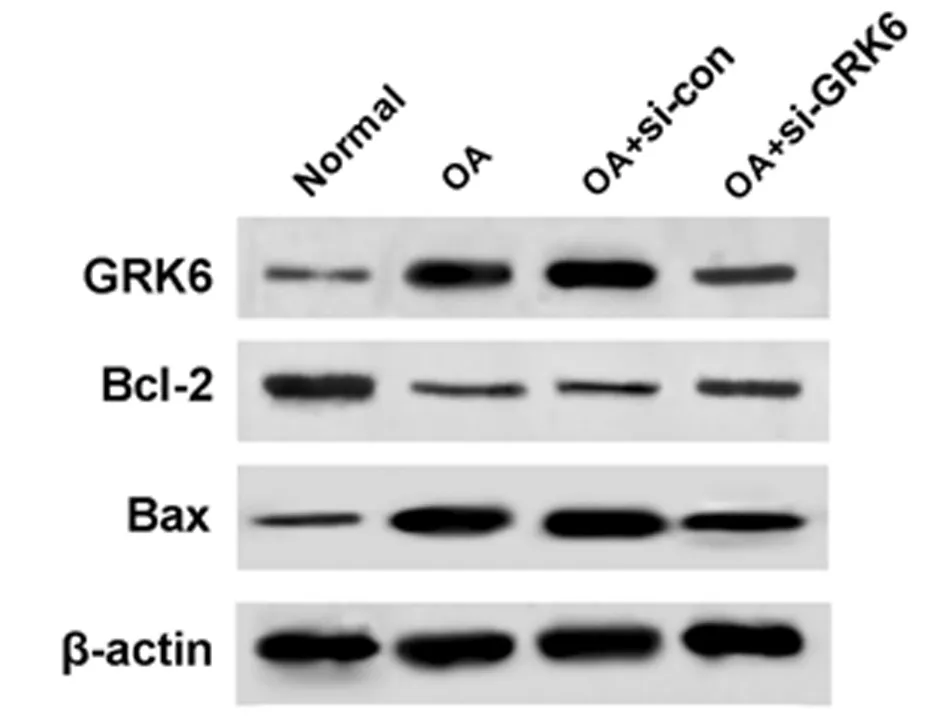
图3 Western blot检测GRK6、Bax和Bcl-2蛋白的表达

表4 沉默GRK6对人OA软骨细胞增殖和凋亡的影响
2.5 miR-138靶向调控GRK6的表达 靶基因预测显示miR-138与GRK6的3’UTR区存在结合位点。双荧光素酶报告实验结果显示,与miR-con、GRK6-WT共转染组比较,miR-138 mimics、GRK6-WT共转染组细胞荧光素酶活性显著降低(P<0.05);与miR-con、GRK6-MUT共转染组比较,miR-138 mimics、GRK6-MUT共转染组细胞荧光素酶活性无明显变化(P>0.05)。Western blot法检测结果显示,与miR-con组比较,miR-138组细胞中GRK6蛋白表达下调(P<0.05);与anti-miR-con组比较,anti-miR-138组细胞中GRK6蛋白表达上调(P<0.05)。见图4,表5、6。

图4 miR - 138靶向调控GRK6的表达;A:GRK6的3’UTR中含有与miR-138互补的核苷酸序列;B:Western blot法检测miR-138对GRK6蛋白表达的影响

表5 双荧光素酶报告实验
2.6 过表达GRK6逆转了miR-138对人OA软骨细胞增殖的促进和凋亡的抑制作用 与OA+miR-138+

表6 miR-138调控GRK6的表达
pcDNA组比较,OA+miR-138+pcDNA -GRK6组软骨细胞增殖活力显著降低(P<0.05),细胞凋亡率显著升高(P<0.05),Bcl-2蛋白表达量显著降低(P<0.05),Bax蛋白表达量显著升高(P<0.05)。见图5,表7。
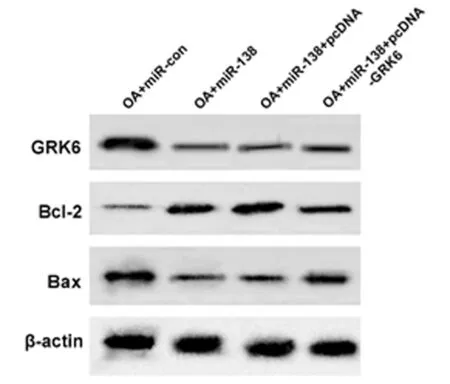
图5 Western blot检测GRK6、Bax和Bcl-2蛋白的表达

表7 过表达GRK6逆转了miR-138对人OA软骨细胞增殖的促进和凋亡的抑制作用
3 讨论
miRNA属于一类内源性非编码RNA,可通过抑制下游靶基因翻译或促进靶基因降解而参与细胞增殖、凋亡及器官发育等多种生理病理过程,研究表明miR-138在肝细胞癌等多种肿瘤组织或细胞系中呈低表达,并可抑制肿瘤细胞增殖、迁移及侵袭并诱导细胞凋亡[10-13]。研究表明miR-138可通过靶向沉默信息调节因子1(SIRT1)而调控膀胱癌细胞增殖及凋亡[14]。相关研究报道指出年龄相关性白内障患者晶状体囊膜中miR-138表达上调,其可通过靶向负性调控SIRT1表达促进晶状体上皮细胞凋亡[15],与其研究结果不同,本研究结果显示,OA软骨细胞中miR-138的表达下调,分析原因可能为不同组织或细胞miR-138表达不同。因此miR-138在OA软骨细胞中的作用及机制仍需进一步研究,本研究结果显示,上调miR-138表达后,OA软骨细胞增殖能力增强,细胞凋亡率降低,Bcl-2蛋白表达上调,Bax蛋白表达下调,已有研究报道指出Bcl-2、Bax基因在软骨细胞凋亡过程中发挥重要作用,上调Bcl-2表达及下调Bax表达可抑制细胞凋亡的发生,探究根本原因在于其可阻断细胞内部自身凋亡机制的启动[16]。说明miR-138过表达可通过调控细胞凋亡基因表达而抑制OA软骨细胞过度凋亡。提示miR-138过表达可能是抑制OA软骨破坏的重要机制。
GRK6在多发性骨髓瘤患者血浆及其细胞系中呈高表达,下调GRK6表达可诱导细胞周期停滞于G0/G1期,抑制多发性骨髓瘤细胞增殖[17,18]。研究表明GRK6表达水平升高可促进机体内炎性巨噬细胞分泌、增强机体炎性反应从而参与多种病理过程[19,20]。本研究结果显示GRK6在OA软骨细胞中的表达上调,与文献报道[17-20]相似,说明GRK6表达水平升高可能促进OA发生发展。本研究通过抑制GRK6表达,结果发现OA软骨细胞增殖能力升高,细胞凋亡能力明显受到抑制,表明抑制GRK6表达与miR-138过表达对OA软骨细胞增殖及凋亡的作用相同。进一步研究分析发现miR-138可靶向负性调控GRK6表达,GRK6过表达可部分逆转miR-138过表达对OA软骨细胞增殖及凋亡的作用。说明miR-138可负向调控GRK6表达而抑制OA软骨细胞凋亡,促进细胞增殖。提示miR-138可能作为OA软骨修复因子。
综上所述,miR-138在OA软骨细胞中低表达,而miR-138过表达可通过负性调控GRK6表达而增强OA软骨细胞增殖,抑制细胞凋亡,为OA治疗及药物研发提供新方向。但miR-138、GRK6能否作为OA进展过程中的潜在靶点还需深入研究。
