黄芩汤通过调节ILC3s-Th细胞反应减轻小鼠的溃疡性结肠炎
2021-02-27周长琳郑学宝黄晓其苏冀彦李木霞陈志维李敏瑶迟宏罡
周长琳,郑学宝,黄晓其,苏冀彦,李木霞,陈志维,李敏瑶,迟宏罡
1广东医科大学第一临床医学院,广东 湛江524023;2广州中医药大学中药学院,广东 广州510006;3东莞广州中医药大学中医药数理工程研究院,广东 东莞523000;4佛山市妇幼保健院南方医科大学附属佛山妇幼保健院科研实验室,广东 佛山528000;5广东医科大学第二临床医学院,广东 东莞523000
溃疡性结肠炎(UC)是一种慢性、复发性肠道炎症性疾病。UC 的常规治疗药物如5-氨基水杨酸、糖皮质激素、免疫抑制剂等存在停药后易复发,长期用药副反应多等缺点[1]。黄芩汤治疗UC的机制研究多集中于抗炎、调节免疫及肠道菌群等[2-5],前期研究发现,黄芩汤能够调节UC大鼠Th细胞亚群细胞因子分泌的平衡,缓解实验大鼠症状[6-8]。但黄芩汤在治疗UC过程中具体通过哪些上游靶标来调节Th细胞亚群平衡有待进一步探讨。三型固有淋巴细胞(ILC3s)对UC发展过程中的Th细胞免疫反应具有重要的调节作用[9-11],其通过主要组织相容性复合物Ⅱ类(MHCⅡ)分子依赖性方式提呈抗原,促进致炎性Th细胞凋亡,极可能成为UC治疗药物的潜在靶标[12-15]。ILC3s是否可能是黄芩汤的一个作用靶标,黄芩汤在治疗UC过程中调节Th细胞亚群平衡的作用是否与ILC3s有关,目前尚未有文献报道。本研究从ILC3s-Th细胞反应调控角度,通过检测结肠炎小鼠结肠组织ILC3s、Th细胞数目以及反映Th细胞功能的相关促炎性细胞因子如IL-2、IL-17A、IL-23、TNF-α、IFN-γ等,进一步阐明黄芩汤缓解溃疡性结肠炎的作用靶标。
1 材料和方法
1.1 实验动物
雄性Ba1b/c小鼠96只,6~8周龄,体质量约25 g,购于广东省医学实验动物中心,合格证号:SYXK(粤)2018-0002。实验动物饲养于广东省微生物研究所实验动物中心,室温20~24 ℃,相对湿度40%~70%。实验过程对小鼠的处理符合动物伦理学标准,已通过实验动物伦理审查。
1.2 实验药物及试剂
黄芩、白芍、大枣、炙甘草饮片(康美药业股份有限公司);美沙拉嗪(ME 上海爱的发制药有限公司);葡聚糖硫酸钠(DSS上海源叶生物科技有限公司);苏木精、伊红、分化液、返蓝液(武汉赛维尔生物科技有限公司)、RPMI 1640培养基(Thermo fisher);胶原酶Ⅳ(Sigma)、脱氧核糖核酸酶Ⅰ(广州菲博生物科技有限公司)、分散酶(上海源叶生物科技有限公司);淋巴细胞分离液(达科为生物技术有限公司);佛波酯、离子霉素、布雷非德菌素(杭州联科生物技术股份有限公司);抗小鼠CD3、CD4、CD25、Foxp3、IFN-γ (BD Biosciences) ;Hematopoietic Lineage、CD127、MHCⅡ、RORgamma(t)的荧光抗体及Foxp3/转录因子固定破膜染色液组合和全蛋白提取试剂盒(北京索莱宝生物科技有限公司)、多因子测定试剂盒(Thermo fisher)。
1.3 仪器
GS-20 轨道式摇床(杭州米欧仪器有限公司)、L535R离心机(湘仪)、E-6000A旋转蒸发器(上海亚荣生化仪器)、A1pha1-4LDp1us冻干机(博励行)、全自动HE染色机(Thermo fisher)ML-1600平板显微镜(武汉赛维尔生物科技有限公司)、FACSCantoⅡ流式细胞仪(BD Biosciences)、Gabaxy170S+CO2细 胞 培 养 箱(Eppendorf)、BSC-1800ⅡA2超净工作台(北京东联哈尔仪器邮箱公司)、IC1000自动细胞计数仪(上海睿钰生物科技有限公司)、IX71 显微镜(O1ympus)、Luminex200 液 相 芯 片 分 析 系 统(Mi11ipore)、ThermoMK3全波长酶标仪(Thermo fisher)。
1.4 黄芩汤制备
黄芩、芍药、大枣、炙甘草按质量比9∶6∶6∶49加入10倍蒸馏水浸泡30 min后加热至100 ℃,持续30 min,药液过滤;残余物用蒸馏水稀释8倍,相同条件下进行第2次提取。将2次提取液混合并旋蒸至浓度为1 g/mL的浓缩液,浓缩液冻干,所得冻干粉于干燥阴凉处保存备用。
1.5 动物造模及给药
将96只Ba1b/c小鼠按体质量随机分为6组,正常组、模型组(DSS)、美沙拉嗪组(ME,400 mg/kg)黄芩汤低剂量组(HL,2.275 g/kg)、黄芩汤中剂量组(HM,4.55 g/kg)、黄芩汤高剂量组(HH,9.1 g/kg),每组16只。除正常组外,其余各组小鼠自由饮用3%DSS溶液,同时黄芩汤组小鼠每日予0.1 mL/mg黄芩汤灌胃,正常组及模型组0.1 mL/mg蒸馏水灌胃。各组正常自由饮食。造模及给药持续7 d。
1.6 一般状况及疾病活动指数(DAI)评分
造模期间每天观察小鼠活动状态、精神状态、毛发光泽度,记录饮食及饮水量,并每天记录小鼠粪便性状、血便及体质量,参照Su等[22]的评分标准进行DAI评分(表1)。

表1 DAI评分标准Tab.1 Criteria for DAI scoring
1.7 结肠宏观评分
实验第8天颈椎脱臼处死小鼠,剖取结肠,测量结肠长度,观察有无水肿、充血、组织黏连,然后纵向剖开结肠,观察溃疡、坏死情况,并进行评分,0分:无水肿、充血、粘连及溃疡点,1分:局部有水肿、充血或粘连,并且每增加1个溃疡点增加1分。
1.8 各组小鼠结肠组织病理观察
切取一块病变结肠组织约0.5 cm,10%甲醛溶液固定,常规石蜡包埋并切片(3 μm),组织切片用苏木素及伊红染色,然后依次片放入从低到高浓度的乙醇和二甲苯进行脱水,中性树脂胶封片并于显微镜下观察结肠组织变化。
1.9 结肠上皮及固有层淋巴细胞提取
将各组1~10号小鼠结肠纵向剖开,PBS清洗肠内容物,于六孔板每孔中加入7 mL含5 mmo1/L EDTA2Na及1 mmo1/L DTT的RPMI 1640完全培养基,并将各组内结肠两两合并放入其中剪成约0.2 cm大小,37 ℃恒温摇床上震荡30 min进行预消化。预消化结束后用200目无菌滤布过滤预消化液,并相同条件下重复预消化1次。收集2次预消化液离心(300×g,5 min,4 ℃),保存管底细胞。在剩余结肠组织中加入4 mL含0.5 mg/mLⅣ型胶原酶、0.02 mg/mL DNA酶Ⅰ、0.4 U/mL分散酶Ⅱ的RPMI 1640完全培养基,37 ℃恒温摇床上震荡1 h进行消化。消化结束后用200目滤布过滤消化液并离心(300 g,5 min,4 ℃),保存管底细胞。采用淋巴细胞分离液分离淋巴细胞,具体操作见说明书。
1.10 流式细胞术分析相关免疫细胞变化
1.10.1 ILC3细胞及MHCⅡ 分离的淋巴细胞转移至流式管,PBS洗涤。细胞表面蛋白的流式抗体孵育:流式管中加入含流式抗体FITC-HematopoieticLineage(Lin)、eF1uor450-CD127、PE-MHC Ⅱ的0.5% BSA/PBS,室温避光孵育30 min,PBS洗涤,使用固定破膜染色液组合进行固定并破膜。然后细胞与APC-RORγ(t),室温避光孵育30 min。最后,加入100 μL0.5%BSA/PBS重悬细胞,上机检测,收集标记表面抗体阴性(Lin-)细胞,用Divasoftware(version6.0)对数据进行分析。
1.10.2 Th1、Treg细胞 在96孔板每孔加入含50 ng/mL佛波酯、1 μg/mL离子霉素、10 μg/mL 布雷非德菌素的RPMI 1640完全培养基,并加入分离的淋巴细胞,调整细胞浓度为1×107/mL,将96孔板放入37 ℃、5%CO2培养箱中培养6 h,转移含细胞的培养液于流式管中,PBS洗涤。细胞表面蛋白的流式抗体孵育:流式管中加入含流 式 抗 体FITC-CD3、PerCP-Cy ™5.5-CD4、BV510-CD25的0.5%BSA/PBS,室温避光孵育30 min,PBS洗涤,使用固定破膜染色液组合进行固定并破膜。然后细胞与BV421-Foxp3、PE-Cy™7-IFN-γ,室温避光孵育30 min。最后,加入100 μL 0.5%BSA/PBS 重悬细胞,上机检测,收集标记表面抗体阳性(CD3+)细胞,用Divasoftware(version6.0)对数据进行分析。
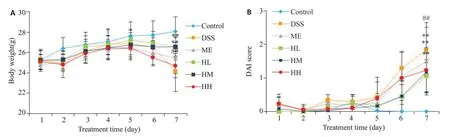
图1 小鼠的体征变化Fig.1 Changes of body weight(A)and DAI score(B)of the mice in the 6 groups(n=16).##P<0.01 vs control group;**P<0.01 vs DSS group.DSS: Dextran sulphate sodium; ME: Mesalazine; HL: Huangqin decoction low-dose; HM: Huangqin decoction medium-dose; HH:Huangqin decoction high-dose.
1.11 细胞因子检测
取各组11~16号小鼠结肠采用全蛋白提取试剂盒(北京索莱宝)提取总蛋白并检测蛋白浓度,按照多因子检测试剂盒(美国Thermo 公司)的说明书操作并用Luminex 200 液相芯片分析系统测定结肠组织中IL-17A、IL-23、IL-2、IL-13、IL-15、IL-4、TNF-α、IFN-γ含量,对细胞因子含量除以蛋白浓度所得数据进行分析。
1.12 数据分析
应用SPSS23.0统计软件进行处理,计量数据以均数±标准差表示,检测结果比较采用t检验或者单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 黄芩汤缓解DSS诱导的炎症症状
造模期间DSS组小鼠出现懒动、精神状态差、毛发缺少光泽、饮食及饮水减少等症状,黄芩汤能够改善上述症状。图1结果显示正常组DAI评分为0,与DSS组评分(2.13±0.57)对比有差异(P<0.05);黄芩汤可显著降低小鼠的DAI 评分,其中HL 组(1.27±0.21)、HM 组(1.12±0.43)、HH组(1.26±0.32)与DSS组对比均有显著差异(P<0.01)。
2.2 黄芩汤减轻DSS引起的结肠损伤
DSS诱导结肠炎后,受试小鼠结肠长度明显缩短,与正常组结肠长度相比,DSS 组结肠长度缩短(P<0.01)。给予黄芩汤治疗后结肠长度明显延长,HL组结肠长度、HM组结肠长度、HH组结肠长度与DSS组对比均有差异(P<0.01,图2)。正常组结肠宏观评分为0;而DSS组结肠有明显的水肿、充血、溃疡点及粘连情况,DSS组结肠宏观评分(6.88±0.89)与正常组相比有差异(P<0.01)。给予黄芩汤治疗后结肠水肿、充血、溃疡点及粘连改善,宏观评分降低,HL、HM、HH组结肠宏观评分分别为3.00±0.85、2.73±0.88、2.69±0.85,与DSS对比均有显著差异(P<0.01)。DSS 组结肠结构出现如肠上皮损伤、肠隐窝模糊、粘膜下层及肌层水肿等明显特征;ME组的结肠上皮被修复,粘膜下层和肌层的水肿明显改善,肠隐窝加深,但较正常组浅;而在HQD组中,除肠上皮、粘膜下层和肌层的损伤有明显改善,结肠的隐窝分支较少(图3)。
2.3 黄芩汤上调结肠ILC3s比例及其表达的MHCⅡ比例

图2 小鼠结肠长度变化Fig.2 Comparison of colon length of the mice among the 6 groups.A: Whole colon (from anus to cecum). B: Changes of colon length(n=16).##P<0.01 vs control group;*P<0.05 vs DSS group.

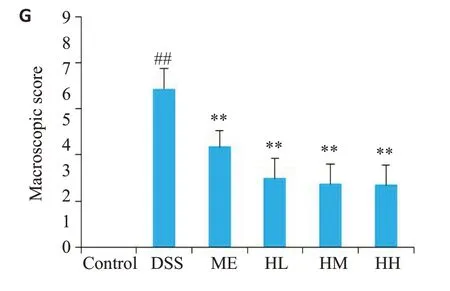
图3 小鼠结肠组织宏观及病理变化Fig.3 Macroscopic and pathological changes of the colon in the 6 groups(Original magnification:×100). A: Control group. B: DSS group. C: ME group.D:HL group.E:HM group.F:HH group.G:Changes of colonic macroscopic score in the 6 groups. n=16,##P<0.01 vs control group; **P<0.01 vs DSS group.
小鼠结肠组织ILC3s的结果如图4,与正常组小鼠结肠ILC3s比例[(27.83±3.39)%]相比,DSS组小鼠结肠上皮及固有层ILC3s细胞比例[(4.40±5.09)%],显著减少(P<0.01)。给予黄芩汤治疗后,HM、HH组与DSS组相比显著增加(P<0.05)。DSS组ILC3s的MHCⅡ表达比例为[(0.92±1.2)%],与正常组MHCⅡ表达比例[(6.89±3.18%)]相比显著减少(P<0.01)。而黄芩汤可增加ILC3s的MHCⅡ表达比例,HL、HM、HH组MHCⅡ表达量分别为[(4.37±2.88)%]、[(4.02±0.46)%]、[(5.60±2.13)%],与正常组相比HM组有差异(P<0.05),HL、HH组差异显著(P<0.01,图5)。
2.4 黄芩汤上调结肠Treg比例并下调Th1比例
图6与图7流式细胞术结果显示,DSS组Treg及Th1细胞比例与正常组相比无显著差异,HL、HM组较DSS组明显增加(P<0.05,图6)。DSS组流式细胞结果显示HL、HM组与DSS组相比Th1细胞比例有显著差异(P<0.01,图7)。
2.5 黄芩汤下调促炎细胞因子
多因子检测结果显示,DSS组小鼠结肠细胞因子IL-2、IL-4、IL-13、IL-15、IL-17A、IL-23、TNF-α较正常组明显升高(P<0.05),IFN-γ较正常组有升高趋势(P=0.06)。HQD各剂量组可明显降低小鼠结肠IL-15、IL-17A、IL-23、TNF-α、IFN-γ含量(P<0.05),同时HQD可降低IL-2、IL-4、IL-10、IL-13的生成(P<0.05,图8)。

图4 流式细胞术分析各组结肠ILC3s比例的变化Fig.4 Flow cytometric analysis of the proportion of colonic ILC3s in the 6 groups.A:Representative plots.B:Statistical analysis(n=3-5).##P<0.01 vs control group;*P<0.05 vs DSS group.

图5 流式细胞术分析各组小结肠MHC II比例的变化Fig.5 Flow cytometric analysis of the proportion of colonic MHC II.A:Representative plots.B:Statistical analysis(n=3-5).##P<0.01 vs control group;*P<0.05 and**P<0.01 vs DSS group.

图6 流式细胞术分析各组小鼠结肠Th1的比例变化Fig.6 Flow cytometric analysis of the proportion of colonic Th1.A:Representative plots;B:Statistical analysis.n=3-5,**P<0.01 versus DSS group.

图7 流式细胞术分析各组小鼠结肠Treg的比例变化Fig.7 Flow cytometric analysis of the proportion of colonic Treg.A:Representative plots;B:Statistical analysis.n=3-5,*P<0.05 vs DSS group.
3 讨论
黄芩汤是《伤寒论》的治痢经典名方[17],临床上用于治疗溃疡性结肠炎[18]。在UC动物模型中,黄芩汤可通过调节Th细胞亚群的平衡显著缓解UC炎症症状[19-20]。本研究中,经黄芩汤治疗后,UC小鼠体质量增加,结肠长度增长,DAI评分降低,结肠炎症改善。此外,黄芩汤可通过上调ILC3s细胞的比例及MHCⅡ分子的表达,进而上调Treg细胞的比例和下调Th1细胞的比例,并降低多种促炎细胞因子的分泌,与本课题组的前期研究结果一致[6-7,19-20],进一步说明黄芩汤能通过调节机体免疫功能达到治疗UC的功效。

图8 各组小鼠结肠细胞因子表达比较Fig.8 Expression of pro-inflammatory cytokines in the colon in the 6 groups.A:IL-2.B:IL-4.C:IL-13.D:IL-15.E:IL-17A.F:IL-23.G:IFN-γ.H:TNF-α.n=4-6,#P<0.05 and##P<0.01 vs control group.*P<0.05 and**P<0.01 vs DSS group.
本研究首次探讨了黄芩汤对DSS诱导的UC小鼠结肠组织ILC3s及其表达的MHCⅡ分子的调节作用。ILC3s能够不依赖细胞因子、抗原及微生物源性刺激并持续地表达MHCⅡ分子,通过MHCⅡ分子加工、提呈抗原,直接诱导效应性T细胞(Th1,Th2,Th17)凋亡,因此ILC3s的MHCⅡ依赖性抗原提呈过程能够调节Th细胞亚群的平衡[9]。动物实验表明,当敲除小鼠MHCⅡ基因后,小鼠体质量降低,出现明显结肠炎症,结肠长度缩短,脾质量增加,同时结肠组织中效应性T细胞比例显著升高[13-14]。有研究表明,在IBD患者结肠组织中,ILC3s细胞及其表达的MHCⅡ降低[14,21]。从文献报道来看,当ILC3s的MHCⅡ依赖性抗原提呈功能受损时,效应性T细胞的过度活化不能够被有效抑制,进而发生结肠炎症[13-14,21]。本实验的研究结果与上述文献研究的结论相一致,初步验证了黄芩汤通过上调ILC3s,增加MHCⅡ的表达进而发挥其免疫调节作用及抗炎药效,因此ILC3s及MHCⅡ可能成为黄芩汤调节Th细胞的上游靶标。
在UC患者的肠黏膜及UC小鼠的结肠中,存在效应性T细胞与调节性T细胞的失衡,效应T细胞过度活化并产生大量促炎性细胞因子[22-24],如IL-2、IL-13、IL-15、IL-17A及IL-23,这些细胞因子可破坏肠上皮屏障、诱导效应性T细胞分化,也会促进其他促炎性细胞因子的分泌,因此机体中免疫细胞的失衡在UC的发生发展中起着重要作用[25-28]。抑制效应性T细胞相关促炎性细胞因子的表达,能够有效缓解小鼠UC症状[28],前期研究表明,黄芩汤可调节UC小鼠结肠组织效应性T细胞及Treg细胞的平衡,降低促炎性细胞因子TNF-α、IFN-γ、IL-4含量[30]。本实验还检测了Th细胞分泌的其他促炎性细胞因子如IL-2、IL-13、IL-15、IL-17A、IL-23,实验结果表明,黄芩汤可降低上述细胞因子的表达,进一步说明黄芩汤可抑制效应性T细胞的分化及功能,具有免疫调节及抗炎的药效。
综上所述,本研究利用DSS诱导的UC小鼠模型,探讨了黄芩汤可能通过调节ILC3s及MHCⅡ等Th细胞反应调节的可能上游靶标的表达,调节UC发展过程中病变部位微环境免疫稳态,发挥黄芩汤治疗UC的药效。本实验从ILC3s-Th细胞角度进一步探讨了黄芩汤缓解UC的可能作用靶点,阐释了中药复方治疗UC的可能作用机制,为黄芩汤的临床应用提供理论依据。