BALB/c小鼠单纯疱疹病毒性角膜炎复发感染模型的建立及鉴定
2021-02-26肖书毓俞莹陶津华
肖书毓 俞莹 陶津华
上海中医药大学附属曙光医院眼科 201203
单纯疱疹病毒性角膜炎(herpes simplex keratitis,HSK)是临床常见的致盲眼病,大多数感染的病毒是Ⅰ型单纯疱疹病毒(herpes simplex virus-1,HSV-1),1%~2%的临床患者最终可致盲[1]。这些致盲病例中大多是因HSV-1潜伏感染重新激活而导致,因此HSK复发模型的建立对于疾病的研究至关重要。紫外灯照射是常用的诱导HSK复发的手段,但以往所报道的实验研究中,研究者多在角膜行病毒接种后腹腔内注射中和HSV-1的异种血清抗体,以保证小鼠的存活,但异种抗HSV血清较难获取;而且有研究表明,不予腹腔内注射抗HSV血清会更贴近疾病自然发生时的机体免疫表现[2]。本研究探讨未腹腔内注射血清抗体的BALB/c小鼠复发性HSK模型的建立方法并对其进行鉴定。
1 材料与方法
1.1 材料
1.1.1实验动物及细胞 选取健康5周龄BALB/c雌性小鼠84只[上海西普尔-必凯实验动物有限公司(No.20180006001983),许可证号:SCXK(沪)2018-0006],所有小鼠均饲养于上海中医药大学动物实验中心。本研究经上海中医药大学伦理委员会批准(批文号:PZSHUTCM190222039),动物使用符合美国视觉和眼科研究协会的动物使用宣言规定。非洲绿猴肾细胞(Vero)由上海中医药大学科技实验中心提供。
1.1.2主要试剂及仪器 HSV-KOS病毒株、DMEM溶液(上海中医药大学科技实验中心病毒实验室提供);林可霉素滴眼液(上海信谊药厂有限公司);荧光素钠染色试纸(天津晶明新技术开发有限公司);戊巴比妥钠(上海国药集团化学试剂有限公司)。裂隙灯显微镜(YZ5H1,武汉科尔达医疗科技有限公司);低温离心机(5810R,德国Eppendorf公司);酶标仪(T100,美国伯乐公司);SZM系列体氏显微镜(深圳市方特科技有限公司);手持紫外灯照射仪、紫外照射防护袋(上海熙浩实业有限公司);倒置细胞显微镜(EVOS M5000,美国赛默飞世尔科技有限公司)。
1.2 方法
1.2.1实验动物分组 任取12只小鼠采用随机数字表法按照紫外灯照射时间不同分为紫外灯照射3 min组、紫外灯照射2 min 45 s组和紫外灯照射2 min 30 s组,每组4只小鼠,确定最适紫外灯照射参数。将剩余72只小鼠采用随机数字表法分为空白对照组、模型组和复发组,每组24只。
1.2.2紫外灯照射参数的筛选 右手拇指、食指抓取小鼠双耳及颈后皮肤,小指固定尾部,使小鼠右眼正面向上。右手固定小鼠后套上紫外照射防护袋,防护袋有直径0.6 cm小孔使小鼠仅右眼暴露于紫外灯照射下,将手持紫外灯置于距离小鼠右眼上方5 cm处,按照分组进行不同时间的照射。于紫外灯照射后2 min和3 d,采用林可霉素滴眼液浸润荧光素钠试纸行小鼠右眼染色,裂隙灯显微镜下观察角膜染色情况并拍照,选择最佳照射条件。
1.2.3初次感染造模 空白对照组、模型组和复发组小鼠按照10 ml/kg经腹腔内注射戊巴比妥钠行全身麻醉。采用文献[1]描述的方法用医用手术刀片在小鼠右眼角膜上皮划开#字,空白对照组术眼滴入5 μl生理盐水,模型组和复发组小鼠术眼滴入HSV-1病毒悬液1×106PFU各5 μl,用无菌棉签轻轻按摩术眼使病毒悬液充分吸收;麻醉时所有小鼠对侧眼均用5 μl生理盐水点眼以保持眼部湿润。造模后1 h观察小鼠的复苏情况,造模后1~3 d每只小鼠早晚分别用林可霉素滴眼液点眼1次,预防细菌感染,并且所有小鼠不予腹腔内注射HSV-1异种血清抗体。HSV-1病毒悬液接种后第3天,用荧光素钠试纸染色后在裂隙灯显微镜下观察到角膜上皮点状或树枝状缺损,标志初次病毒感染造模成功。然后用DMEM溶液沾湿的无菌棉棒在72只小鼠的右眼上擦拭,将棉棒放入DMEM溶液试管中震荡,离心半径15 cm,4 ℃条件下2 000 r/min离心5 min,吸出200 μl上清液放入48孔板的Vero细胞培养基中培养观察。
1.2.4复发感染造模 初次感染后5周,裂隙灯显微镜下检查小鼠双眼角膜,排除HSK的自发性复发。然后对复发组24只小鼠进行紫外灯照射(紫外线B-302 nm)复发造模处理。给予小鼠右眼2 min 45 s的紫外灯复发照射,照射剂量为2.104 mJ/cm2,将无菌棉球在紫外灯复发照射前置于1 ml DMEM培养液中,在紫外灯照射前和照射后1~7 d,每天用无菌棉棒在72只小鼠的右眼上擦拭,将角膜擦拭液相对应地放入48孔板的Vero细胞培养基中培养观察来确定病毒活化脱落。
1.2.5小鼠眼表病变表现及评价 参照Ando计分法及Trousdale计分法[3-4],裂隙灯显微镜照相和解剖显微镜下检查并评价角膜基质混浊和睑缘炎的严重程度,采用0~4分评分法[1]。(1)角膜基质混浊的评分标准 0分:角膜基质清晰透明;1分:角膜基质稍混浊;2分:角膜基质中度混浊,可透见后部虹膜特征;3分:角膜基质重度混浊不透明,但仍可判断瞳孔缘的位置;4分:角膜基质完全混浊,不能看到后部特征。(2)睑缘炎评分标准 0分:无病变;1分:轻度眼睑肿胀;2分:中度眼睑肿胀和眼球分泌物;3分:眼睑严重肿胀,中度眼周皮肤脱落和病变;4分:眼睑严重肿胀,严重的眼周皮肤脱落和病变。眼表病变总评分=角膜基质混浊程度评分+睑缘炎评分。
1.2.6复发性HSK的评判标准及鉴定指标 采用文献[5]的方法和标准,对紫外灯照射后的角膜擦拭液进行Vero细胞培养,细胞形态学发生漂浮、聚拢、变形等改变(cytopathic effect,CPE病变)且角膜荧光染色观察到角膜深层或浅层病变即可确定为HSK复发。鉴定指标包括小鼠眼表病变评分、角膜染色病变表现及CPE病变阳性率。
1.3 统计学方法
采用GraphPad 7.0统计学软件(序列号:GPS-0320559-LFUL-95242)和Excel软件进行统计分析。本研究中计量资料经W检验证实符合正态分布,以mean±SD表示,组间均数经Levene检验证实方差齐。采用随机区组设计,空白对照组、模型组和复发组小鼠紫外灯照射后不同时间点眼表症状评分比较采用重复测量两因素方差分析,多重比较采用LSD-t检验。模型组与复发组小鼠角膜擦拭液细胞培养CPE病变阳性率比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 紫外灯照射后小鼠角膜表现
紫外灯照射3 min组小鼠照射后2 min角膜染色可见轻度水肿,3 h后水肿消失,照射后3 d角膜染色可见少量色素沉着;紫外灯照射2 min 45 s组小鼠照射后2 min角膜染色可见轻度水肿,3 h后水肿消失,照射后3 d角膜染色未见色素沉着,角膜透明;紫外灯照射2 min 30 s组小鼠照射后2 min角膜无水肿,照射后3 d角膜染色未见色素沉着,角膜透明(图1)。故选取照射时长2 min 45 s为紫外灯照射最适条件。

图1 紫外灯照射后不同时间点小鼠角膜染色图 A:照射后2 min,紫外灯照射3 min组小鼠角膜轻度水肿 B:照射后3 d,紫外灯照射3 min组小鼠角膜可见轻度染色 C:照射后2 min,紫外灯照射2 min 45 s组小鼠角膜轻度水肿 D:照射后3 d,紫外灯照射2 min 45 s组小鼠角膜透明,未见色素沉着 E:照射后2 min,紫外灯照射2 min 30 s组小鼠角膜未见水肿 F:照射后3 d,紫外灯照射2 min 30 s组小鼠角膜透明,未见色素沉着Figure 1 Corneal staining of mice in different groups at different time points after ultraviolet light irradiation A:Two minutes after ultraviolet light irradiation,the 3 minutes group mice showed slight corneal edema B:Three days after ultraviolet light irradiation,a small amount of pigmentation was found in the cornea of 3 minutes group C:Two minutes after ultraviolet light irradiation,the 2 minutes 45 seconds group mice showed slight corneal edema D:Three days after ultraviolet light irradiation,no pigmentation was found,and the cornea was transparent in the 2 minutes 45 seconds group E:Two minutes after ultraviolet light irradiation,no corneal edema was found in the 2 minutes 30 seconds group F:Three days after ultraviolet light irradiation,no pigmentation was found,and the cornea was transparent in the 2 minutes 30 seconds group
2.2 初次病毒感染后和紫外灯照射后小鼠眼表表现
复发组小鼠初次病毒感染后3 d右眼出现角膜混浊,角膜呈点状染色,分泌物增多。初次病毒感染后1周,复发组小鼠右眼角膜逐渐恢复光滑。初次病毒感染后5周,模型组和复发组小鼠眼睑轻度肿胀,角膜透明。紫外灯照射后3 d,空白对照组小鼠角膜透明、光滑,复发组小鼠角膜水肿 、混浊,出现地图样或树枝状染色(图2)。复发组有75%(18/24)的小鼠出现较明显的眼表感染症状。
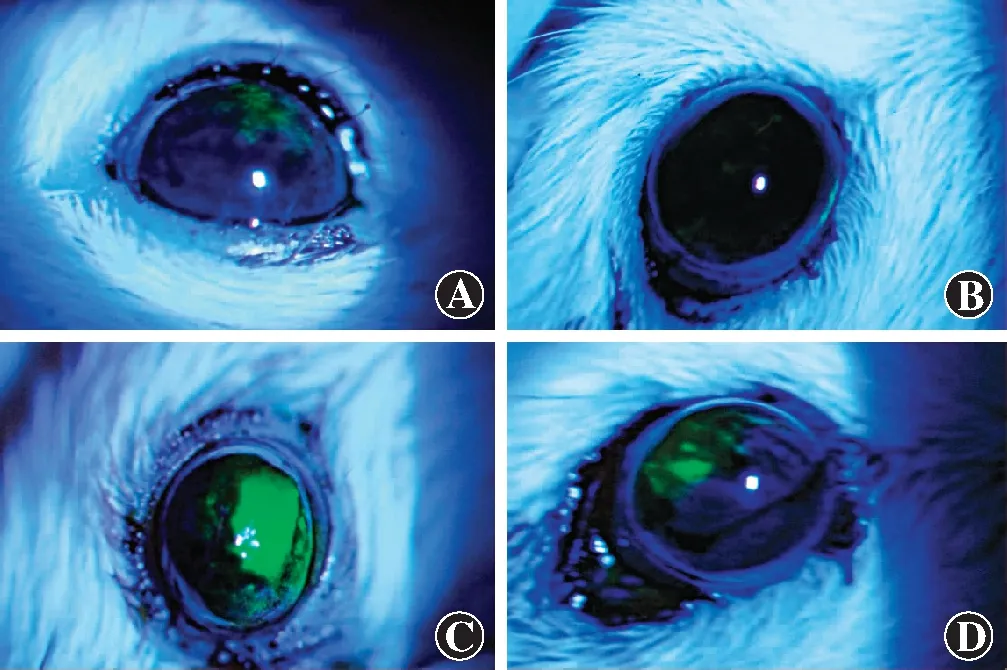
图2 初次病毒感染后和紫外灯照射后小鼠角膜染色图 A:初次病毒感染后3 d复发组小鼠角膜呈点状染色 B:紫外灯照射后3 d,空白对照组小鼠角膜光滑、透明 C:紫外灯照射后3 d,复发组小鼠角膜混浊,呈现地图样染色,中度眼周皮肤脱落 D:紫外灯照射后3 d,复发组小鼠角膜出现树枝状染色,轻度眼周皮肤脱落Figure 2 Corneal staining of mice in different groups after ultraviolet light irradiation and initial viral infection A:Three days after the initial viral infection,the cornea of the mice in the recurrence group showed punctate staining B:Three days after ultraviolet light irradiation,the cornea of the mice in the blank control group showed smooth and transparent C:Three days after ultraviolet light irradiation,the cornea of the mice in the recurrence group showed opacity,geographic staining,and moderate periocular skin exfoliation D:Three days after ultraviolet light irradiation,the corneal staining of the mice in the recurrence group showed dendritic staining and mild periocular skin exfoliation
2.3 各组小鼠紫外灯照射后不同时间点眼表病变症状评分
紫外灯照射后1 d,复发组小鼠眼表病变症状评分较空白对照组小鼠高,差异有统计学意义(P=0.047),复发组小鼠眼表病变症状评分较模型组小鼠略高,差异无统计学意义(P>0.05)。紫外灯照射后3 d,复发组小鼠眼表病变症状评分较空白对照组、模型组小鼠高,差异均有统计学意义(P=0.002、0.003)。紫外灯照射后7 d,复发组小鼠眼表病变症状评分较空白对照组小鼠高,差异有统计学意义(P=0.024);复发组小鼠眼表病变症状评分较模型组小鼠略高,差异无统计学意义(P=0.069)(表1)。

表1 各组小鼠紫外灯照射后不同时间点眼表症状评分比较(mean±SD,分)Table 1 Comparison of ocular symptom score among different groups after ultraviolet light irradiation at different time points (mean±SD,score)组别眼数紫外灯照射后不同时间点眼表症状评分0d1d3d7d空白对照组240.167±0.3730.333±0.4710.000±0.0000.167±0.373模型组241.500±0.5001.500±0.7640.833±0.3731.000±0.577复发组240.833±0.3732.667±0.943a5.167±2.267ab3.000±1.155a 注:F组别=48.84,P<0.01;F时间=5.00,P<0.01.与相应时间点空白对照组比较,aP<0.05;与相应时间点模型组比较,bP<0.05(重复测量两因素方差分析,LSD-t检验) Note:Fgroup=48.84,P<0.01;Ftime=5.00,P<0.01.Compared with the blank control group,aP<0.05;Compared with the model group,bP<0.05(Repeated measurement two-way ANOVA,LSD-t test)
2.4 小鼠角膜擦拭液细胞培养CPE病变表现
小鼠角膜擦拭液细胞培养后5 d,复发组共有17只小鼠角膜擦拭液样本的细胞培养出现CPE病变,细胞培养液未变色(图3),阳性率为71%(17/24),模型组CPE病变阳性率为8%(2/24),细胞培养液颜色变黄,复发组CPE病变阳性率明显高于模型组,差异有统计学意义(χ2=19.601,P=0.001)(表2)。

图3 小鼠角膜擦拭液细胞培养CPE病变图(×200,标尺=200 μm) 空白对照组、模型组和复发组紫外灯照射前小鼠角膜擦拭液细胞呈长梭形,培养基颜色无变化;紫外灯照射后空白对照组小鼠角膜擦拭液细胞呈长梭形,培养基颜色变黄,模型组小鼠角膜擦拭液细胞形态部分皱缩、变形,培养基颜色变黄,复发组小鼠角膜擦拭液细胞形态呈现皱缩、聚拢改变,培养基颜色无变化Figure 3 CPE lesions of Vero cells cultured in corneal wiping fluid from mice of different groups (×200,bar=200 μm) In the blank control group,model group and recurrence group,the Vero cells was in a long spindle shape,and the color of the medium had no change before ultraviolet light irradiation;in the blank control group after ultraviolet light irradiation,the Vero cells was in a long spindle shape,and the culture medium turned yellow;in the model group after ultraviolet light irradiation,the Vero cells was partially shrunk and deformed,and the culture medium turned yellow;in the recurrence group after ultraviolet light irradiation,the Vero cells showed shrunk and gathered,and the color of the medium did not change
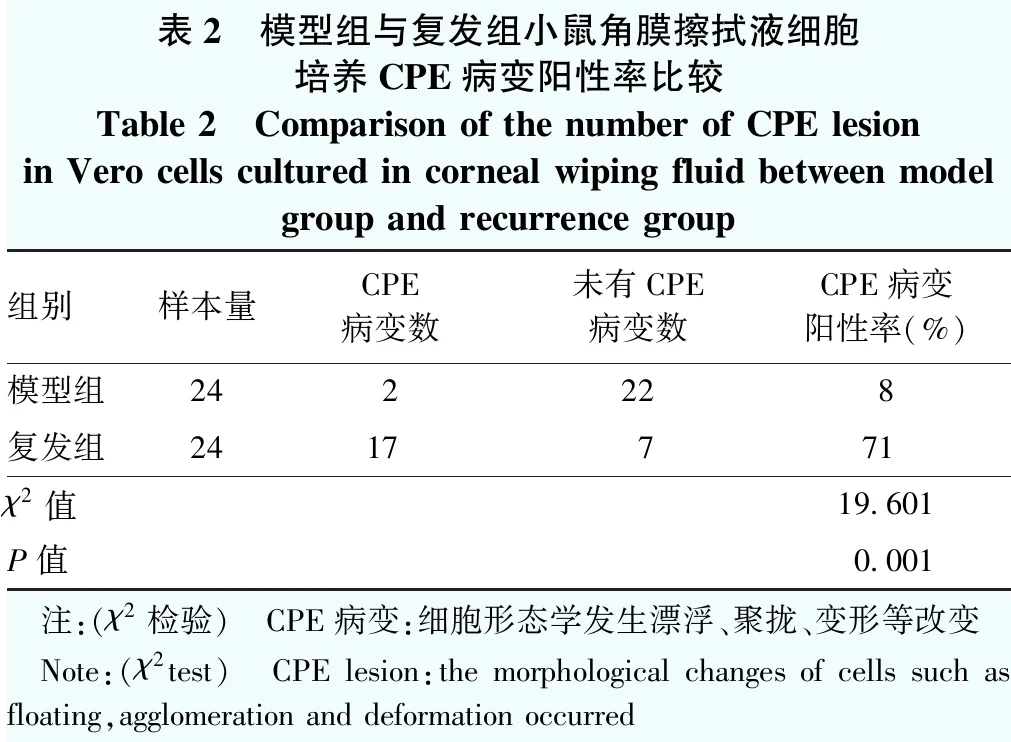
表2 模型组与复发组小鼠角膜擦拭液细胞培养CPE病变阳性率比较Table 2 Comparison of the number of CPE lesion in Vero cells cultured in corneal wiping fluid between model group and recurrence group组别样本量CPE病变数未有CPE病变数CPE病变阳性率(%)模型组242228复发组2417771χ2值19.601P值0.001 注:(χ2检验) CPE病变:细胞形态学发生漂浮、聚拢、变形等改变 Note:(χ2test) CPE lesion:the morphological changes of cells such as floating,agglomeration and deformation occurred
3 讨论
HSV-1在世界范围内流行,据统计约90%的人携带该病毒[6-7]。面对如此庞大的感染人群,建立一个可靠的动物模型对于研究疾病潜伏期/再激活、控制复发的机制和测试治疗性疫苗和药物疗效至关重要。HSK的小鼠复发模型相比其他动物模型更有优势,小鼠复发模型中的临床特征可模拟人类疾病中观察到的许多症状[3]。
以往研究中病毒性角膜炎复发造模时通常会在模型初次感染病毒之后注射人抗HSV血清以中和病毒,减少HSV-1病毒感染后急性眼病引起的小鼠死亡和角膜损伤,保证小鼠的存活[1]。但抗HSV血清获取困难,增加了造模的不便。有研究显示临床上成年人血清抗体阳性率较高,但对疾病诊断和评估意义不大[8];还有研究显示免疫血清的注射可能调节先天性和获得性疱疹免疫[2],我们认为抗体注射改变了病毒感染的自然过程,从而改变再次暴露于病毒抗原(即重新激活的病毒)后对HSV-1的记忆免疫反应。因此,造模过程中避免使用血清抗体能更贴近自然的临床情况。本研究结果显示,未给予腹腔内抗HSV血清注射不会影响小鼠的存活率,且未对模型后续的建立和处理造成影响。HSK的病程始于HSV-1的初次感染,随后是病毒进入感觉神经和自主神经节的潜伏期,复发的基础是病毒的潜伏和复发因素的影响,与是否注入抗HSV血清并无密切关系。
HSK复发的机制为机体免疫力下降,潜伏的病毒在小鼠模型中激活,沿三叉神经逆行至靶组织引起发病[9]。在小鼠体内潜伏感染的HSV-1几乎不会自发激活,紫外灯照射法是HSK复发模型采用的诱导复发手段之一,此法既会导致泪液中病毒的重新激活和部分脱落,又会导致HSK的复发[10]。因为该方法相对安全、有效,并且与人感染情况相近,故常规采用此法。为排除紫外灯照射法对BALB/c小鼠角膜的影响,本研究专门设置了紫外灯照射时间筛选实验,结果显示紫外灯照射在适当的时间下对于角膜的影响仅是短暂的轻度水肿,照射后3 d角膜染色无异常,眼表损伤恢复。在此研究中确定了紫外灯照射时长为2 min 45 s,相较于其他研究的3 min照射时长更短,可避免照射时紫外灯对于眼表损伤的影响。
本研究中初次病毒感染后3 d,复发组小鼠右眼角膜出现混浊,角膜呈现点状染色,标志着复发组小鼠初次病毒感染成功。紫外灯照射后3 d,角膜呈现地图状和树枝状染色改变,右眼分泌物增多,部分小鼠出现双眼同时感染的情况,推测病毒在潜伏时会出现眼位迁移,这也提示我们在临床上应注意疾病的早期预防,防止迁移发病。目前大多学者认为HSV-1感染人体后可在三叉神经元中潜伏,易形成终生潜伏感染状态[11];也有研究认为,角膜亦可能是病毒潜伏的场所和HSK复发的另一个潜在根源[12]。观察感染小鼠角膜擦拭液对细胞生长形态的影响是鉴定小鼠HSK复发的一个依据,在HSV-1的作用下,Vero细胞形态会发生CPE病变,这被认为是确认病毒再活化的依据[1]。在紫外灯照射后,复发组小鼠角膜擦拭液细胞培养出现CPE病变,细胞培养液未变色,显示细胞因病毒感染未过度生长,培养基营养未耗竭;空白对照组小鼠角膜擦拭液细胞培养未出现CPE病变,因细胞过度生长,培养液营养耗竭,颜色变黄。复发组较模型组小鼠细胞培养CPE病变阳性率更高,说明诱导HSK复发建模成功。
此外,并非所有HSV-1潜伏感染的小鼠在紫外灯照射后都会在泪膜中检测到病毒脱落,但这并不意味着它们不能被成功激活[13],可能是病毒数量过低,通过角膜擦拭液的细胞培养无法检测到。复发大多会造成角膜基质层的损伤,导致严重且反复发作的临床表现,包括角膜混浊、新生血管形成等[14]。每天用裂隙灯显微镜检查角膜染色表现,角膜呈现树枝状、地图状等表现结合眼表病变症状评分可帮助评判HSK的复发。随着疾病发展,复发组小鼠眼表病变症状评分逐渐升高,在紫外灯照射后3 d,复发组小鼠眼部表现明显,眼表病变症状评分最高;紫外灯照射后7 d,眼表病变症状评分开始下降;模型组及空白对照组小鼠眼表病变症状评分相对较低。紫外灯照射后,眼表的表现和角膜擦拭液细胞培养CPE病变阳性率2个指标结合可鉴定复发模型的建立是否成功。复发组小鼠中细胞培养CPE病变阳性率为71%,裂隙灯显微镜下观察复发组中75%小鼠有眼部表现,部分小鼠有眼表表现而未观察到细胞的CPE病变,故2个指标综合计算复发建模成功率可达71%。此造模方法的免疫学评价还有待进一步研究。
本研究结果显示紫外灯照射可成功诱导未注射中和血清抗体的HSK小鼠复发,造模成功率高,制作过程简便可控,是研究复发性HSK合适的模型。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明肖书毓:实验操作、论文撰写、数据整理、统计分析;俞莹:实验设计和指导、论文修改、经费支持;陶津华:文献查找
