白芍多糖纯化及其抗运动性疲劳活性研究*
2021-02-26李然
李 然
(西安航空学院 体育部,陕西 西安 710077)
白芍为毛茛科芍药属植物芍药的去皮干燥根,富含多糖、皂苷、蛋白质、β-谷甾醇等化学成分,具有养血调经,敛阴止汗的功效,可用于抗炎、抗病毒、抗惊厥、镇痛与护肝[1,2]。目前,有关白芍的研究,仅限于对其活性成分的提取及药理作用的探讨,如:秦亚东等采用“水提醇沉”工艺制得白芍多糖,并发现其对羟基自由基、DPPH 自由基等活性氧自由基的清除作用较好[3,4]。由于“运动性疲劳”主要归因于机体剧烈运动产生的大量活性氧自由基,破坏体内抗氧化与氧化系统的平衡,造成组织损伤和肌肉收缩能力的下降[5,6],而对机体补充外源性抗氧化剂是延缓运动性疲劳产生的有效方法之一。近年来,部分体外抗氧化活性较好物质,被发现其对体内抗疲劳亦有较好作用[7,8]。由于白芍多糖提取物中仍有较多蛋白、色素等杂质,可能影响其活性作用。为此,本研究利用大孔树脂纯化白芍多糖提取物,探讨不同工艺条件对提取物纯化效果的影响,同时通过动物实验,观察其抗运动性疲劳活性。
1 实验部分
1.1 材料与试剂
白芍(老百姓大药房,经鉴定为毛茛科芍药属植物芍药的根);D-无水葡萄糖标准品(中国食品药品检定研究院);甲醇、无水乙醇、浓H2SO4、苯酚为分析纯,国药集团化学试剂有限公司;乳酸(LD)、尿素氮(BUN)试剂盒为江苏科特生物科技有限公司生产;实验用水为超纯水;实验动物:SPF 级健康雄性小鼠 100 只,体质量 15~22g。
AB-8、H 103、D 101 型大孔树脂(天津欧瑞生物科技有限公司);HPD 400 型大孔树脂(天津浩聚科技有限公司);HPD 600 型大孔树脂(北京索莱宝科技有限公司)。
1.2 仪器与设备
XL-06A 粉碎机(上海烨昌食品机械有限公司);752N 型紫外-可见分光光度计(上海仪电科技有限公司);FA124 型电子天平(上海恒平科学仪器有限公司);RE-52AA 型旋转蒸发仪(上海亚荣生化仪器厂);TG16G 型台式高速离心机(常州亿能实验仪器有限公司);110X50 型水浴恒温振荡器(济南来宝医疗器械有限公司)。
1.3 多糖提取物制备
白芍的干燥根经粉碎后,称取适量,经无水乙醇浸泡过夜后,在1∶10 固液比下,于80℃热水浸提2 次,合并提取溶剂,水浴浓缩至原体积三分之一后,在1∶3 固液比下,加入无水乙醇,4℃静置12h 后离心,收集沉淀,真空干燥,即得白芍多糖粗提物[4]。
1.4 多糖含量测定
精密称取干燥至恒重的葡萄糖标准品,加入5%苯酚溶液和浓H2SO4处理后,于490nm 测定不同浓度的标准品溶液的吸光度[9],绘制标准曲线,得到标准曲线回归方程:y=2.391x+0.011(r=0.9994),表明葡萄糖在0.02~0.2mg·mL-1浓度范围内,线性关系良好,另于相同波长,测定实际样品的吸光度,平行测定3 次,计算样品中多糖纯度。
1.5 树脂静态吸附-解吸性能比较
经预处理后的5.0g 不同型号树脂置于锥形瓶内,分别加入50mL 3mg·mL-1多糖提取液,于室温振荡至饱和吸附后过滤,测得饱和吸附后溶液中多糖浓度。随后,将饱和吸附的大孔树脂采用纯水冲洗至无色后,置于锥形瓶内,另加入100mL,体积分数为70%的乙醇溶液,于相同条件振荡解吸至平衡,测得乙醇溶液中多糖浓度,计算不同类型大孔树脂的吸附率、解吸率及回收率[10]。
1.6 树脂动态吸附-解吸条件考察
1.6.1 吸附条件考察 固定样品溶液体积50mL,以吸附率为衡量指标,分别考察样品浓度、上样液pH值及上样流速对D101 树脂吸附白芍多糖的影响,具体如下:当上样液pH 值为5,上样流速为2mL·min-1,样品浓度分别为:1、2、3、4、5mg·mL-1;当样品浓度为3mg·mL-1,上样流速为 2mL·min-1,上样液 pH 值分别为:3、4、5、6、7;当样品浓度为 3mg·mL-1,上样液pH 值为 5,上样流速分别为 1、2、3、4、5mL·min-1。
1.6.2 解吸条件考察 以不同浓度乙醇作洗脱液,解吸率为衡量指标,分别考察洗脱液浓度、体积和洗脱流速对解吸率的影响,具体如下:当洗脱流速为1mL·min-1,洗脱液体积为 120mL 时,洗脱液浓度分别为:50%、60%、70%、80%、90%;当洗脱液浓度为70%,洗脱液体积为120mL 时,洗脱流速分别为0.5、1、2、3、4mL·min-1;当洗脱液浓度为 70%,洗脱流速为1mL·min-1时,洗脱液体积分别为100、110、120、130、140mL。
1.7 抗疲劳活性研究
1.7.1 动物分组与剂量设计 80 只健康雄性小鼠适应性喂养7d 后(饲养环境温度:20~25℃,相对湿度:50~70%),按体质量随机分为4 组,即空白对照组和纯化产物的低、中、高剂量组,每组各20 只,根据《保健食品功能评价》要求,设计人体推荐摄入剂量的 10、20、30 倍,作为低、中、高剂量组动物每日纯化产物的摄入量,即 0.10、0.20、0.30mg·(g·d)-1,空白对照组则给予等量生理盐水,全部动物每天灌胃1 次,连续灌胃30d,灌胃期间各组小鼠可自由喂食与饮水[11]。
1.7.2 力竭游泳时间 末次灌胃结束后,各组随机选取10 只小鼠,于鼠尾负重5%体重重物,置于游泳池内,温度为(25±2)℃,记录其自入水游泳至沉没超过 10s 的时间[12]。
1.7.3 生化指标检测 末次灌胃结束后,各组剩余动物游泳30min,取出擦净,休息15min 后,摘眼球取血后离心,制备血清,照相关试剂盒使用说明,检测各组小鼠血清中LD 和BUN 的含量[13]。
1.8 数据处理
实验数据采用均数、标准差描述,利用SPSS 19.0 进行单因素方差分析,不同组间的比较采用方差分析,检验水准α=0.05,当P<0.05 判断为差异显著,P<0.01 判断为差异极显著。
2 结果与分析
2.1 树脂静态吸附-解吸性能比较
大孔树脂的吸附与解吸性能与树脂的极性、比表面积有关,不同类型树脂的静态吸附与解吸性能,见表1。

表1 不同树脂的静态吸附与解吸性能Tab.1 Static adsorption and desorption performance of different resins
从表1 可见,各类树脂对白芍多糖的吸附与解吸效果呈明显差别,其中D 101 树脂对提取液中多糖的回收率达到79.1%,其次为H 103,这归因于多糖化学结构中存在较多羟基,具有一定的极性,但H 103 树脂的比表面积≥900m2·g-1,吸附作用最强,而 D 101 树脂的比表面积为 500~600m2·g-1,易于脱附,因而确定采用D 101 树脂作为纯化白芍多糖提取物的大孔树脂。
2.2 树脂吸附条件优化
2.2.1 样品浓度选择 不同样品浓度对树脂的吸附率影响,见图1。

图1 样品浓度的选择Fig.1 Selection of concentration of sample solution
由图1 可见,随着样品浓度的增大,吸附率先升高后降低,这归因于提取物浓度过大,使得样品中杂质增多,竞争吸附于树脂内,导致待分离物的过早泄漏,因此,确定样品中提取物浓度为3mg·mL-1。
2.2.2 上样流速选择 不同上样流速对树脂的吸附率影响,见图2。
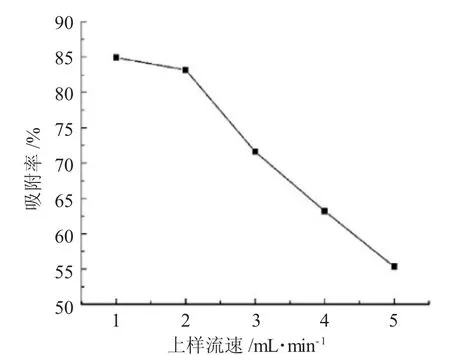
图2 上样流速的选择Fig.2 Selection of loading flow rate of sample solution
由图2 可见,随着上样流速的增大,吸附率逐渐下降,这源于流速过快,样品溶液未与树脂充分接触,致使吸附量降低,但流速过慢,可能影响吸附效率。为此,综合考虑选择上样流速为2mL·min-1。
2.2.3 上样液pH 值选择 不同上样液pH 值对树脂的吸附率影响,见图3。
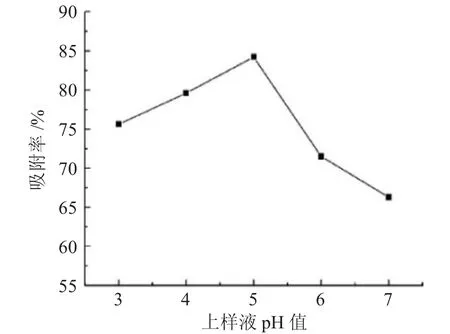
图3 上样液pH 值的选择Fig.3 Selection of sample solution pH
由图3 可见,伴随上样液pH 值的增大,吸附率先升高后降低,这可能源于多糖在酸、碱条件下均易发生水解反应,影响其溶解度与化学性质[14],而在弱酸性条件下,多糖更易于被树脂吸附,因此确定上样液pH 值为5。
2.3 树脂解吸条件优化
2.3.1 洗脱液浓度选择 图4 为不同洗脱液浓度对多糖解吸率的影响。
由图4 可见,当乙醇溶液体积分数增大至70%时,解吸率开始降低,若乙醇浓度过高,易将吸附在树脂的蛋白质等杂质洗脱,而乙醇浓度过低,则与多糖的极性相差较大,因此,选择洗脱液乙醇的浓度为70%。
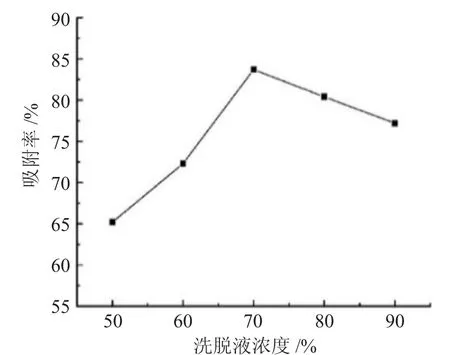
图4 洗脱液浓度的选择Fig.4 Selection of eluent concentration
2.3.2 洗脱流速选择 图5 为不同洗脱流速对多糖解吸率的影响。

图5 洗脱流速的选择Fig.5 Selection of different flow rate of elution
由图5 可见,随着洗脱液洗脱流速的增大,多糖的解吸率不断降低,这归因于洗脱流速过快,同样会使洗脱剂与树脂接触不充分,导致其解吸多糖效果较差,综合解吸效率,选择洗脱流速为1mL·min-1。
2.3.3 洗脱液体积选择 洗脱液体积对多糖解吸率的影响,见图6。

图6 洗脱液体积的选择Fig.6 Selection of eluent volume
由图6 可见,随着洗脱液体积增大至120mL时,解吸率逐渐上升至趋于平衡,表明吸附在树脂的多糖基本被解吸完全,因此选择洗脱液体积为120mL。
2.4 验证实验
采取上述最佳条件纯化白芍提取物中多糖,即配制浓度为 3mg·mL-1,pH 值为 5 的样品溶液 50mL,以2mL·min-1流速上样至D 101 树脂中吸附后,采用体积分数为70%的乙醇溶液120mL,以1mL·min-1流速洗脱,产物的多糖含量由纯化前85.57 提高至纯化后 224.2mg·g-1,约为 2.6 倍。
2.5 纯化产物对动物力竭游泳时间影响
动物力竭游泳实验可客观反映白芍多糖的抗运动性疲劳效果,见表2。

表2 白芍多糖对力竭游泳时间的影响Tab.2 Effect of polysaccharide of Radix Paeoniae Alba on exhaustive swimming time
由表2 可知,与空白对照组相比,中、高剂量的纯化产物均可显著延长动物的力竭游泳时间,中剂量组与其差异显著(P<0.05),而高剂量组与其差异极显著(P<0.01),表明中、高剂量的白芍多糖纯化产物有助于提高机体的运动耐力,延长运动时间。
2.6 纯化产物对动物体内乳酸浓度影响
高强度运动时体内供氧不足,部分血糖易转化成乳酸,使得四肢肌肉酸痛,出现疲劳感,因此,分别考察运动后不同组别动物体内的LD 浓度,结果见表3。
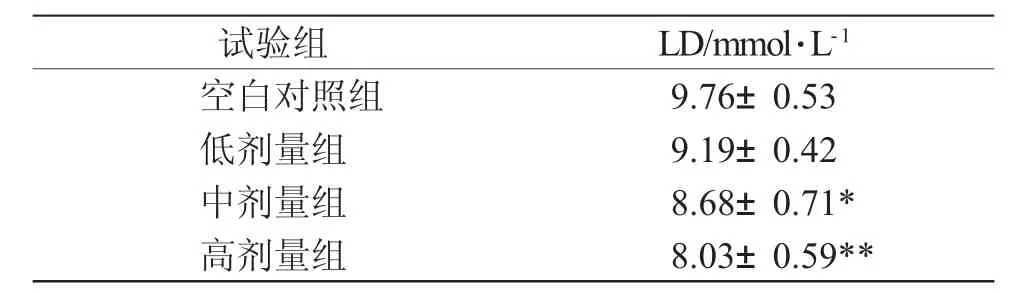
表3 白芍多糖对LD 浓度的影响Tab.3 Effect of polysaccharide of Radix Paeoniae Alba on LD concentration
由表3 可知,与空白对照组相比,中、高剂量组动物的体内LD 浓度均明显低于空白对照组(P<0.05, P<0.01),表明中、高剂量的纯化产物可明显减少体内乳酸的累积,延缓运动疲劳产生。
2.7 纯化产物对动物体内尿素氮浓度影响
当机体剧烈运动时,血糖供应不足,体内蛋白质和氨基酸分解代谢加快,以维持运动,致使代谢产物尿素氮浓度增大[25],运动后不同组别动物体内的尿素氮浓度,见表4。
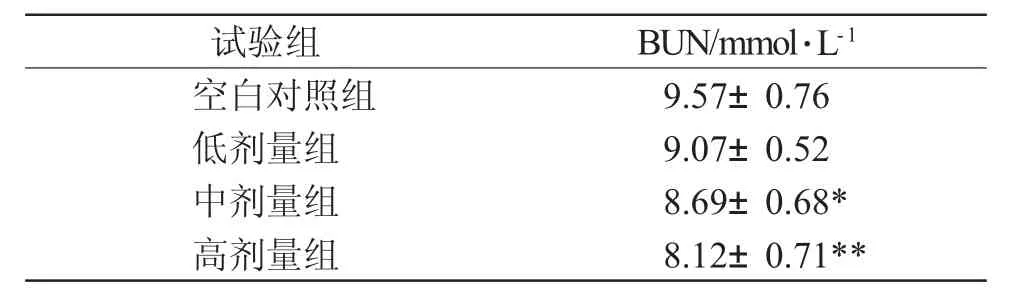
表4 白芍多糖对BUN 浓度的影响Tab.4 Effect of polysaccharide of Radix Paeoniae Alba on BUN concentration
由表4 可知,与空白对照组相比,中、高剂量组动物体内的BUN 浓度均明显低于空白对照组(P<0.05, P<0.01),表明中、高剂量的白芍多糖可显著减少运动时体内蛋白质的分解利用。
3 结论
本研究探讨了大孔树脂纯化白芍多糖的最佳工艺条件并考察其抗运动性疲劳活性。实验结果表明,配制浓度为 3mg·mL-1,pH 值为 5 的样品溶液 50mL,以2mL·min-1流速上样至D 101 树脂中吸附后,采用体积分数为70%的乙醇溶液120mL,以1mL·min-1 流速洗脱,产物的多糖含量由纯化前85.57 提高至纯化后224.2mg·g-1,约为2.6 倍。中、高剂量的白芍多糖纯化产物有助于避免运动时体内的乳酸累积,降低蛋白质的分解利用,因此,可为相关运动食品的开发提供参考。