双金属离子水热催化转化葡萄糖制备乳酸
2021-02-26李航伟罗小飞郭晓亚孔令照
李航伟,杨 翔,罗小飞,郭晓亚,孔令照
(1. 上海大学环境与化学工程学院,上海 200444;2. 上海高等研究院低碳转化科学与工程重点实验室,上海 201210)
乳酸(lactic acid,LA)是一种重要的有机化合物,大量用于食品、化妆品、药品和化学品等领域[1]. 乳酸可用于制备可生物降解的高分子材料聚乳酸,或者作为制备丙烯醇、丙烯酸、丙酮酸等精细化学品的中间体[2]. 工业上一般将淀粉或者葡萄糖发酵以制取乳酸,存在产率较低、原料成本较高、发酵时间较长的缺点[3].
随着制备工艺的优化和催化体系的开发,水热转化逐渐显现出化学催化转化的优势. 多种制备乳酸的催化体系已被开发,包括均相催化剂、非均相催化剂以及离子液体等. 而能直接转化己糖生产乳酸的催化剂应该是碱性的或者具有明显的路易斯酸性[4]. 非均相催化剂有Nb@MgF2和Nb@CaF2[5],Yb(OTf)2-SO3-SBA-15[6],Pt/C[7],Zn-N-活性炭[8],ZrO2-Al2O3[9],活化水滑石[10],长石[11],Nb2O5[12],Sn-β[13],ZnO-SiO2[14]与ZrO2[15]等. 均相催化剂有Ni2++NaOH[16],Pb2+[17],NaOH/Ca(OH)2[18],Ba(OH)2[19]等. 离子液体有SnCl2/ChCl[20]等. 非均相催化剂的主要问题是重复实验会导致催化剂结构破坏,引起产率降低; 而均相催化剂,比如Pb2+对乳酸的选择性较好,但是作为一种有毒的重金属会使人致癌[17]. 在超临界和近临界条件下使用碱可以断裂葡萄糖中的C—C 键生成乳酸盐,但选择性较低[18].
Sn2+作为一种路易斯酸性金属离子,可以将葡萄糖等碳水化合物转化为乳酸及其酯类,而且Sn2+在醇中表现出了较高的催化活性和选择性[20]. Hayashi等[21]以甲醇为溶剂,用SnCl2和SnCl4在温和温度下将三聚糖转化为乳酸甲酯(90°C,80~90%,3 h). Holm等[13]在甲醇中以Sn-β 沸石为固体催化剂转化果糖,可以得到68%的乳酸甲酯,但在水相条件下,Sn2+对乳酸及其酯类的合成活性和选择性较低. Rasrendra等[22]在水中用Sn2+转化丙糖,乳酸的选择性只有22%,远低于Al3+,Cr2+和Cr3+(80%~95%). Wang等[17]在190°C,4 h 和3 MPa 的氮气下,用Sn2+转化纤维素,也只得到了15%的乳酸产率. 因此,研究Sn2+在水相条件下的应用,并在碱性条件下提高Sn2+的催化活性和选择性十分有意义.
本工作采用Sn2+与其他金属离子复配作为催化剂,在碱性条件下水热转化葡萄糖等碳水化合物,制备了高产率的乳酸,并研究了相应的协同作用机制和反应路径.
1 实验部分
1.1 主要试剂与仪器
实验药品有葡萄糖、果糖、丙烯酸、1,3-二羟基丙酮、乙醛酸、羟乙醛、乙二醛、丙酮醛、乳酸、甲酸(formic acid,FA)、乙酸(acetic acid,AA)、硫酸、氯化锌、氯化锰、硫酸钴、氯化铝、氯化锡、硫酸铜和氢氧化钠,均为分析纯(上海泰坦科技有限公司).
实验仪器有电子天平(AL204,梅特勒-托利多仪器上海有限公司)、电热恒温鼓风干燥箱(DHG-9036A,上海精宏实验设备有限公司)、磁力搅拌器(84-1A,上海梅颖浦仪器仪表制造有限公司)、循环水真空泵(SHZ-Ⅲ,巩义市予华仪器有限责任公司)、高效液相色谱(high performance liquid chromatography,HPLC)仪(Agilent 1100,USA,安捷伦科技有限公司)、X 射线衍射(X-ray diffraction,XRD)仪(XD6/7 系列衍射仪,北京普析通用仪器有限责任公司). 反应容器为50 mL 带有聚四氟乙烯内衬的水热反应釜.
1.2 实验步骤
水热反应在50 mL 带有聚四氟乙烯内衬的水热反应釜中进行. 将葡萄糖、去离子水、NaOH 和金属离子盐加入反应釜后,在磁力搅拌器上搅拌3 min,随后密封,放入已达设定温度的烘箱中进行水热转化. 反应结束后,将水热反应釜立刻放入冰水浴中淬灭反应. 冷却之后,将过滤得到的滤液用1 mol/L 的硫酸滴定至酸性后进行HPLC 分析,滤渣进行XRD 分析.
1.3 分析方法
液体样品使用配备有UVD(G1315B,Agilent,USA)和ZORBAX SB-C18 柱(4.6 mm×250 mm 5-Micron,Agilent,USA)的HPLC 分析. 柱温箱的温度为40°C,流动相为w(1%磷酸)∶w(甲醇)=95∶5,流速为1 mL/min. 有机酸产率定义为产物中的碳质量(碳摩尔数)与加入的原料中的碳质量(碳摩尔数)的百分比.
实验产生的固体残渣主要是一些碱金属氢氧化物或者金属单质,在XRD 仪上进行扫描分析,X 射线管为Cu 靶,管电压为40 kV,管电流为30 mA,扫描范围为5°~85°,采样步宽为0.01°,扫描速率为4(°)/min.
2 结果与讨论
2.1 金属催化剂的筛选
为了筛选出合适的金属催化剂,首先研究了较为廉价和毒性较小的单金属阳离子盐. 在葡萄糖用量为0.025 g、水用量为20 mL、NaOH 用量为0.04 g、反应温度为200°C 的条件下反应3 h. 选取的催化剂包括Sn2+,Zn2+,Al3+,Mn2+,Co2+和Cu2+. 在单独金属离子体系中,金属离子用量均为1 mmol; 在双金属离子体系中,两种金属离子的用量分别为0.5 mmol.由图1 所示的实验结果可以发现: 在碱性条件下,没有金属离子参与的反应得到了8.1%的乳酸产率,10.7%的甲酸产率和9.3%的乙酸产率,表明葡萄糖在碱性条件下能降解转化得到乳酸,但是产率相对较低; 在单独金属离子催化体系下,Sn2+催化转化葡萄糖得到的乳酸产率为38%,乙酸产率为14.5%,相比其他水相条件[17,22]产率更高,表明反应在碱性溶液中进行,乳酸的选择性增加; Cu2+得到了最高的乳酸产率,为42.2%,甲酸产率为12.5%,乙酸产率为9.7%.

图1 金属阳离子种类对乳酸、甲酸和乙酸产率的影响Fig.1 Effects of metal cation species on the yields of lactic acid,formic acid and acetic acid
为了研究Sn2+与其他金属离子能否通过协同效应提高乳酸产率,后续进行了双金属离子体系水热转化葡糖糖的实验. 将摩尔比为1∶1 的Sn2+和其他金属离子组合,在200°C 下反应3 h,转化葡萄糖制备乳酸. 从图1 可以看出,Sn2+和Cu2+双金属离子体系催化转化葡萄糖的实验得到了最高的乳酸产率,为54.3%,甲酸产率为14.2%,乙酸产率为27.9%. 相比单独使用Sn2+和Cu2+,乳酸产率有了明显的提升,说明Sn2+和Cu2+两种金属离子转化葡萄糖可能具有协同催化作用.
2.2 条件优化
2.2.1 反应时间对羧酸产率的影响
反应时间是影响羧酸产率的重要因素[23]. 为了研究反应时间对乳酸产率的影响,在200°C 反应温度、0.025 g 葡萄糖用量、20 mL 水、0.04 g NaOH、Sn2+和Cu2+的摩尔数分别为0.5 mmol 的条件下,反应时间分别设定为1,2,3,4 和5 h 进行实验,测定产物中主产物乳酸、副产物甲酸和乙酸的产率,结果如图2 所示. 可以看出: 当反应时间从1 h 延长到3 h 时,乳酸产率从52.5%升高到55.7%,甲酸产率从10.2%升高到14.6%,而乙酸产率的提高最为显著,从18.7%升高到28.6%. 进一步延长反应时间到5 h,乳酸产率明显下降,为45%,甲酸产率降为11.4%,乙酸产率降为13.8%. 这说明过长的反应时间会造成产物发生部分分解,从而导致产率下降.
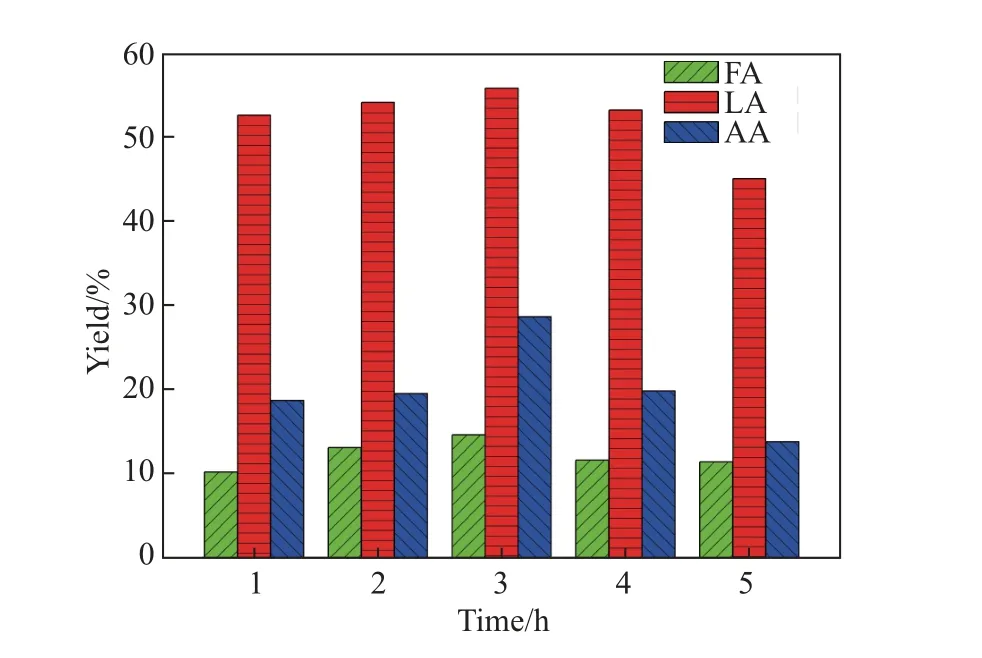
图2 不同反应时间对乳酸、甲酸和乙酸产率的影响Fig.2 Effects of different reaction time on the yields of lactic acid,formic acid and acetic acid
2.2.2 温度对羧酸产率的影响
与反应时间一样,温度也是影响催化体系活性的重要因素之一. 为了研究温度对乳酸产率的影响,在20 mL 水、0.04 g NaOH、Sn2+和Cu2+的摩尔数分别为0.5 mmol 的条件下转化0.025 g 葡萄糖,反应时间为3 h,温度分别设定为160,180,200,220 和240°C,实验结果如图3 所示. 可以看出: 随着温度的升高,乳酸、甲酸和乙酸的产率提高明显. 当温度从160°C 升高到200°C,乳酸产率从47.1%升高到55.7%,乙酸产率从8.9%升高到28.6%,甲酸从产率4.7%升高到14.6%; 随着的温度进一步升高,乳酸、甲酸和乙酸的产率并没有继续增加. 这可能是由于温度太高,葡萄糖发生了碳化,反而降低了产物的产率.

图3 不同温度对乳酸、甲酸和乙酸产率的影响Fig.3 Effects of different temperatures on the yields of lactic acid,formic acid and acetic acid
2.2.3 NaOH 用量对羧酸产率的影响
为了研究碱的加入量对葡萄糖转化的影响,在0.025 g 葡萄糖、20 mL 水、分别加入0.5 mmol Sn2+和Cu2+催化剂、反应时间为3 h、反应温度为200°C 的条件下,NaOH 的加入量从0 增加至2.5 mmol,考察了NaOH 用量对于乳酸产率的影响,结果如图4 所示. 可以看出:当不加入NaOH 时,产物产率非常低,乳酸产率只有4.3%,甲酸产率只有11.7%;随着NaOH 加入量增加,乳酸产率大幅提升,表明碱性环境有利于乳酸的形成,并且碱的存在还可以防止有机化合物被氧化[23]; 当NaOH 的加入量为2.0 mmol 时,乳酸产率达到最高值,为62.4%,甲酸产率为13.8%,乙酸产率为11.1%; 当NaOH 的加入量为2.5 mmol 时,乳酸产率降为56.6%,同时甲酸产率为14%,乙酸产率为7.1%. 这表明NaOH 的过载会削弱Sn2+和Cu2+的催化作用,降低产物的产率.
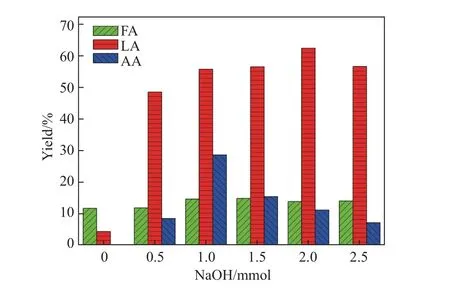
图4 NaOH 用量对乳酸、甲酸和乙酸产率的影响Fig.4 Effects of the amount of NaOH on the yields of lactic acid,formic acid and acetic acid
2.2.4 催化剂中金属离子复配比例对羧酸产率的影响
为了研究Sn2+和Cu2+的比例对葡萄糖转化为羧酸产率的影响,在0.025 g 葡萄糖、2 mmol NaOH、20 mL 水的体系中分别加入n(Sn2+)∶n(Cu2+)为1∶0,0.75∶0.25,0.5∶0.5,0.25∶0.75 和0∶1 的催化剂,双金属离子的总摩尔数为1 mmol,200°C 下反应3 h 后的结果如图5 所示. 可以发现: 当单独加入Sn2+和单独加入Cu2+时,乳酸产率分别为46.9%和43.2%,甲酸产率为10.2%和13.2%,乙酸产率为15.6%和10.1%,这说明单一催化剂的催化效果不如两种催化剂复配的催化效果好,Sn2+和Cu2+催化葡萄糖转化具有明显的协同作用; 随着Cu2+比例的增加,乳酸产率明显增加,当n(Sn2+)∶n(Cu2+)=0.25∶0.75 时,乳酸产率达到最大,为64.1%,甲酸产率为20.3%,乙酸产率为11%. 因此可以推测,Cu2+可能在促进葡萄糖转化为乳酸或者抑制乳酸分解过程中有重要的作用.

图5 金属离子复配比例对乳酸、甲酸和乙酸产率的影响Fig.5 Effects of metal ion compounding ratio on yields of lactic acid,formic acid and acetic acid
2.3 固体残渣的XRD 分析
果糖为葡萄糖的同分异构体,并且是葡萄糖转化过程中的一个重要中间体. 为了研究催化剂在反应过程中的变化情况,采用葡萄糖和果糖为反应原料进行转化反应,反应残渣的组成采用XRD 来进行分析,结果如图6 所示. 可以发现,两种原料的反应残渣中都出现了对应于Cu 的衍射峰(2θ= 43.3°,50.4°和74.1°). 这表明Cu2+在催化氧化后被还原为Cu 单质. 这可能是因为Cu2+与葡萄糖会形成络合物,电子会从氧原子转移到较近的Cu2+[24],导致Cu2+被还原为Cu 单质.

图6 不同原料反应残渣的XRD 图Fig.6 XRD pattern of different raw material reaction residues
通过对Sn 元素的不同物相进行检索比对,Sn 单质的衍射峰比较小,并且其他Sn 的氧化物无法对应,所以暂时无法确定Sn 元素反应结束后的最终物相.
2.4 反应机理的推断
为了推断可能的反应机理,采用不同的模型化合物来进行实验,通过产物分布来确定葡萄糖转化过程中的中间产物. 固定的反应条件如下: 反应温度200°C,原料用量0.025 g,水用量20 mL,反应时间3 h,催化剂用量1 mmol,NaOH 用量2 mmol. 反应结果如表1 所示. 由于果糖会最先通过葡萄糖的异构化形成[19],所以首先采用果糖作为原料进行实验,最终得到了66.8%的乳酸产率,19.5%的甲酸产率和13%的乙酸产率. 3 种产物的产率与葡萄糖作为原料时的结果相近.

表1 不同模型化合物水热转化反应的产物分布Table 1 Product distributions for conversion of different model compounds
在葡萄糖的降解过程中会生成多种C2,C3 化合物中间体,所以本实验以多种可能的C2,C3 化合物作为原料进行反应,包括丙烯酸、1,3-二羟基丙酮、乙醛酸、羟乙醛、乙二醛、丙酮醛和乳酸. 通过对比这几种化合物反应生成的产物产率,发现以丙烯酸、羟乙醛、乙醛酸和乙二醛为原料的反应产物产率非常低,所以认为这4 种物质可能不是反应的中间产物. 以1,3-二羟基丙酮和丙酮醛为原料的反应得到了较高的乳酸产率. 1,3二羟基丙酮与甘油醛为同分异构体[25],而丙酮醛则为二者的脱水产物. 当采用乳酸作为原料进行反应后发现,产物中出现了少量的甲酸和乙酸,说明乳酸在反应条件下会发生一定的分解,生成甲酸和乙酸.
综上,推断可能的转化路径如下: 葡萄糖在碱性条件下部分异构化为果糖,果糖、葡萄糖会发生逆羟醛缩合形成同分异构体——甘油醛和1,3-二羟基丙酮,二者进一步脱水形成丙酮醛,丙酮醛通过二苯乙醇酸重排形成乳酸[23]. 乙酸和甲酸部分来自于乳酸的分解,部分来自于葡萄糖的其他途径的降解(见图7).
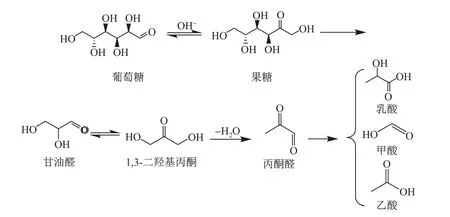
图7 葡萄糖在Sn2++Cu2+催化下的转化路径Fig.7 Transformation pathway of glucose under Sn2++Cu2+
当采用Cu2+转化模型化合物时,发现果糖和1,3-二羟基丙酮反应生成的乳酸产率略有下降,乳酸的分解大大减少而丙酮醛的转化效率很低,说明Cu2+能抑制乳酸的分解,但对于丙酮醛的转化没有什么催化作用. 而在双金属离子体系中,丙酮醛转化为乳酸的效率大大提高,说明在催化丙酮醛转化为乳酸的步骤上,Sn2+可能更为高效. 双金属离子体系可以提高乳酸产率的原因可能在于: 两种离子在协同作用下,Cu2+抑制了乳酸的分解,Sn2+提高了中间步骤丙酮醛转化为乳酸的转化效率,从而在总体上提高了乳酸的产率.
3 结 论
(1) 在碱性条件下,几种不同的双金属阳离子协同催化葡萄糖的结果表明,Sn2++Cu2+具有更好的协同催化效果.优化工艺得到最高乳酸产率的实验条件如下: 在0.025 g 葡萄糖原料、2 mmol NaOH 和20 mL 水的体系中,加入n(Sn2+)∶n(Cu2+)=0.25∶0.75(1 mmol)双金属离子催化剂. 200°C 反应3 h 后,得到的最高乳酸产率为64.1%,副产物甲酸产率为20.3%,乙酸产率为11%.
(2) 对残渣的XRD 分析结果发现,Cu2+反应结束部分被转化为Cu 单质,可能是在反应过程中Cu2+与葡萄糖形成了络合物,电子从氧原子转移到较近的Cu2+,导致Cu2+被还原为Cu 单质.
(3) 采用几种可能的反应中间体为原料进行实验,推断了可能的反应机理. 结果表明,果糖、1,3-二羟基丙酮和丙酮醛是葡萄糖碱性条件下降解转化的重要中间产物.在Sn2+和Cu2+两种离子的协同作用下,乳酸产率得到了很大程度的提高. 这是因为Cu2+的存在抑制了乳酸的分解,而Sn2+提高了丙酮醛转化至乳酸的转化效率,从而提高了乳酸的产率.
