miR-223在尿毒症肠组织的表达及对紧密连接蛋白表达的影响*
2021-02-26何荃陈蕾魏萌魏丽敏薛瑾虹渠宁刘华
何荃 陈蕾 魏萌 魏丽敏 薛瑾虹 渠宁 刘华
(西安交通大学第一附属医院血液净化科,陕西 西安 710061)
尿毒症状态下存在显著的肠道屏障功能障碍(Intestinal barrier dysfunction,IBD),已逐渐成为国内外肾脏病学领域的共识[1]。越来越多的证据显示,IBD 引起的肠道通透性增加,会促进肠源性尿毒症毒素入血、肠道菌群移位、加剧系统性炎症反应,从而诱发或加重尿毒症患者动脉粥样硬化、营养不良、贫血等多种并发症,严重威胁此类患者的生存质量及生命[2-3]。然而,尿毒症状态下 IBD 发病机制尚不清楚,更缺乏靶向其分子机制的干预手段。因此,深入探索尿毒症状态下IBD的机制,寻找行之有效的干预手段,是肾脏病学者迫在眉睫的任务。MicroRNA(miRNAs)为18-25nt的小分子RNA,可与目标mRNA的3’-UTR区域互补配对,导致翻译的抑制或mRNA降解。研究显示,miRNAs可通过上述机制参与众多生理疾病过程的调控,包括肠道相关的肠粘膜炎症反应、免疫耐受、先天免疫、肿瘤形成及肠上皮增殖、分化、凋亡等[4-8],亦被证实与IBD相关。miR-223 是哺乳动物常见的miRNA之一, 存在于多种细胞、组织中,参与炎症反应等过程[9]。既往研究显示,miR-223在CKD血清中表达下调[10],但其在尿毒症肠组织中的表达情况及其对肠屏障功能的作用尚不清楚。因此,本研究拟通过检测尿毒症大鼠肠道中miR-223表达量并在体外细胞实验中探索miR-223对肠上皮细胞紧密连接蛋白的调控作用,探讨miR-223在尿毒症肠屏障功能障碍中的可能作用及其相关机制,为治疗尿毒症相关IBD提供潜在靶点。本文通过尿毒症大鼠及细胞体外实验分析miR-223在尿毒症肠上皮表达情况及其对紧密连接蛋白的调控作用,探讨IBD机制和治疗新靶点。
1 材料与方法
1.1 实验动物与分组 SPF级成年健康雄性SD大鼠35只,体重180~230g,购自西安交通大学医学院实验动物中心。本实验经西安交通大学医学院第一附属医院伦理委员会批准。大鼠在标准环境中饲养,室温25~26℃,普通固态饲料、自来水喂养,自由摄食和饮水。随机分为尿毒症组20只和假手术组10只。
1.2 尿毒症动物模型建立、分组及干预 本实验采用5/6肾切除建立模型。一期手术切除左肾上下极各1/3,创面止血。一期手术后7~10天行二期手术,摘除右肾。假手术组,手术时仅打开肾包膜,暴露肾脏约5min后,逐层缝合切口部位。分为尿毒症组10只,尿毒症+益生菌组10只,同时设立假手术组10只为对照组。益生菌动物双气杆菌乳亚种(Bifidobacterium animalis subsp.Lactis Bi-07)保存于中国西北大学生命学院微生物实验室。冻干粉接种至改良TPY培养基复苏后,取少量菌液再次接种至TPY培养基37℃培养16h,3000r/min离心10min后弃去上清液,PBS缓冲液稀释细菌,麦氏比浊法将菌液1mL迅速灌胃尿毒症+益生菌组大鼠。灌胃后给与正常饮水、饮食,每日灌胃,共持续4周,其余两组大鼠均正常饮水饮食。
1.3 生化指标的检测及肾脏组织病理学观察 二期手术后第12周末处死大鼠,下腔静脉抽取血标本5mL。留取血清检测三组大鼠血清肌酐、尿素氮、血常规水平,委托西安交通大学第一附属医院检验科完成。取残存肾组织,磷酸盐缓冲液漂洗3次,置于4%多聚甲醛固定液中固定,常规脱水、透明、石蜡包埋、切片,做HE染色,光镜观察各组组织形态学改变。
1.4 Caco2细胞的培养和分组 对数生长期生长良好的Caco2细胞接种于6孔细胞培养板,每孔2×105个细胞,于5% CO2培养箱中37℃培养过夜。转染前2h,更换无血清MEM培养基。合成的miR-223模拟物或miR-223抑制剂用LipofectamineTM2000(上海恒飞生物科技有限公司,上海,中国)包装。分4组:miR-223-mimics-NC组、miR-223-mimics组、miR-223-inhibitor-NC和miR-223-inhibitor组。RT-qPCR方法检测各组ZO-1、Occludin、claudin-1 mRNA表达。根据制造商的操作规程,使用不同的转染溶液,将细胞置于37℃的CO2培养箱中培养,6h后将混合溶液吸收并交换到正常培养基中。
1.5 实时荧光定量PCR(RT-qPCR)检测肠组织miR-223、occludin、claudin-1和ZO-1的表达 称取冻存回肠组织100mg,以Trizol法匀浆提取总RNA,测定其浓度与含量。取5μLRNA,逆转录成cDNA,从GenBank中检索出大鼠miR-223、Occludin、claudin-1、ZO-1所对应的cDNA序列。Primer5.0软件设计出目的基因片段的引物序列。所有引物均有宝生物工程有限公司合成。miR-223引物:5′-GTCGTATC CAGTGCAGGGTCCGAGGTATTCGCACTGGATA CGACGGGGTATT-3′,5′-TGCGCTGTCAGTTTGT CAAAT-3′;occludin引物:5′-GACATGCCTCCACC CCCATCTGACT-3′,5′-TCTTCGCCTTCCCTGCTT TCCCCTT-3′;claudin-1引物:5′-GATGAAGTGCA AAAGATGTGGATGG-3′,5′-CA GTAGAAGGTG TTGGCTTGGGATA-3′;ZO-1引物:5′-TCATCTCC AGTCCCTTACCTTTC-3′,5′-ATG GTTTTGTCT CATCATTTCCTCA-3′。按下列反应条件在RT-qPCR扩增仪上进行扩增。50℃ 2 min,95℃ 10min;95℃ 30 sec,60℃ 30 sec,40 cycles。绘制溶解曲线,最终数据以2-△△Ct进行分析。
1.6 免疫组织化学染色 取回肠组织,中性福尔马林固定,经酒精脱水,二甲苯透明后石蜡包埋、切片、脱蜡,置水后经3%双氧水浸泡清除内源性过氧化物酶,微波修复,分别滴加50μL ZO-1、claudin-1(Abcam,英国)、Occludin(Thermo Fisher,美国),室温过夜,滴加二抗,室温孵育30min,DAB显色,常规脱水透明,封片;每张切片随机选6个视野,利用KS400图像分析系统进行阳性率分析比较。
1.7 RT-qPCR检测Caco2细胞转染miR-223-mimics或inhibitor后紧密连接蛋白表达 按照Trizol法提取总RNA。测定其浓度与含量。取5μLRNA,逆转录成cDNA,从GenBank中检索出人Occludin、claudin-1、ZO-1所对应的cDNA序列。Primer5.0 软件设计出目的基因片段的引物序列。所有引物均有宝生物工程有限公司合成。ZO-1引物:5′-CTAAGG GAGCACATGGTGAAGGTAA-3′,5′-GTCGGGCA GAACTTGTATATGGTTT-3′;occludin引物:5′-CT TCACCCCCATCTGACTATGT-3′,5′-GTCGGGCA GAACTTGTATATGGTTT-3′;claudin-1引物:5′-G AAGATGAGGATGGCTGTCATTGGG-3′,5′-GGT AAGAGGTTGTTTTTCGGGGAC-3′。按下列反应条件在RT-qPCR扩增仪上进行扩增。50℃ 2 min,95℃ 10min;95℃ 30 s,60℃ 30 s,40 cycles。绘制溶解曲线,最终数据以2-△△Ct进行分析。
1.8 Western blotting检测Caco2细胞转染miR-223-mimics或inhibitor后紧密连接蛋白表达 总蛋白在含有蛋白酶抑制剂(Sigma-Aldrich,美国)的RIPA缓冲液中提取和溶解。用BSA检测试剂盒(Pierce, Rockford IL, USA)测定蛋白浓度后,从每个样品中提取总蛋白40 μg,用10% SDS-PAGE在70 V下分离30 min,再用110 V分离至最后,转移至PVDF膜(Millpore, USA)。膜与一抗在4℃孵育过夜(Abcam Technology,UK:claudin-1 1∶4000;occludin 1∶1500;Thermo Fisher科学公司,美国:ZO-1,1∶1000;Abcam技术,英国:GAPDH 1∶2000),然后与过氧化物酶结合二级抗体孵育(Boster生物技术,武汉,中国,1∶5000),室温1h,用增强化学发光(ECL)检测系统(Pierce,Rockford IL,USA)检测蛋白质条带,并用Image J软件进行密度测定。
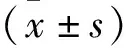
2 结果
2.1 实验动物一般情况和生化指标 术后尿毒症组(Group UR)大鼠逐渐表现活动量减少,对外界刺激反应迟钝,喜拱背蜷缩。食物摄入量减少,且体重增长速度减缓。毛色转黄干枯,疏松不齐,眼、耳、尾逐渐变苍白。假手术组(Group SH)活动灵活,毛色、眼、耳及尾部均无异常变化,食量随体重增长不断增加,尿量无异常改变。尿毒症组大鼠血肌酐、尿素氮、红细胞比容较对照组显著下降,而较尿毒症+益生菌组(Group UP)无显著差异,见表1。

表1 三组大鼠一般情况及实验室指标比较
2.2 肾组织病理学改变 尿毒症组和尿毒症+益生菌组大鼠肾小球结构紊乱,肾小球呈局灶或弥漫性球性硬化,部分肾小球代偿性增大,肾小管管腔内存在蛋白管型,肾间质见大量炎细胞浸润,纤维组织增生。假手术组大鼠肾小球结构清晰,毛细血管袢开放,无明显系膜增生,肾间质无炎细胞浸润及纤维组织增生(图1)。半定量分析显示,与SH组相比,UR组大鼠肾小球硬化指数评分(1.70±0.31 vs.0.27±0.11,P<0.01)和肾小管间质损伤指数评分(2.33±0.16 vs.0.48±0.15,P<0.01)明显升高,且平均肾小球直径更大(102.30±10.09 vs.78.83±4.67,P<0.01);UR组与UP组上述指标无差异。

图1 不同组大鼠肾脏病理学改变(苏木精-伊红染色,200×)
2.3 RT-qPCR检测肠组织中紧密连接蛋白和miR-223 mRNA的表达 与假手术组比较,尿毒症组肠组织中miR-223 和紧密连接蛋白ZO-1、occludin、claudin-1 mRNA显著降低,给予益生菌干预后可见miR-223表达较尿毒症组显著升高(P<0.01),同时紧密连接蛋白ZO-1、occludin、claudin-1 mRNA表达也较尿毒症组显著升高,见表2。

表2 三组大鼠肠组织miR-223、ZO-1、occludin、claudin-1 mRNA相对表达量比较
2.4 免疫组化观察ZO-1、occludin、claudin-1表达 利用免疫组化观察各组大鼠大鼠肠粘膜紧密连接蛋白表达及分布差异。可见,SH组肠粘膜表面紧密连接蛋白ZO-1、occludin、claudin-1棕色颗粒较多,粘膜表面和隐窝均有ZO-1、occludin、claudin-1分布;UR组肠上皮细胞间ZO-1、occludin、claudin-1棕色颗粒明显减少,提示表达下降;UP组ZO-1、occludin、claudin-1表达较UR组增加,见图2。

图2 三组大鼠回肠ZO-1、Occludin、claudin-1表达(400×)
2.5 RT-qPCR检测转染miR-223-mimics或inhibitor后Caco2细胞紧密连接蛋白mRNA表达 与对照组比较转染miR-223-mimics上调miR-223表达可以引起Caco2细胞中紧密连接occludin、claudin-1、ZO-1 mRNA表达水平升高;而转染miR-223-inhibitor下调miR-223表达可以导致紧密连接蛋白表达下降,见表3。

表3 Caco2细胞转染miR-223模拟物与抑制剂对紧密连接蛋白mRNA相对表达量影响
2.6 Western blotting检测转染miR-223-mimics或inhibitor后Caco2细胞紧密连接蛋白表达 与对照组比较转染miR-223-mimics上调miR-223表达可以引起Caco2细胞中紧密连接occludin、claudin-1、ZO-1 蛋白表达水平升高;而转染miR-223-inhibitor下调miR-223表达可以导致紧密连接蛋白表达下降,见图3。
3 讨论
近年来,越来越多的证据显示慢性肾脏病(chronic renal disease,CKD)特别是终末期肾病(end stage renal disease,ESRD)的肠屏障功能受损[1-3],其中一个最重要的机制是机体内尿毒症毒素升高破坏了肠上皮紧密连接蛋白(tight junction proteins,TJPs)(如claudin-1、occludin和ZO-1)的表达[11]。TJPs作为肠屏障重要组成部分对保持肠道通透性至关重要[12],其丢失会导致更多肠道产生的毒素进入机体,进一步加重肠屏障损伤,形成恶性循环。尽管TJPs受损在CKD中的作用被广泛认识,但其内在分子机制仍有待探索。在本研究中,我们发现伴随着尿毒症大鼠肠组织中紧密连接蛋白ZO-1、occludin、claudin-1 mRNA和蛋白水平显著降低,miR-233的表达水平亦显著下降;在给予益生菌干预后,miR-223表达升高,同时紧密连接蛋白ZO-1、occludin、claudin-1 mRNA表达亦显著升高。进一步的体外细胞实验显示,应用miR-223 mimics或者miR-223 inhibitor上调或下调miR-223的表达可以调控肠上皮Caco2细胞紧密连接蛋白ZO-1、occludin、claudin-1 mRNA及蛋白表达水平。我们的研究提示miR-223可能通过调控尿毒症肠上皮紧密连接蛋白参与尿毒症相关IBD。
miR-223是一种广泛表达的人类代谢性疾病标志物,亦被报道参与炎症、自身免疫等病理生理过程,其在心血管疾病、癌症中的作用已引起越来越多的关注[13]。肾脏疾病方面,先前研究表明CKD的小鼠模型及CKD晚期患者血清中miR-223下降[10],调节CKD患者miR-223可能发挥逆转此类患者血管钙化的作用。在本研究中,我们首次发现尿毒症肠上皮细胞miR-223表达下调,尽管未证实miR-223下调的机制,但根据既往文献报道,这可能与尿毒症毒素对miR-223的调控作用相关[14]。在本研究中,我们还发现,在使用益生菌干预后,伴随着miR-223上调,尿毒症中受损的肠道紧密连接蛋白表达水平亦明显改善,这一结果提示miR-223可能与尿毒症肠道紧密连接蛋白表达及尿毒症相关IBD存在相关性。
既往研究显示,miRNA不仅在胃肠道发育和生理功能中发挥重要作用,还在肠粘膜炎症反应、免疫耐受、先天免疫、肿瘤形成及肠上皮增殖、分化、凋亡等病理过程中发挥巨大作用[4-8]。已有研究证实异常表达的miRNAs参与了结肠炎等IBD相关疾病的发病机制[15-16],其中也包括miR-233。研究显示,miR-223可作为结肠炎患者的一种新型生物标志物[17],McKenna等[4]进一步证实,miR-223在实验性结肠炎中发挥重要保护作用。鉴于尿毒症患者有着与上述疾病相类似的肠道紧密连接蛋白受损表现,我们猜想,miR-223也可能在尿毒症相关IBD中发挥作用。因此,我们进一步在体外细胞实验中探索了miR-223对肠道紧密连接蛋白表达的调控作用,结果显示,下调的miR-223可引起肠道紧密连接蛋白ZO-1、occludin、claudin-1 mRNA及蛋白表达水平显著下降,反之,miR-223上调可使ZO-1、occludin、claudin-1 mRNA及蛋白表达水平显著上升。结合先前体内研究的结果,我们的研究表明miR-223可能通过对肠道紧密连接蛋白的调控参与尿毒症相关IBD。既往研究显示,紧密连接蛋白ZO-1、occludin和claudin-1的表达受NLRP3炎性小体的调控[18-20],而miR-223则被证实可直接结合于 NLRP3 mRNA 3′-UTR 区域,导致 NLRP3 mRNA 降解、蛋白表达量下降,起到抑制NLRP3炎症小体活性的作用[21-23]。因此,我们推测,miR-223可能通过靶向NLRP3调控紧密连接蛋白表达,但这一猜想仍需进一步体内外实验证实。此外,本研究还发现益生菌的干预改善了尿毒症大鼠肠组织中miR-223以及紧密连接蛋白ZO-1、occludin、claudin-1的表达。这一结果也为以益生菌改善维持性血液透析患者肠道失衡和降低尿毒症毒素的暴露[24]的学说增添了理论依据。
4 结论
本研究结果显示,miR-223在尿毒症大鼠肠组织中表达显著下降,下调的miR-223可能通过下调肠上皮紧密连接蛋白参与尿毒症相关IBD的发生发展。此外,益生菌的干预可以上调尿毒症肠上皮miR-223的表达,并改善紧密连接蛋白的表达。
