HBV相关慢加急性肝衰竭的预测模型*
2021-02-26林佳成马利节陈博武孙学华孔晓妮高月求
林佳成 马利节, 陈博武 孙学华 孔晓妮 高月求△
1.上海中医药大学附属曙光医院中心实验室 (上海, 200021) 2.上海中医药大学附属曙光医院肝病科
慢加急性肝衰竭(ACLF)是一种在慢性肝病基础上急性加重的临床综合征,以严重的系统性感染以及肝外多器官衰竭为特征,在短期内有50%~90%的死亡率[1,2]。多个国际医学团体对ACLF进行了定义,中国《肝衰竭诊治指南(2018年版)》[3]基本沿用了亚太肝病学会(APASL)[4]对ACLF的定义,认为ACLF是在慢性肝病基础上(根据是否存在肝硬化及肝硬化阶段分为3型)出现的急性黄疸加深[血清总胆红素(TBil)≥10×ULN或每日上升≥17.1 μmol/L]、凝血功能障碍[有出血表现、凝血酶原活动度(PTA)≤40%或凝血国际标准化比值(INR)≥1.5],合并有肝性脑病(HE)、腹水、电解质紊乱、感染等并发症及肝外器官功能衰竭。ACLF潜在患者众多,作为一种进展快速的疾病,我们需要有效的预测模型对临床乙型肝炎相关的慢加急性肝衰竭(HBV-ACLF)患者的状况及预后进行及时评估,以选择最佳的治疗方案。在西方国家,酒精性肝病是ACLF主要的病因,而在中国, HBV-ACLF占ACLF的70%[4,5]。因此,结合病因、种族和临床特征差异等多方面因素,有必要重新建立更加贴近HBV-ACLF预后的预测模型。目前已有多种可预测HBV-ACLF预后的模型相继被发表,本文将这些预测模型介绍如下。
1 ACLF经典预测模型
ACLF已有成熟且被公认的预测模型,这些模型虽然并非为HBV-ACLF所设,但是仍然对HBV-ACLF适用,并且也是考察新设立的模型准确度的重要评价标准。
1.1 终末期肝病模型(MELD)及MELD-Na MELD是以肌酐(Cr),INR,TBil结合病因进行评价的一种经典预测模型。MELD评分=3.8×In[TBil(mg/dl)]+11.2×ln(INR)+9.6 ln[Cr(mg/dl)]+6.4×(病因:胆汁性或酒精性0,其他1),MELD评分为30~40分的患者病死率在50%以上,MELD评分>40分的患者病死率在70%以上[6]。在此基础上将血清Na+浓度与MELD评分结合,形成了MELD-Na评分系统:MELD-Na评分=MELD+1.59×(135-Na+),当血清Na+水平>135 mmol/L时按135 mmol/L计算,<120 mmol/L时按120 mmol/L计算,120~135 mmol/L时按具体数值计算)。由于MELD没有优先考虑血液动力学和HE,低估了疾病的严重程度和死亡率,因此MELD评分在ACLF中应用备受质疑[8],而MELD-Na评分在评估患者病情和预测患者等待移植的死亡率方面提高了可预见性[9],MELD-Na评分优于单纯的MELD评分,而在预测患者移植后生存率方面,两者均存在一定的争议。
1.2 慢性肝衰竭-序贯器官衰竭评估(CLIF-SOFA) 欧洲肝脏研究学会(EASL)开发了基于顺序器官衰竭评估的CLIF-SOFA评分系统(表1)[10]。该标准侧重于多器官衰竭合并肝硬化,并被认为是ACLF患者疾病进展和死亡的独立危险因素。然而, 该标准定义的ACLF患者,主要集中在乙醇诱导的ACLF上,而不是HBV-ACLF。
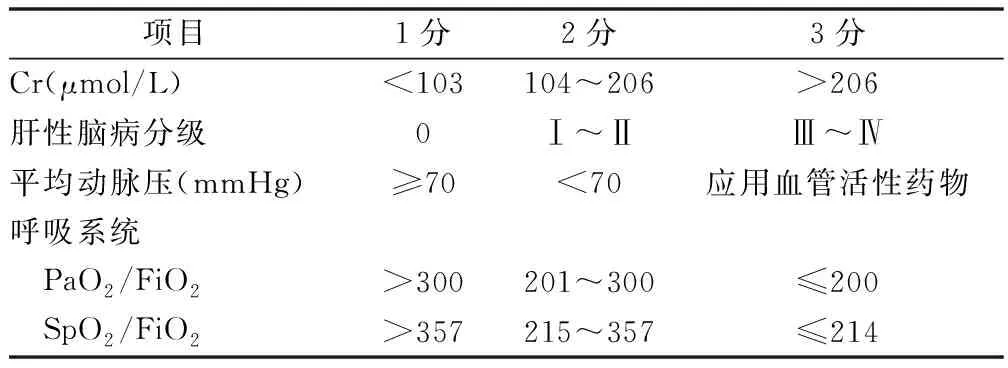
表1 CLIF-SOFA评分系统
1.3 慢性肝病联合器官衰竭评分系统(CLIF-COFs) CLIF-COFs是以CLIF-SOFA的评分系统为基础,旨在简化复杂的CLIF-SOFA。通过CLIF-COFs系统与年龄、白细胞计数两个独立预测指标进行组合,得出ACLF的特定预后评分CLIF-C ACLF。CLIF-C ACLFs=10×[0.33×CLIF-COFs+0.04×年龄+0.63×In(白细胞计数)-2][11]。
1.4 AARC-ACLF 亚太肝脏研究协会慢加急性肝衰竭研究小组评分(APASL-ACLF) AARC-ACLF则是针对亚洲ACLF人群建立的(表2),是一种动态评估模型[4]。分析国内ACLF患者[12]以及亚太多国HBV-ACLF的验证队列数据[13]显示,AARC评分对ACLF患者的28、90 d具有良好的预测价值,在临床易于使用,能动态预测且可靠。
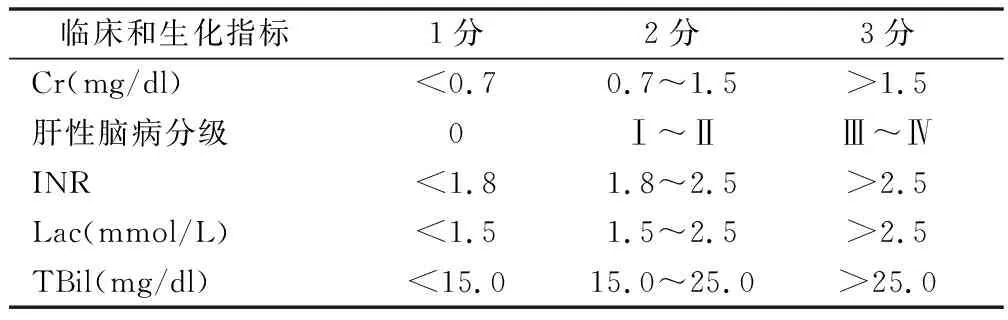
表2 AARC-ACLF评分系统
2 基于危险因子的模型
2.1 COSSH-ACLFs模型 中国重型乙型肝炎研究小组(COSSH)提出的COSSH-ACLFs模型最近被更新。结合CLIF-SOFA器官衰竭评价,INR、年龄、TBil水平,提出了新的COSSH-ACLFs模型,COSSH-ACLFs=0.741×INR+0.523×HBV-SOFA+0.026×年龄+0.003×TBil,通过外部队列研究验证,新的COSSH-ACLFs模型在28和90 d的对HBV-ACLF预后预测优于包含MELD评分、MELD-Na评分、CLIF-COFs在内的其他ACLF模型[14]。
2.2 基于危险因素的Logistic回归模型(LRM) 一项研究通过对来自单中心的204例患者临床数据进行多元逻辑回归分析,发现肝肾综合征、肝硬化、HBeAg、白蛋白和凝血酶原活性是预测HBV-ACLF预后的独立因素,随后在此基础上建立预测预后的LRM:Py=e^x/(1+e^x)X=1.405 3+3.601 7×肝肾综合征+1.206 9×肝硬化-1.155 5×HBeAg-0.100 3×白蛋白-0.042×凝血酶原活性,该研究声称在预测ACLF-HBV患者3个月死亡率方面优于MELD评分系统[15]。
2.3 基于甲胎蛋白(AFP)的线性预测因子模型 一项研究通过分析来自双中心的333例患者临床数据,经单因素和多因素分析后发现年龄、AFP、TBil、血小板计数(PLT)和INR是HBV-ACLF患者预后不良的独立危险因素。基于逻辑回归建立HBV-ACLF患者预后的线性预测因子(LP)公式:LP-ACLF =-5.04-0.056×年龄-0.002×AFP-0.010×PLT + 0.002×TBil + 0.877×INR,该模型对于HBV-ALCF患者90 d预后具有较好的预测和校正价值[16]。
2.4 基于甲状腺激素的HINT模型 为阐明甲状腺激素在HBV-ACLF中的作用,有研究基于来自单中心的199例患者进行分析,通过HE、INR、中性粒细胞计数和促甲状腺激素(TSH)建立新型预后评分:HINT评分=1.48×HE+3.92×ln(INR)+0.73×ln(中性粒细胞计数)-0.46×ln(TSH)-5.78。结果显示HINT评分(n=426)在非幸存者中显著升高(1.17±2.38,P<0.0001),30 d死亡率的AUROC为0.889,明显高于MELD、CLIF-SOFA评分(P<0.05)。据此证实TSH动态监测有助于预测ACLF的疾病进程[17]。
2.5 基于机器学习的人工神经网络(ANN)模型 ANN是一种基于机器学习的分析系统,在结构和功能上模拟生物神经系统,已被广泛用于管理非线性复杂生物系统。有研究小组建立了基于机器学习的ANN模型[18]。在ANN训练过程中,输入具有统计学意义的差异或重要临床特征的变量和独立的危险因素,最终确立了以年龄、HE、血清钠、凝血酶原活动度、γ-谷氨酰转移酶、乙型肝炎e抗原、碱性磷酸酶和TBil为基础的ANN模型,模型可从https://zsg.github.io/ditan_zxyjh/获取,通过验证队列分析,该模型对HBV-ACLF患者28和90 d预后的预测精度高于MELD、 MELD-Na评分系统等预测模型。
3 基于ACLF特征的预测模型
3.1 基于并发症的TPPMs评分 并发症是ACLF中重要的危险因素,并发症提示患者病情的加重,并与预后密切相关,基于单中心研究的283例临床数据,单因素分析显示,腹水、HE、自发性腹膜炎、肝肾综合征和食管出血静脉曲张对ACLF的结局具有预测价值。因此基于并发症,结合血液指标建立了TPPMs评分系统:P=1/(1+e-Logit(P));Logit(P)=0.003×[TBil(μmol/L)] +0.951×INR+2.258×(并发症常数:0,无或有1个并发症;1,有2个或以上并发症)+0.114×[lg HBV DNA(copies/ml)]-5.012。当P=1,患者死亡;如果P>0.5,患者将要死亡。该模型被多项研究再次验证,TPPMs的预测能力优于包括MELD在内的多种评分系统[13,19]。
3.2 基于系统性炎症的RNTIC模型 全身炎症反应与肝功能衰竭的发展和预后密切相关。一项回顾性研究收集了来自单中心的577例临床病例,多因素分析临床资料和实验室检测指标,发现红细胞分布宽度(RDW)、中性粒细胞/淋巴细胞比率(NLR)、INR、TBil和Cr是HBV-ACLF患者90 d死亡的危险因素,以此建立了RNTIC模型:Cox-RNTIC=0.053×RDW+0.027×NLR+0.003×TBil+0.317×INR+0.003×Cr,并且该评分较MELD、MELD-Na评分系统对 HBV-ACLF患者预后具有更强的预测能力[20]。
3.3 基于肝再生的TACIA评分 肝脏是一个可再生的器官,在ACLF发生时,肝细胞再生能力将影响预后。一项研究对单中心的308例临床病例进行多因素Cox回归分析,证实Cr、年龄、TBil、AFP和INR是独立的预后因素,并在此基础上建立了TACIA评分:TACIA 评分=0.003×TBil(μmol/L)+0.036×年龄+0.009×Cr(μmol/L)+0.525×INR-0.003×AFP(ng/ml)。结果表明, TACIA评分较低(<4.34) 的患者可能比TACIA评分较高(≥4.34) 的患者存活时间更长。即TACIA评分高的患者可能存在更严重的肝功能衰竭,甚至合并多器官衰竭,肝再生能力将减弱[21]。
4 展望
目前已有多种HBV-ACLF预测模型被提出,并且通过验证队列与现有的ACLF预测模型进行比较。各项研究声称在其研究范围内,这些模型有着较高的准确度。基于临床危险因素建立的模型是目前最为主流的模型建立方式,但是这些研究往往是单中心研究。另一方面由于检测试剂和检测仪器造成的测量偏倚是目前临床研究仍需解决的问题,鉴于预后预测模型的可行性,应当使用目前检测中偏倚较小的生物标志物。通过多中心的临床数据进行预测因子的分析可能是解决方法。值得注意的是,多中心研究所得结果往往导向更为简单的预测模型。目前的研究中多中心合作仍较为缺乏,单中心研究难以获得可靠的结果,多中心的密切合作以及临床数据的共享更具有建设性的。此外,机器学习也是一个面向未来,具有当下时效性的解决方案,临床疗法的重大更新可能对疾病治疗和患者特征产生深远的影响,因此,通过不断补充的临床数据进行优化,并确定最佳的预测指标和相关系数,建立符合当下患者特征的预测模型是未来的研究方向。
以HBV-ACLF患者病理特征出发结合血清学指标建立模型,以期获得临床和病理机制的统一。这类模型或许可以快速反映HBV-ACLF病情的变化,并从局部特征出发进行快速预警,但是此类模型的价值仍需进一步验证。由于多种独立危险因素逐渐被揭示,基于特异性标志物的HBV-ACLF预测模型逐渐被提出。相反的,考虑到HBV-ACLF患者的临床特征异质性,以特异性标志物出发可能存在严重的误判。因此局部特异性生物标志物与肝脏学指标结合,是目前最为常见的模型公式。
综合来看,考虑到临床ACLF的复杂性,临床上通过多种预测模型判断病情或许是可接受的。多种模型的同时应用,从不同维度对疾病预后进行判断,这或许有利于局部特异性模型作为补充模型进行应用,为临床决策提供更多参考,但同时应当考虑到公式过多以及过于复杂的模型将难以在床旁使用。因此进行临床决策的HBV-ACLF预测模型需要被权衡。
