六西格玛管理用于药物临床试验启动前流程优化的初步探讨
2021-02-25叶林淼
叶林淼
药物临床试验(drug clinical trial)是指任何在人体(患者或健康志愿者)进行药物的系统性研究,以证实或揭示试验药物的作用、不良反应和(或)试验药物的吸收、分布、代谢和排泄,目的是确定试验药物的疗效与安全性[1]。药物的研发周期很长,其中临床试验阶段一般需要5~9年[2]。提高临床试验效率,减少不必要的等待时间,既能使广大患者早日获得新的治疗选择,又能为医药企业带来巨大的经济效益[3]。2017年10月,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,意见提出要改革临床试验管理,加快上市审评审批[4]。医院机构作为临床试验实施方,从申办方开始项目调研至项目启动期间,药物临床试验机构如何做到高质量、高效率对项目进行管理,是一个值得探讨的课题[5]。2019年11月,“广东肿瘤试验联盟”在第9届广东省药学会药物临床试验专业委员会学术年会上宣告成立,该联盟成立的目的之一,是探索肿瘤临床试验项目立项、伦理审查及合同等环节的标准化流程设置,进而缩短医药企业的药品研发转化周期[6]。1986年,摩托罗拉公司的比尔·史密斯提出六西格玛管理(Six Sigma),通过DMAIC模式持续对企业的流程进行严格和高质量的管理,是一种新型、高效的质量管理方法[7-8]。DMAIC包括界定(Define),确定问题;测量(Measure),对既往流行进行评估;分析(Analysis),分析问题根本原因;改进(Improve),针对问题进行改进;控制(Control),巩固新流程。
六西格玛管理在许多领域均得到广泛应用,例如研发管理、生产管理、供应链管理及人事管理等[9-12]。随着中国加入WTO,六西格玛管理在国内也逐渐流行,其中在医疗领域也有许多应用,通过DAMIC模式医院管理流程、临床医疗各环节质量和患者满意度方面均有明显改善[13-15]。2018年7月,广东省揭阳市人民医院通过国家药物临床试验机构资格认定,共14个专业具备开展临床试验资格。截至2019年12月,医院共开展药物临床试验12项。药物临床试验机构办公室(以下简称“机构办”)致力于做好项目管理和服务工作,并一直关注项目立项审查、合同审查等启动前耗时环节的改进。本文结合六西格玛DAMIC模式,对项目立项、合同两个耗时环节进行探索,旨在提高机构办项目启动前工作的效率,以更好管理、服务临床试验。
1 六西格玛管理
1.1 准备阶段 2019年3月,机构办人员和CRC共4人组成讨论小组,共同学习六西格玛管理知识,认识该管理方法的实践意义。
1.2 立项环节
1.2.1 界定阶段:经过成员小组讨论,确定以下问题为目前影响立项环节速度的主要原因。(1)资料递交:项目资料递交过程中,机构办发现部分项目资料盖章混乱,例如应申办方盖章的资料盖了CRO公司红章。此外,不同项目递交的立项资料目录不一致,导致机构办秘书形式审查耗时长。(2)立项审查:项目指定1名主审审查,再经过立项讨论小组会审决定是否立项。由于立项审查需召集人员开会,不能保证每个项目均能及时上会讨论。
1.2.2 测量阶段:(1)资料递交:机构办提供的立项资料未对盖章提出明确要求。机构办虽提供了资料提交要求和目录模板,但部分CRA的主观能动性不够,例如项目不产生的文件,目录中未删除。(2)立项会审:立项讨论小组由机构办人员、药师、临床医师组成。临床医师由于临床工作繁忙,不一定能在约定时间抽空参会,导致会议需要推迟或改期。
1.2.3 分析阶段:讨论小组采用根本原因循环分析法(见图1)从各个角度进行探讨,确定更可能缩短时间的步骤,同时寻找导致立项资料递交耗时和会议延迟的根本原因。经过讨论,认为资料递交环节比上会审查环节能更节省时间。分析发现会议需要推迟原因在于妇科医师需出门诊,通常无法在会议约定时间前完成患者诊疗工作;会议改期是因为项目指定的主审为外科医师,外科医师在约定时间由于急诊手术无法参会。
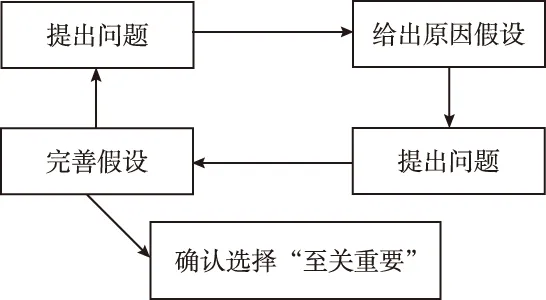
图1 根本原因循环分析法
1.2.4 改进阶段:(1)资料递交:机构办进一步细化立项资料递交要求,包括统一立项资料封面、添加填写指引及明确盖章要求等。确保CRA看到立项资料要求后,直观了解机构办对每一份资料的要求,节约了双方针对资料准备的沟通时间,同时避免因提交不符合要求资料因更换而导致立项时间延长。(2)立项审查:立项讨论出现时间推迟与改期均是出于客观原因,目前只能做到提前通知尽量撮合成员时间避免会议改期。
1.2.5 控制阶段:机构办将细化的立项资料递交要求以制度流程形式进行约定,使立项递交资料的改进成果得以维持并持续改进。
1.3 合同环节 我院项目合同包括两种:临床试验合同(主合同)和CRC合同。合同洽谈的时间长短取决于申办方/CRO、医院和SMO公司的反馈速度,本文仅探讨医院在合同审查上可改进的环节。
1.3.1 界定阶段:主合同审查时间较长主要集中于第一轮审查,初审需要14 d左右;CRC合同不存在耗时长的问题。
1.3.2 测量阶段:主合同审核耗时原因之一在于医院未制定合同模板,申办方/CRO公司既有国内、国外药企或外资CRO,特别是具有外资背景的企业,合同审查需要花费更长时间。CRC合同采用医院模板,为三方合同。合同约定费用由申办方/CRO公司支付给SMO公司,医院不参与费用收付,因此初审和后续洽谈的效率均较高。
1.3.3 分析阶段:讨论小组同样采用根本原因循环分析法(见图1)进行探讨。经过讨论,主合同耗时长的原因还包括重复审查,即机构办人员审核两次再到机构办主任审核;此外合同经费由于没有固定模板导致机构办合同审核时间延长。
1.3.4 改进阶段:主合同审核流程改为机构版秘书审核条款部分、机构办财务专员审核经费部分,汇总后再由机构办主任进行全面审核。采取该流程后,合同一般1周内即能完成一轮审查。经费部分机构办综合现有项目的经费计算特点,形成医院的经费模板,采用该模板加速了财务专员、机构办主任审核经费的时间。
1.3.5 控制阶段:与立项环节一致,机构办同样将合同审核流程通过“合同审核的SOP”进行约定,使改进成果得以维持并持续改进。
2 总 结
综上所述,通过六西格玛管理DAMIC模式对临床试验启动前的立项审查、合同审查两个关键环节进行流程优化,取得了初步成果。由此可见六西格玛管理在临床试验管理各环节流程的优化是可行的,既可保证临床试验质量,又能提高效率。可作为新成立的药物临床试验机构流程优化的管理工具,持续提高机构的管理水平。
